刺五加过氧化氢酶基因的克隆与表达分析
2014-01-22邢朝斌修乐山龙月红
邢朝斌,刘 岩,修乐山,龙月红,吴 鹏
(河北联合大学 生命科学学院,河北 唐山 063000)
植物细胞正常代谢过程中,氧分子作为重要的电子受体,在传递电子时,通常还伴随着部分电子逃逸出氧化还原系统,产生氧化能力极强、具有毒害作用的H2O2[1]。同时,植物在遭受病原菌胁迫及逆境胁迫时也可产生大量H2O2[2]。H2O2的过量积累可导致膜脂过氧化,抑制卡尔文循环的关键酶,从而对细胞造成较大的伤害,另外H2O2还可以直接作为氧化剂对植物组织产生毒害作用[3]。过氧化氢酶(Catalase,CAT)广泛存在于动植物中,对于H2O2具有较高亲和力,可有效地清除线粒体电子传递、脂肪酸氧化等过程中产生的H2O2,参与植物的多种胁迫反应,如抗病、抗旱、耐盐等,并与植物老化也有一定的关系[3-4]。因此,植物CAT对维持植物氧化还原平衡和抵御胁迫方面具有重要的作用[5]。
刺五加Eleutherococcus senticosus(Rupr.et Maxim)Maxim是我国传统的珍贵药用植物,具有多种生理活性及药理作用[6]。一般认为包括病原菌及干旱、低温等在内的各种胁迫条件对药用植物次生代谢产物的形成具有重要的影响[7]。因此,克隆参与多种胁迫反应的刺五加CAT基因并分析其表达情况,对揭示其次生代谢产物产量差异形成的分子机理具有重要意义。但目前关于刺五加的研究多集中在直接参与其次生代谢产物生物合成的关键酶基因方面[8-10],尚未见关于刺五加CAT基因的相关报道,致使相关工作难以开展。文中利用cDNA末端快速扩增(Rapid Ampli fi cation of cDNA Ends,RACE)技术克隆到刺五加CAT基因的全长cDNA序列,并分析了其在不同生长发育时期、不同器官中的表达,旨在为深入研究CAT对刺五加生长及次生代谢的影响提供理论依据。
1 材料与方法
1.1 试验材料
供试刺五加采自黑龙江省鸡西市。分别以萌芽期(4月26日)、叶片完全展开期(5月26日)、盛花期(6月26日)、果实快速生长期(7月26日)、果实基本成熟期(8月26日)、叶片衰老期(9月26日)的叶片和8月16日的叶片、叶柄、幼茎和根作为提取RNA的试材。
1.2 试验方法
1.2.1 刺五加总RNA的提取和CAT基因保守区的获得
根据植物总RNA提取试剂盒的说明,分别提取刺五加1~10号样本的总RNA。利用Oligo(dT)18引物,以2μL的总RNA为模板,按照RevertAidTMFirst strand cDNA synthesis Kit的步骤说明,分别将各样本的总RNA逆转录为cDNA。以逆转录获得的刺五加cDNA为模板,利用简并上游引物CATS1:5′- GGAAACAA(C/T)TTCCCTGTC -3′和简并下游引物 CATX1:5′- ACCTC(C/T)TC(A/G)TCCCTGTGC -3′,PCR扩增刺五加CAT基因的保守区核苷酸序列。反应体系50μL,其中LA Taq酶0.6μL,上下游引物各 1μL,cDNA 3μL,2.5mmol·L-1dNTP 4μL,10×LA Taq Buffer 5μL,补 ddH2O 至 50μL。反应条件为:95℃,5min;95℃,1min;51.5℃,40s;72℃,50s。35个循环后72℃补充延伸10min。扩增产物经1.5%琼脂糖凝胶电泳、回收后,克隆入PGM-T质粒载体,转化大肠杆菌TOP10。将转化成功的菌株送Invitrogen公司测序。
1.2.2 RACE技术获取刺五加CAT基因cDNA 的末端序列
根据所获得的刺五加CATcDNA核苷酸序列,应用Primer premier 5.0设计5′RACE扩增刺五加CAT基因,5′末端序列的特异性引物CAT52:5′-TCTGGGTGGTGGGAGAAGAAGT-3′和CAT51:5′-GTGAGACTTTGGACTGGGTTTA-3′,及3′RACE 扩增刺五加CAT基因3′末端序列的特异性引物CAT32:5′- TGCCCTGCT ATTATCGTTCCTG -3′和 CAT31:5′- CGCTCATC ACAACAATCACCAT -3′。参照罗聪等[11]的方法,取刺五加总RNA 3μL,逆转录合成cDNA第1链后,利用5′RACE技术扩增CAT基因cDNA的5′末端序列。参照3′-Full RACE core set Ver.2.0试剂盒说明,进行3′RACE扩增。参照1.2.1中的方法电泳、回收、克隆、测序。
1.2.3 刺五加CAT基因全长的拼接、验证与生物信息学分析
将获得的刺五加CAT基因的5′、3′末端序列和保守区序列导入DNAMAN 6.0软件,进行拼接,获得刺五加CAT基因cDNA的全长序列。根据拼接获得的序列,设计扩增包含CAT基因起始密码子的上游引物CATQS:5′-CTCATCAAACAATCCGTCTC-3′和 包 含 终 止密码子的下游引物CATQX:5′-CTCTTTCTCGCA ATCAACAG-3′,PCR扩增CAT基因的 cDNA全长序列,预计扩增1 558 bp。反应条件为:95℃,5min;95℃,1min;55℃,40s;72℃,100s。30个循环后72℃补充延伸10min。PCR扩增体系与1.2.2中相同。参照文献[12]中的方法,利用DNAMAN 6.0、PROSITE、ProtParam、PSORT和SOPMA软件进行生物信息学分析。使用MEGA 5.21软件中的Neighbor-Joining法构建系统发育树。
1.2.4 刺五加CAT基因的表达分析
参照文献[12]中的方法,利用预计扩增CAT基因长度为168 bp的上游引物CATRTS:5′- CTGCCCTGCTATTATCGTTCC-3′,下 游 引 物CATRTX:5′-AAGCCTTCATGGTGATTGTTGTG-3′,和预计扩增刺五加GAPDH基因长度为134 bp的引物RGS和RGX,进行表达量分析。
2 结果与分析
2.1 刺五加CAT基因的克隆
以刺五加的cDNA为模板,利用简并引物CATS1和CATX1进行PCR扩增后,测序获得1条长761 bp的条带(见图1)。经NCBI的BLAST比对,确定该序列为刺五加CAT基因cDNA的部分序列。利用CAT52和CAT51引物,5′RACE扩增后,测序获得CAT基因长633 bp的5′末端cDNA序列(见图1)。利用CAT32和CAT31引物,3′RACE扩增后,测序获得CAT基因长551 bp的3′末端cDNA序列(见图1)。将所获得的保守区片段与5′、3′末端cDNA序列进行拼接,发现该序列包含刺五加CAT基因的完整开放阅读框(ORF)。利用CATQS和CATQX引物,以刺五加的cDNA为模板,PCR扩增后,测序获得1条长1 558 bp的条带(见图1),与预期大小相符。且该序列与拼接获得的序列完全相同。
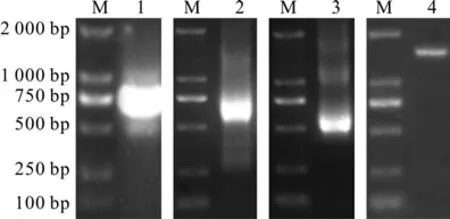
图1 刺五加CAT基因的克隆Fig.1 Clone of CAT gene from E.senticosus
2.2 刺五加CAT基因的生物信息学分析
刺五加CAT基因全长1 840 bp(GenBank登录号:KF498592),其中5′端非翻译区(5′UTR)长 138 bp,3′端非翻译区(3′UTR)长 223 bp,终止密码子为TGA,开放阅读框(ORF)长1 479 bp,3′末端具有poly A尾,编码492个氨基酸残基构成的蛋白质。预测的蛋白质相对分子质量为56.689 1 kD,理论等电点(pI)为7.11。氨基酸序列与人参Panax ginseng、可可Theobroma cacao和枣树Ziziphus jujuba的同源性分别达到96.5%、96.3%和96.3%。通过NCBI的BLAST比对发现,刺五加的CAT蛋白与其它物种的CAT具有相似的功能结构域。刺五加CAT的14~492氨基酸残基处为CAT家族的基本轮廓,54~70(FDRERIPERVVHARGAS)氨基酸残基处为近CAT活性位点保守序列,344~352(RIFSYADTQ)氨基酸残基处为近血红素配体保守序列,484~486(SRL)氨基酸残基处为典型的PTS1(peroxisomal targeting signal)motif,480~482(QKL)氨基酸残基处为典型的PTS1-like motif。刺五加CAT蛋白不存在跨膜螺旋,定位于过氧化物酶体。刺五加CAT蛋白的二级结构中含有137个α螺旋,占27.85%;78个延伸链,占15.85%;31个β折叠,占6.30%;246个无规则卷曲,占50.00%。
2.3 刺五加CAT蛋白的分子系统进化分析
利用MEGA 5.21软件,将GenBank中登载的13个物种的CAT蛋白与刺五加的CAT蛋白进行聚类分析,构建CAT蛋白的系统进化树(见图2)。刺五加与同为五加科的人参亲缘关系最近,首先聚为一支,可信度99%。之后其它双子叶植物聚在一起,进而与裸子植物聚为一个大的分支。单子叶植物单独聚为一个分支后与双子叶植物和裸子植物聚在一起。这与传统的分类结果相一致。
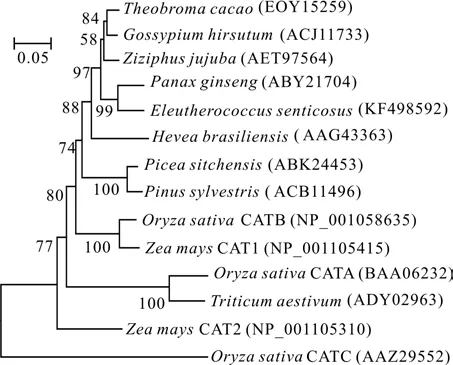
图2 CAT蛋白的系统进化树Fig.2 Phylogenetic tree of CAT protein
2.4 刺五加CAT 基因的表达分析
刺五加CAT基因在不同生长发育时期和器官中的表达量变化如图3所示。自萌芽开始的整个生长期中,CAT基因均有表达,但表达量差异显著(P<0.05)。在整个生长期中,CAT的表达呈现先高后低的变化趋势。萌芽期、叶片完全展开期、盛花期和果实快速生长期的表达量较高,果实基本成熟期和叶片衰老期的表达量较低。其中盛花期的表达量最高,果实基本成熟期的表达量最低,前者是后者的1.28倍。
刺五加的CAT基因在叶片、叶柄、幼茎和根中均有表达,但表达量具有显著差异(P<0.05)(见图3)。最大表达量出现在叶柄中,叶片和根次之,茎中的表达量最低。最高表达量为最低表达量的1.48倍。
3 结论与讨论
本试验中所克隆的刺五加CAT基因包含完整的ORF,与人参、可可和枣树等的CAT基因的序列同源性均在90%以上,其编码蛋白具备CAT超家族的标志性序列特征,说明刺五加的CAT基因的cDNA全长序列被成功克隆。一般认为多数CAT在被翻译后,通过识别PTS1进入过氧化物酶体发挥生物学功能[3]。刺五加CAT蛋白484~486位(SRL)的PTS1 motif与拟南芥、冬枣CAT的PTS1 motif序列相同,且均位于距离CAT蛋白C末端上游的第7~9位氨基酸残基处,行使增强CAT向过氧化物酶体转运效率的功能[13]。而480~482位(QKL)的PTS1-like motif,为CAT家族的C端保守序列,在CAT与PTS1受体蛋白Pex5p的相互识别中发挥着重要的作用[14]。
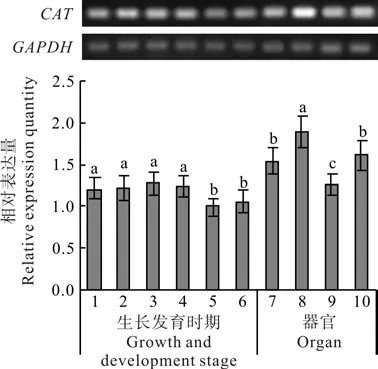
图3 刺五加不同生长发育时期及器官中CAT基因的表达变化Fig.3 Expression variations of CAT gene during different growth and development stages and in different organs of E.senticosus
根据CAT表达的时空特点,可将CAT分为在光合组织中高表达的类型I、在维管组织中高表达的类型II和在生殖组织与生殖时期高表达的类型III[15]。系统进化分析的结果表明,刺五加的CAT与属于类型III的玉米CAT1、水稻CATB[15]的亲缘关系显著近于其它2种类型。同时表达量的分析结果也表明,刺五加的CAT在不同生长发育时期均有表达,但盛花期的表达量最高的特点也与同属类型III的人参CAT相符[16]。因此,初步判定研究所克隆的刺五加CAT属类型III。
已有的研究表明,CAT的表达受植物的发育时期、组织和器官类型的显著影响。刺五加CAT自萌芽后开始至果实快速生长期始终高表达的特点与玉米中同属类型III的CAT1在幼叶期至授粉后21~30d始终高表达[17]的特点完全相符。而刺五加CAT在叶柄中表达量最高,叶片中相对较低的特点则与人参CAT[16]的表达规律相同。
[1] 陈金峰,王宫南,程素满.过氧化氢酶在植物胁迫响应中的功能研究进展[J].西北植物学报,2008,28(1):188-193.
[2] Iwamoto M,Higo H,Higo K.Strong expression of the rice catalase gene CatB promoter in protoplasts and roots of both a monocot and dicots[J].Plant Physiol Biochem,2004,42(3):241-249.
[3] 林星谷,孔德仓,庞晓明,等.冬枣过氧化氢酶基因的克隆及表达分析[J].西北植物学报,2012,32(6):1086-1092.
[4] 吴丽君,李志辉,邹 峰.水分胁迫对珍贵树种赤皮青冈幼苗生理特性的影响[J].中南林业科技大学学报,2012,32(7):10-13.
[5] Willekens H,Chamnongpol S,Davey M,et al.Catalase is a sink for H2O2and is indispensable for stress defence in C3plants[J].EMBO J,1997,16(16):4806-4816.
[6] 张宝香,姜 英,张雅凤.刺五加叶研究新进展[J].特产研究,2009,31(4):69-70,77.
[7] 陈美兰,黄璐琦,欧阳少华,等.植物内生菌对道地药材形成的影响[J].中国中医药信息杂志,2006,13(9):40-42.
[8] 许若娴,曹福祥,彭继庆,等.云南萝芙木异胡豆苷合成酶基因的克隆与分析[J].中南林业科技大学学报,2012,32(6):128-131.
[9] 邢朝斌,龙月红,劳凤云,等.刺五加鲨烯合酶基因的表达及其对皂苷含量的影响[J].经济林研究,2013,31(1):25-29.
[10] 邢朝斌,孟春燕,修乐山,等.不同性别刺五加中皂苷合成酶基因的表达及其与皂苷含量的相关性[J].经济林研究,2013,31(3): 81-85.
[11] 罗 聪,何新华,陈 虎,等.一种高效获取基因5′末端的RACE方法[J].植物生理学报,2011,47(4):409-414.
[12] 邢朝斌,龙月红,劳凤云,等.内生真菌对刺五加皂苷合成关键酶基因表达及皂苷含量的影响[J].中国中药杂志,2012,37(14): 2041-2045.
[13] Hu J,Baker A,Bartel B,et al.Plant peroxisomes: biogenesis and function[J].Plant Cell,2012,24(6):2279-2303.
[14] Kamigaki A,Mano S,Terauchi K,et al.Identification of peroxisomal targeting signal of pumpkin catalase and the binding analysis with PTS1 receptor[J].Plant J,2003,33(1):161-175.
[15] Mhamdi A,Queval G,Chaouch S,et al.Catalase function in plants: a focus onArabidopsismutants as stress-mimic models[J].J Exp Bot,2010,61(15):4197-4220.
[16] Purev M,Kim Y J,Kim M K,et al.Isolation of a novel catalase(Cat1)gene from Panax ginseng and analysis of the response of this gene to various stresses[J].Plant Physiol Biochem,2010,48(6): 451-460.
[17] Wadsworth G J,Scandalios J G.Differential expression of the maize catalase genes during kernel development: the role of steady-state mRNA levels[J].Dev Genet,1989,10(4):304-310.
