酪蛋白非磷酸肽对大豆多肽的修饰及复合物的乳化性表征
2014-01-20黄文秀郭庆启石彦国
黄文秀,郭庆启,石彦国,张 娜,*
酪蛋白非磷酸肽对大豆多肽的修饰及复合物的乳化性表征
黄文秀1,郭庆启2,石彦国1,张 娜1,*
(1.哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.东北林业大学林学院,黑龙江 哈尔滨 150040)
通过Plastein反应利用酪蛋白非磷酸肽(casein non-phosphopeptides,CNPPs)对大豆多肽进行修饰,对制备出的CNPPs-大豆多肽复合物进行电泳、乳化性质和微观结构分析。结果表明:反应最佳工艺参数为:反应温度42 ℃、pH 4.8、时间3 h、凝乳酶添加量5 g/100 mL,该最优条件下产物的产率为(45.26±0.62)%,电泳结果证实CNPPs和大豆多肽发生了组合。对复合物功能性评价发现,CNPPs-大豆多肽复合物乳化性为0.28±0.02,乳化稳定性为(13.44±0.47)min,均高于大豆多肽的乳化性和乳化稳定性。微观结构较未修饰的大豆多肽呈现出更多的、均一的球形乳化微粒,证实通过CNPPs对大豆多肽的修饰可以有效提高蛋白质的乳化性和乳化稳定性。
酪蛋白非磷肽;大豆多肽;复合物;乳化性;微观结构
酪蛋白是乳中含量极为丰富的蛋白质,其蛋氨酸(Met)的含量约占总酪蛋白的3.26%,这些Met主要存在于酪蛋白非磷酸肽(casein non-phosphopeptides,CNPPs)部分,每100 g CNPPs含Met约3.1 g[1]。CNPPs是酪蛋白磷酸肽(casein phosphopeptides,CPPs)制备过程中的副产物,以疏水性氨基酸为主,随着CPPs商业化进程的不断 加深,大量的CNPPs也就相应生成。CNPPs目前主要作为3 类重要的生物活性肽的原料:免疫调节肽、抗氧化活性肽、抑制血管紧张素转化酶活性肽[2],但这些研究均处于实验室初级阶段,生产过程中有近80%的CNPPs未被合理利用,作为饲料或废物弃去,如何充分利用CNPPs资源具有很大的经济效益,也具有一定的社会效益[3-4]。
大豆蛋白作为大豆中含量最为丰富的优质植物蛋白质,水解产生的肽类具有抗氧化、抑制ACE、免疫调节、抗血栓、抗致病菌和促进双歧杆菌增殖等功能,在国内外食品科学研究和应用领域被广泛关注。但是,有两 大方面不足是其发展的瓶颈。一是从营养学角度看,大豆蛋白的氨基酸组成中含硫氨基酸(主要是Met)含量极低(仅为1.0~1.4 g/100 g),Met在人体内与ATP结合生成S-腺苷蛋氨酸,人体内无法自身生成,一旦缺乏会导致体内蛋白质合成受阻,引起生长减缓,肾脏肿大和肝脏铁堆积,最后导致肝坏死等一系列机体损害。为了弥补大豆蛋白中Met含量过少的缺陷,很多科研人员在大豆蛋白中添加游离Met,不过,游离Met在加工过程中不稳定,容易产生不良气味,而且容易和食品中的其他成分反应[3],简单的添加游离Met的方法是不可行的。二是从应用角度来看,大豆蛋白的乳化性、乳化稳定性、溶解性、胶凝性等功能性质欠佳。国内外科学家纷纷对大豆蛋白进行修饰,修饰的方法包括物理方法[5-6]、化学方法[7]和酶法[8-9],采用酶法对蛋白质进行修饰具有安全、可控等多方面优势[10],但酶法改性过程有诸多含疏水性氨基酸侧链的苦味肽伴随产生,这使得大豆蛋白的功能性缺陷和风味缺陷之间存在此消彼长的关系。因此本课题组考虑利用富含Met的副产物进行再利用,同大豆蛋白的疏水区域进行温和融合,二者在酶的作用下形成一种新的类蛋白复合物,从而促使大豆蛋白的营养组成更加完善同时确保其具有良好的功能性质。利用酶将一种物质同大豆蛋白质相结合,在改善蛋白质功能性方面表现出来巨大的潜力,并能提供新的蛋白质资源,已经引起了日本、美国以及欧洲国家的广泛关注,已成为食品蛋白质领域研究热点之一[11]。
有科研人员曾经对酪蛋白酸钠和大豆蛋白之间的结合状况进行研究[12-14],结果发现表面疏水性是影响二者结合的至关重要的因素[12]。因此,研究过程对大豆蛋白水解形成的大豆多肽的表面疏水性进行调控,以期促进其与CNPPs发生最大化的正向复合。本实验采用胰凝乳酶催化CNPPs对大豆多肽进行修饰研究,通过测定CNPPs-大豆多肽复合物的乳化性和乳化稳定性进行考察,并对复合物的亚基变化和微观结构进行表征,判断CNPPs修饰下大豆多肽的乳化特性,为大豆蛋白的酶法改性以及新的优质大豆蛋白资源的开发和CNPPs重新被利用提供理论参考。
1 材料与方法
1.1 材料、试剂与仪器
CNPPs和大豆多肽溶液 本实验室制得。
Maxiren-180胰凝乳酶(10 000 U/g,食品级) 荷兰代夫特DSM公司;其他所用试剂均为分析纯。
AL204型电子天平、DELTA 320型精密pH计 梅特勒-托利多中国有限公司;722型分光光度计 上海精密
科学仪器有限公司;FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;FOSS2094型均质机 上海东华仪器有限公司;HH-4型数显恒温水浴锅 国华电器有限公司;电泳仪和电泳槽 北京六一仪器厂。
1.2 方法
1.2.1 CNPPs-大豆多肽复合物的制备

图1 CNPPs-大豆多肽复合物制备过程示意图Fig.1 Flowchart for the preparation of CNPP-soybean polypeptide complexes
CNPPs-大豆多肽复合物制备过程如图1所示。将质量浓度为80 g/100 mL的CNPPs与一定表面疏水性的60 g/100 mL大豆多肽以一定的时间、pH值、温度、体积比为1∶1,加入一定质量浓度为0.001 g/mL胰凝乳酶溶液,调控形成复合反应体系,充分搅拌,不断监测重组产物的产率和反应体系的透光率,进而判断CNPPs与大豆多肽的复合效果。
1.2.2 各因素对CNPPs-大豆多肽复合物的影响
1.2.2.1 时间对CNPPs-大豆多肽复合物的影响
固定pH 4.4、温度42 ℃、加酶量3 g/100 mL,分别在时间为1、2、3、4、5、6 h条件下进行反应,计算CNPPs-大豆多肽复合物的产率和反应体系透光率。
1.2.2.2 pH值对CNPPs-大豆多肽复合物的影响
固定温度为42 ℃、加酶量3 g/100 mL、时间为5 h, pH值分别为4.0、4.4、4.8、5.2、5.6条件下进行反应,计算CNPPs-大豆多肽复合物的产率和反应体系透光率。
1.2.2.3 温度对CNPPs-大豆多肽复合物的影响
固定时间5 h、加酶量3 g/100 mL、pH 4.4,温度分别为34、38、42、46、50 ℃条件下进行反应,计算CNPPs-大豆多肽复合物的产率和反应体系透光率。
1.2.2.4 加酶量CNPPs-大豆多肽复合物的影响
固定时间5 h、温度42 ℃、pH 4.4,加酶量分别为1、2、3、4、5、6、7、8、9 g/100 mL进行反应,计算CNPPs-大豆多肽复合物的产率和反应体系透光率。
1.2.3 CNPPs-大豆多肽复合物产率测定
反应结束后取沉淀通过过滤、干燥后称质量,记录CNPPs和大豆多肽的干质量,计算CNPPs-大豆多肽复合物的产率。

1.2.4 反应溶液透光率的测定
在反应过程中每小时取反应体系上、中、下不同位置溶液,分别以蒸馏水为空白,在722型分光光度计,波长400 nm处测其透光率。
1.2.5 CNPPs-大豆多肽复合物的特性研究
1.2.5.1 电泳表征
将大豆多肽、CNPPs、反应产物分别分散于含1%十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、1%巯基乙醇的磷酸溶液(0.01 mol/L,pH 6.8)中,配制成的样品中蛋白质质量浓度1 mg/mL。利用12.5%分离胶(含尿素4.7%),5%浓缩胶,阴极缓冲液为含0.1% SDS的Tris-HCl缓冲液(0.074 mol/L,pH 7.4),阳极缓冲液为含0.2% SDS的Tris缓冲液(1 mol/L,pH 7.8),使用前稀释5 倍。电泳上样量12 μL,电泳电流为恒定20 mA。电泳结束后在50%甲醇,0.054%甲醛水溶液中固定1 h后,用考马斯亮蓝R250染色1 h后进行脱色,进行电泳分析。
1.2.5.2 功能性测定
采用Surówka等[15]的分光光度法测定产物的乳化性和乳化稳定性[16]。
1.2.5.3 透射电镜表征
将干燥的大豆多肽、CNPPs、CNPPs-大豆多肽、CNPPs-大豆多肽复合物粉末分别用超纯水稀释30 倍,超声20 min,移取20 μL样液于洁净电镜观测台表面,将覆有聚乙烯醇缩甲醛膜的铜网浸入样品溶液吸附10 min,再用滤纸吸去铜网周边多余的液体。将pH 6.5的1%磷钨酸滴于洁净表面,负染1.5 min后用滤纸吸去多余液体,待样品晾干后利用透射电子显微镜在100 kV的加速电压下对经磷钨酸染色的样品进行观测。
1.3 统计分析
数据采用SPSS 13.0软件进行方差分析(analysis of variance,ANOVA),结果以3 次测量的±s表示。
2 结果与分析
2.1 CNPPs-大豆多肽复合物的制备
2.1.1 反应时间对CNPPs-大豆多肽复合物制备的影响
CNPPs-大豆多肽的产量是判断CNPPs和大豆多肽复合效果的主要判断依据。本实验中,在不同因素和水平下分别从反应溶液的上、中、下取样进行透光率的测定,并分析反应产物的产率,从而寻找出二者之间的关系,为快速判定复合终点提供依据。
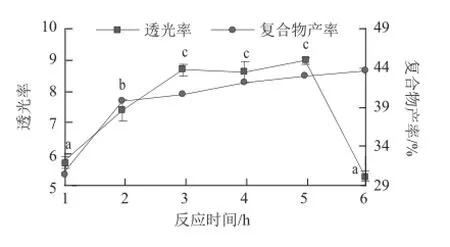
图2 反应时间对CNPPs-大豆多肽复合物的影响Fig.2 Effect of reaction time on CNPP-soybean polypeptide complexes
反应时间对CNPPs-大豆多肽复合物的影响结果如图2所示,当CNPPs与大豆多肽反应溶液的透光率增加时,CNPPs-大豆多肽复合物产量也不断增加,说明反应体系中更多的CNPPs与大豆多肽发生了聚合,使体系溶液更加澄清,复合物产量增加。随着反应时间的延长,反应体系的透光率先显著增加然后保持不变;CNPPs-大豆多肽复合物也同样发生了先显著增长、后期变化不显著的趋势。根据不同反应时间下溶液的透光率和复合物的产率,选择复合反应时间为3 h,此条件下反应得到的CNPPs-大豆多肽的产率为42.10%,溶液透光率为8.68±0.20。反应3~5 h内,溶液的透光率和复合物的产率变化均不显著(P>0.05),而反应达到6 h时,溶液的透光率又出现显著下降(P<0.05),反应6 h时,CNPPs-大豆多肽复合物很可能在胰凝乳酶作用下发生二次降解,导致溶液的透光率有所降低。
2.1.2 反应pH值对CNPPs-大豆多肽复合物制备的影响

图3 反应pH值对CNPPs-大豆多肽复合物的影响Fig.3 Effect of reaction pH on CNPP-soybean polypeptide complexes
不同反应pH值对CNPPs-大豆多肽复合物制备的影响结果如图3所示。反应体系的pH值为4.4时,体系的透光率达到最大值,但当反应体系的pH值为4.8时,CNPPs-大豆多肽组复合物的产率最高,达到40.70%,这种变化规律与胰凝乳酶的酶学特性以及pH环境对CNPPs和大豆多肽吸引程度构成很大的影响。由于胰凝乳酶的最适作用pH值是4.2,所以,当反应体系的pH值调整到4.4时,胰凝乳酶作用效果很好,促使溶液中的大豆多肽和CNPPs发生迅速聚集,使反应体系澄清度增加,透光率增大(P<0.05),但这个情况下很可能一些迅速聚集起来的CNPPs-大豆多肽复合物过小,没有形成大的整体,从目前的实验结果来看,pH 4.8的反应体系下,CNPPs和大豆多肽结合程度要稍好于其他pH环境。因此,将反应体系的pH值确定为4.8。
2.1.3 反应温度对CNPPs-大豆多肽制备的影响

图4 反应温度对CNPPs-大豆多肽复合物的影响Fig.4 Effect of reaction temperature on CNPP-soybean polypeptide complexes
不同反应温度对CNPPs-大豆多肽复合物制备的影响结果如图4所示。随着体系温度的改变,溶液的透光率和复合物均出现先增加后降低的变化趋势。在体系温度为42 ℃时,溶液透光率和复合物的产率均出现最大值,温度超过42 ℃的反应环境下,当反应3 h时,体系中酶可能存在较大的失活现象,导致结合过程不够充分。
2.1.4 加酶量对CNPPs-大豆多肽制备的影响
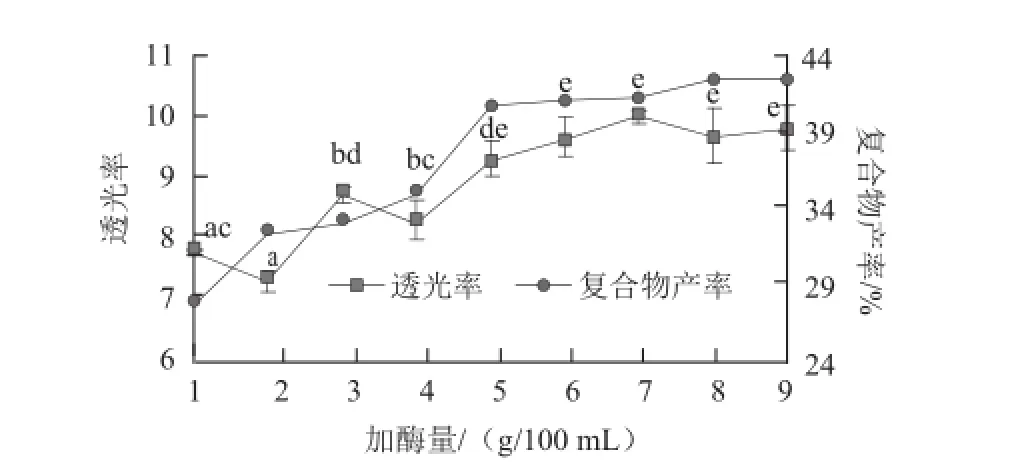
图5 加酶量对CNPPs-大豆多肽复合物的影响Fig.5 Effect of rennin dosage on CNPP-soybean polypeptide complexes
加酶量对CNPPs-大豆多肽制备的影响结果如图5所示。加酶量的不断增加导致体系中透光率和复合物的产率均出现不断增长的变化趋势,不过,当酶添加量大于5 g/100 mL时,这种增长逐渐缓慢(P<0.05),因此考虑采用5 g/100 mL的胰凝乳酶添加量促进CNPPs和大豆多肽的复合正向发生。
当采用胰凝乳酶添加量5 g/100 mL、反应体系pH 4.8、反应温度42 ℃、反应3 h时,得到的CNPPs-大豆多肽复合物的产量为(45.26±0.62)%。
2.2 CNPPs-大豆多肽复合物电泳分析
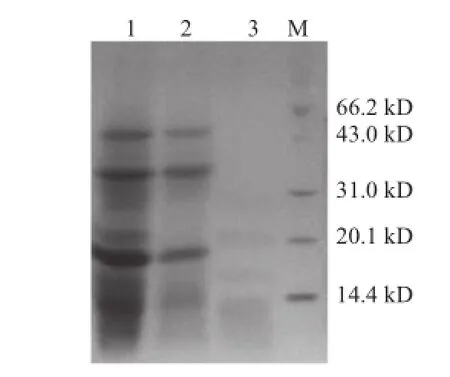
图6 大豆多肽-CNPPs复合物电泳图Fig.6 Electrophorsis of CNPP-soybean polypeptide complexes
对CNPPs、大豆多肽以及CNPPs-大豆多肽复合物进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析,结果如图6所示。CNPPs-大豆多肽复合物中分子质量在50.2、37.6、18.8 kD处的条带主要由大豆多肽提供(泳道1、2),CNPPs在此分子质量范围内并无条带生成,而CNPPs在分子质量22.5 kD和16.8 kD处出现两条颜色较浅的条带,CNPPs-大豆多肽复合物也恰好在这两处出现亚基(泳道1、3),CNPPs在分子质量14.4 kD以下的条带呈连续分布,这也使得CNPPs-大豆多肽复合物在该分子质量范围比大豆多肽出现更深的亚基条带。结果初步表明,CNPPs-大豆多肽复合物极有可能是由CNPPs和大豆多肽共同形成的产物。
2.3 大豆多肽复合物特性的评价
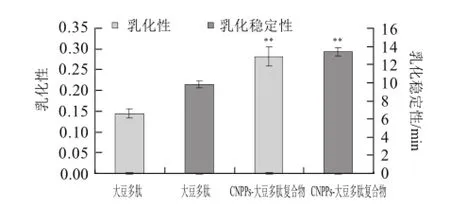
图7 CNPPs-大豆多肽复合物乳化性能评价Fig.7 Emulsibility and emulsion stability of CNPP-soybean polypeptide complexes
对大豆多肽以及CNPPs-大豆多肽复合物进行乳化性和乳化稳定性进行评价,结果如图7所示。利用Plastein反应所得到的CNPPs-大豆多肽复合物的乳化性和乳化稳定性分别为0.28±0.02和(13.44±0.47)min,比本研究中未经CNPPs修饰大豆多肽的乳化性和乳化稳定性极其显著地分别提高了90%和37%(P<0.000 1)。同其他研究者对于大豆蛋白的乳化性能方面的研究比较发现,殷军等[17]利用脱脂豆粕醇洗,晾干制作的大豆浓缩蛋白的乳化性约为0.01、乳化稳定性为10.50 min;物理改性得到的大豆浓缩蛋白的乳化性约为0.14、乳化稳定性为11 min;采用碱溶酸沉法制备得到的大豆分离蛋白的乳化性约为0.06,乳化稳定性约为15 min。顾振宇等[18]使用用醇洗大豆浓缩蛋白经物理改性,喷雾干燥制得改性大豆浓缩蛋白的乳化性0.135、乳化稳定性为11.68 min。CNPPs-大豆多肽复合物的乳化性和乳化稳定性比一些研究结果稍有提高。
2.4 透射电镜技术对CNPPs-大豆多肽复合物的表征

图8 大豆多肽(a)、CNPPs(b)、CNPPs-大豆多肽复合物(c)的透射电镜结果(×100 000)Fig.8 Transmission electron microscopic profiles of soybean peptide (a), CNPPs (b) and CNPP-soybean peptide complexes (c) (× 100 000)
用透射电镜观察大豆多肽、CNPPs、CNPPs-大豆多肽复合物颗粒的表面,如图8所示。由图8a可知,大豆多肽微观结构相对致密,可见大小不等的圆形及不规则形塌陷,这与大豆多肽热处理过程可能存在一定的关系。图8b显示,CNPPs微观结构呈现疏松,无规则状态,结构中存在明显的不规则孔隙。而图8c中所呈现的CNPPs-大豆多肽复合物的微观结构与大豆多肽和CNPPs有相似之处,CNPPs-大豆多肽复合物结构中既存在大面积不规则塌陷,又存在无规则孔隙,这也进一步证实了SDS-PAGE的结论,即CNPPs-大豆多肽复合物是CNPPs和大豆多肽结合所形成的共同体。同时,CNPPs-大豆多肽复合物的微观结构与大豆多肽和CNPPs之间存在显著的不同,CNPPs-大豆多肽复合物微观结构表面存在直径为40~60 nm的球形结构,该微球尺寸显著小于目前其他研究者对于大豆蛋白乳化微球的研究结果[8,19-20],这可能与电镜分析前处理过程中所使用的化学试剂存在一定关系。不过,从图8a、c比较来看,CNPPs-大豆多肽复合物溶解后所形成的的乳化微粒显著多于大豆多肽,也间接证明CNPPs对大豆多肽修饰后产物的乳化性和乳化稳定性有所提高。
3 结 论
对CNPPs-大豆多肽复合物制备工艺参数进行单因素试验,优化后的最优工艺参数为:时间为3 h、pH值为4.8、温度为42 ℃、加酶量为5 g/100 mL。按此工艺参数进行验证实验,CNPPs-大豆多肽复合物的产率高达(45.26±0.62)%。对CNPPs-大豆多肽复合物的乳化特性评价,乳化性为0.28±0.02,乳化稳定性为(13.44±0.47)min,优于未经CNPPs修饰的大豆蛋白。SDS-PAGE和透射电镜均显示,CNPPs-大豆多肽复合物较大豆多肽在结构上发生了改变,有新的亚基生成,这是大豆多肽和CNPPs在一系列物理化学变化下发生组合的结果。
[1] 赵一明. 酪蛋白非磷酸肽的制备及其ACE抑制活性的研究[D]. 无锡: 江南大学, 2008.
[2] 刘剑虹, 庞广昌, 于金华, 等. 酪蛋白磷酸肽(CPPs)的纯化研究[J]. 食品科学, 2006, 27(4): 31-35.
[3] PARK O, SWAISGOOD H E, ALLEN J C. Calcium binding of phosphopeptides derived from hydrolysis of αs-casein and β-casein using immobilized trypsin[J]. Diary Science, 2006, 81: 2850-2857.
[4] 唐胜球, 董小英. CPPs的功能及其在饲料工业上的应用[J]. 广东饲料, 2002(3): 31-33.
[5] PUPPO M C, SPERONI F, CHAPLEAU N, et al. Effect of highpressure treatment on emulsifying properties of soybean proteins[J]. Food Hydrocolloids, 2005, 19: 289-296.
[6] LI Fang, KONG Xiangzhen, ZHANG Caimeng, et al. Effect of heat treatment on the properties of soy protein-stabilised emulsions[J]. International Journal of Food Science and Technology, 2011, 46(8): 1554-1560.
[7] MATEMU A O, KAYAHARA H, MURASAWA H, et al. Improved emulsifying properties of soy proteins by acylation with saturated fatty acids[J]. Food Chemistry, 2011, 124: 596-602.
[8] CHEN Lin, CHEN Jianshe, REN Jiaoyan, et al. Modifications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J]. Food Hydrocolloids, 2011, 25: 887-897.
[9] ZHANG Jinbo, WU Nana, YANG Xiaoquan, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids, 2012, 28: 301-312.
[10] 张雅丽, 王凤翼, 宋世廉, 等. 蛋白质酶法修饰的初步探讨: 大豆蛋白和芝麻蛋白的合成类蛋白质研究[J]. 食品与发酵工业, 1994(2): 8-13.
[11] KATO H, SUZUKI T. Bradykinin-potentiating peptides from the venom of Agkistrodon halys. Isolation of five bradykinin potentiators and the amino acid sequences of two of them, potentiators B and C[J]. Bochemistry, 2010, 10(6): 972-980.
[12] 唐传核, 杨晓泉, 陈中, 等. 微生物转谷氨酰胺酶的蛋白质底物催化特性及其催化机理研究(Ⅲ)MTGase催化多底物蛋白的聚合特性[J]. 食品科学, 2003, 24(7): 26-32.
[13] LEE H A, CHOI S J, MOON T W. Characteristics of sodium caseinateand soy protein isolate-stabilized emulsion-gels formed by microbial transglutaminase[J]. Journal of Food Science, 2006, 71(6): 352-357.
[14] WATANABE Y, SHIRASE Y, AOKE H, et al. Emulsion stabilizing properties of soy protein isolates mixed with sodium caseinates[J]. Journal of Food Science, 1984, 49(1): 212-216.
[15] SURÓWKA K, ŻMUDZIŃSKI D, SURÓWKA J. Enzymic modification of extruded soy protein concentrates as a method of obtaining new fynctional food components[J]. Trends in Food Science and Technology, 2004, 15(3): 153-160.
[16] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15: 263-269.
[17] 殷军, 华欲飞, 陆健健, 等. 大豆蛋白乳化性能比较及机理探讨[J].中国油脂, 2005 (5): 35-38.
[18] 顾振宇, 江美都, 付道才, 等. 大豆分离蛋白乳化性的研究[J]. 中国粮油学报, 2000, 15(3): 32-35.
[19] KASRAN M, STEVE W, CUI H, et al. Emulsifying properties of soy whey protein isolate-fenugreek gum conjugates in oil-in-water emulsion model system[J]. Food Hydrocolloids, 2013, 30(2): 691-697.
[20] NAKAMURA A, TAKAHASHI T, YOSHIDA R, et al. Emulsifying properties of soybean soluble polysaccharide[J]. Food Hydrocolloids, 2004, 18: 795-803.
Soybean Polypeptide Modification by Casein Non-phosphopeptides (CNPPs) and Emulsification Properties of the Resulting Complexes
HUANG Wen-xiu1, GUO Qing-qi2, SHI Yan-guo1, ZHANG Na1,*
(1. Key Laboratory of Food Science and Engineering of Heilongjiang Province, College of Food Science and Engineering, Harbin University of Commerce, Harbin 150076, China; 2. School of Forestry, Northeast Forestry University, Harbin 150040, China)
Casein nonphosphopeptides were used to modify soybean polypeptide by plastein reaction. The resulting CNPP-soybean polypeptide complexes were studied by SDS-PAGE and their emulsifying properties and microstructure were investigated. The optimum reaction conditions were found to be reaction at 42 ℃ and pH 4.8 for 3 h with added rennin at 5 g/100 mL, resulting in a yield of products of (45.26±0.62)%. SDS-PAGE demonstrated that CNPPs bound to soybean polypeptide. The functionality evaluation of CNPP-soybean polypeptide complexes showed the emulsibility and emulsion stability to be 0.28±0.02 and (13.44±0.47) min, respectively, both of which were higher than those of soybean polypeptide. The miscrostructure showed a larger number of homogeneous spherical microemulsion particles than that of unmodified soybean polypeptide, illustrating that the modification of soybean polypeptides by CNPPs can increase the protein emulsibility and emulsiion stablity effectively.
casein nonphosphopeptides (CNPPs); soybean polypeptides; complex; emulsifying characteristics; microstructure
TS201.2
A
1002-6630(2014)09-0157-05
10.7506/spkx1002-6630-201409032
2013-06-27
国家自然科学基金青年科学基金项目(31301602);“十二五”农村领域国家科技计划项目(2012BAD34B04);黑龙江省应用技术研究与开发计划项目(2013G0558);黑龙江省高校科技创新团队建设计划项目(2010td11)
黄文秀(1989—),女,硕士研究生,研究方向为食品科学。E-mail:1129635023@qq.com
*通信作者:张娜(1979—),女,副教授,博士,研究方向为食品化学与食品安全。E-mail:foodzhangna@163.com
