萝卜苗发芽过程中营养物质的动态变化
2014-01-20周晨光罗云波
周晨光,朱 毅,罗云波
萝卜苗发芽过程中营养物质的动态变化
周晨光,朱 毅*,罗云波
(中国农业大学食品科学与营养工程学院,北京 100083)
通过测定抚顺红与盛丰白萝卜苗中芥子油苷、花青素、VC、总酚含量以及抗氧化能力,探究萝卜种子在发芽过程中营养物质的动态变化。结果表明:除盛丰白幼苗中4-甲硫基-3-丁烯基硫代芥子油苷的 含量随着发芽过程而增加外,抚顺红与盛丰白萝卜苗中其余种类的芥子油苷含量均逐渐下降。抚顺红与盛丰白幼苗生长5 d后总酚含量较萝卜种子中分别下降61.62%和43.93%,之后2 d的含量变化趋于稳定。抚顺红与盛丰白萝卜种子中均未检测到VC,但随着发芽过程的进行,生长7 d的幼苗中VC含量分别增加至65.81 mg/100 g和52.48 mg/100 g。
萝卜;发芽;芥子油苷;抗氧化活性
大量研究结果表明,提高萝卜、西兰花、卷心菜、甘蓝等十字花科蔬菜的摄入量能够明显降低癌症发病率,其主要原因是十字花科蔬菜中含量丰富的芥子油苷(glucosinolates)在加工烹饪过程中能够降解成为抑癌效果显著的异硫氰酸盐(isothiocyanates)[1]。近些年来研究人员发现,相比于成熟的蔬菜,十字花科植物5~7 d的幼苗中芥子油苷含量更高。除此之外,十字花科芽苗菜还富含类胡萝卜素、VC、酚类化合物等营养物质,是一种经济、理想的新型食材资源[2]。然而由于饮食差异的原因,欧美研究人员主要针对西兰花和甘蓝等芽苗菜的营养价值展开研究;而国内关于萝卜幼苗的研究文献主要集中在芥子油苷的分离鉴定,针对萝卜种子萌发生长至芽苗菜这一阶段中营养价值的动态变化鲜有报道。鉴于此,本实验以盛丰白和抚顺红两种北京地区常见的红、白萝卜品种为对象,探究萝卜种子在发芽过程中芥子油苷、花青素、VC以及总酚等营养物质的含量变化情况,旨在为萝卜芽苗菜的深度开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
抚顺红、盛丰白萝卜种子由北京京研盛丰种苗研究所提供。
DEAE Sephadex A-25、2-丙烯基芥子油苷(sinigrin)、硫酸酯酶(sulphatase) 美 国Sigma公司;甲醇、乙腈(均为色谱级) 美国Tedia公司;福林-酚试剂、没食子酸、醋酸、三氯化铁、2,4,6-三(2-吡啶基)三嗪(2,4,6-tripyridyl-S-triazine,TPTZ)、硫酸亚铁 国药集团化学试剂有限公司。
1.2 仪器与设备
PGX型光照培养箱 宁波莱福科技有限公司;DK-98-I恒温水浴锅 天津市泰斯特仪器公司;HZC-250恒温振荡培养箱 江苏太仓实验设备厂;5424R Eppendorf离心机 德国艾本德公司;M200 Pro多功能酶标仪 奥地利帝肯公司;Agilent 1200型液相色谱仪、Agilent 1260-6460三重串联四极杆液质联用仪(LC-DAD-ESI/MS)美国安捷伦公司。
1.3 方法
1.3.1 萝卜苗的栽培
分别挑选颗粒饱满、无霉变的抚顺红和盛丰白两个品种的萝卜种子各30 g,经5 mL/L次氯酸钠溶液浸泡消毒30 min后,蒸馏水浸泡10 h。浸泡后的种子均匀播撒在30 cm×20 cm的育苗盘内,育苗盘内铺有3 张相应规格的衬纸以防育苗过程中水分过度流失。种子在23 ℃的黑暗条件下避光催芽2 d后,转移至 12 h/ d 的光照条件下培育生长,昼/夜温度24 ℃/20 ℃,相对湿度 75%~80%。为尽可能减少条件干扰,用适量蒸馏水每8 h浇 灌一次萝卜苗。在0~7 d的育苗过程中,萝卜苗每24 h取样1 次,样品置于液氮中快速冷冻,经封口袋包装置于-80 ℃超低温冰箱保存,待后续分析。
1.3.2 芥子油苷的测定[3]
1.3. 2.1 芥子油苷的提取与纯化
称取0.1 g冻干样品,加入5 mL 70%的甲醇溶液以及0.5 mL 20 mmol/L的2-丙烯基芥子 油苷内标,85 ℃水浴提取10 min后,加入0.2 mL 0.5 mol/L 的醋酸铅溶液,4 ℃、4 000 ×g离心20 min,取上清液流经DEAE Sephadex A-25 (50 mg)离子交换柱。待提取液全部流出后,向离子交换柱内加入200 μL已活化的硫酸酯酶,封口反应12 h。待离子交换柱内芥子油苷转化为脱硫态后,用3 mL超纯水将脱硫态芥子油苷从离子柱内洗脱下来,洗脱液经0.45 μm微膜过滤,待色谱分析。
1.3.2.2 高效液相色谱法(high performance liquid chromatography,HPLC )分离条件
色谱柱:Agilent C18柱(2.1 mm×150 mm,3.5 μm);流动相A:超纯水;流动相B:乙腈;梯度洗脱条件:0~1 min,乙腈0%;1~21 min,乙腈体积分数梯度增加至20%; 21~26 min,乙腈体积分数逐渐降低至0%;26~31 min,乙腈体积分数保持为0%。流速0.3 mL/min;检测波长229 nm;进样量10 μL;柱温:30 ℃。以2-丙烯基芥子油苷为内标计算芥子油苷的含量,结果以μmol/g表示。
1.3.2.3 质谱条件
通过LC-DAD-ESI/MS对芥子油苷进行鉴定。离子源:电喷雾电离(electrospray ionization,ESI);离子极性:正离子模式;雾化器压力:60 psi;干燥气温度:350 ℃;毛细管电压:4 000 V;扫描离子范围质荷比(m/z):100.00~600.00。
1.3.3 花青素含量的测定
参照Teng等[4]的方法,称取0.2 g样品,加入2 mL含1% HCl的甲醇溶液,4 ℃振荡提取24 h后,4 ℃、12 000×g离心20 m in,取上清液在530 nm和657 nm波长处测定吸光度。花青素相对含量按下式计算。
花青素相对含量=A530nm-1/4A657nm
1.3.4 VC含量的测定
参照Pugliese等[5]的方法并加以改进,称取 0.5 g样品,在5 mL 1%的草 酸溶液中振荡提取15 min,4 ℃、12 000×g离心10 min,吸取上清液经0.45 μm 微膜过滤,待HPLC分析。HPLC条件:Agilent C18色谱柱 (4.6 mm×250 mm,5 μm),流动相为0.1%的草酸溶液,流速1.0 mL/min,进样量20 μL,检测波长245 nm。用不同质量浓度的VC标准品制作标准曲线,按照外标法计算样品中VC的含量。
1.3.5 总酚含量的测定[6]
取0.3 g样品加入3 mL 95%的乙醇溶液,黑暗条件下室温振荡提取48 h,12 000×g 离心10 min,取0.1 mL上清液加入0.1 mL福林酚试剂、1 mL蒸馏水以及0.3 mL 0.7 mol/L Na2CO3溶液。静置2 h,在 765 nm波长测量吸光度,以没食子酸为标样制作标准曲线,结果以每100 g鲜质量样品中含有的没食子酸当量(gallic acid equivalent,GAE)(mg GAE/100 g)来表示。
1.3.6 抗氧化能力测定(ferric reducing antioxidant power,FRAP 法)[7]
吸取总酚提取液0.3 mL至1.5 mL FRAP工作液(0.3 mol/L pH 3.6的醋酸溶液、0.02 mol/L三氯化铁溶液、0.01 mol/L TPTZ溶液按照体积比10∶1∶1混匀,该溶液需现配现用),加入3 mL蒸馏水,37 ℃水浴30 min后,在593 nm波长处测定吸 光度。以硫酸亚铁溶液为标样做标准曲线,以达到同样吸光度所需硫酸亚 铁的量来计算样品FRAP值(mmol/g),以鲜质量计。
1.4 数据统计与分析
本实验数据均采用SPSS 16.0软件进行单因素方差分析和Duncan’s多重比较检验。实验结果以来表示(P<0.05)。
2 结果与分析
2.1 萝卜苗中芥子油苷的定性定量分析
以生长5 d的萝卜苗为例,抚顺红和盛丰白两个品种的幼苗中脱硫芥子油苷HPLC色谱图如图1所示。将HPLC所分离的峰逐一经质谱(mass spectrometry,MS)鉴定,得到了萝卜苗中不同芥子油苷的MS图谱(图2)。含有不同侧链结构的芥子油苷,在电喷雾碰撞激活时很容易丢失一个葡萄糖分子,形成一个MS信号很强的碎片离子[M-G+H]+,这是鉴定芥子油苷种类的有效依据[8]。同时,芥子油苷也易与H+、Na+和K+等离子结合形成碎片离子,这些信号起到 了鉴定芥子油苷种类的辅助作用[9]。参照Bennett等[10]和Zimmermann等[3]的研究,本实验检测到抚顺红萝卜苗中含有的3 种芥子油苷,即4-甲基亚磺酰基-3-丁烯基硫代芥子油苷(glucoraphenin),吲哚-3-甲基芥子油苷(glucobrassicin)以及4-甲氧基吲哚-3-甲基硫代芥子油苷(4-methoxy-glucobrassicin);对于盛丰白萝卜苗而言,除上述3种芥子油苷外,还含有4-甲硫基-3-丁烯基硫代芥子油苷(glucoraphasatin)。
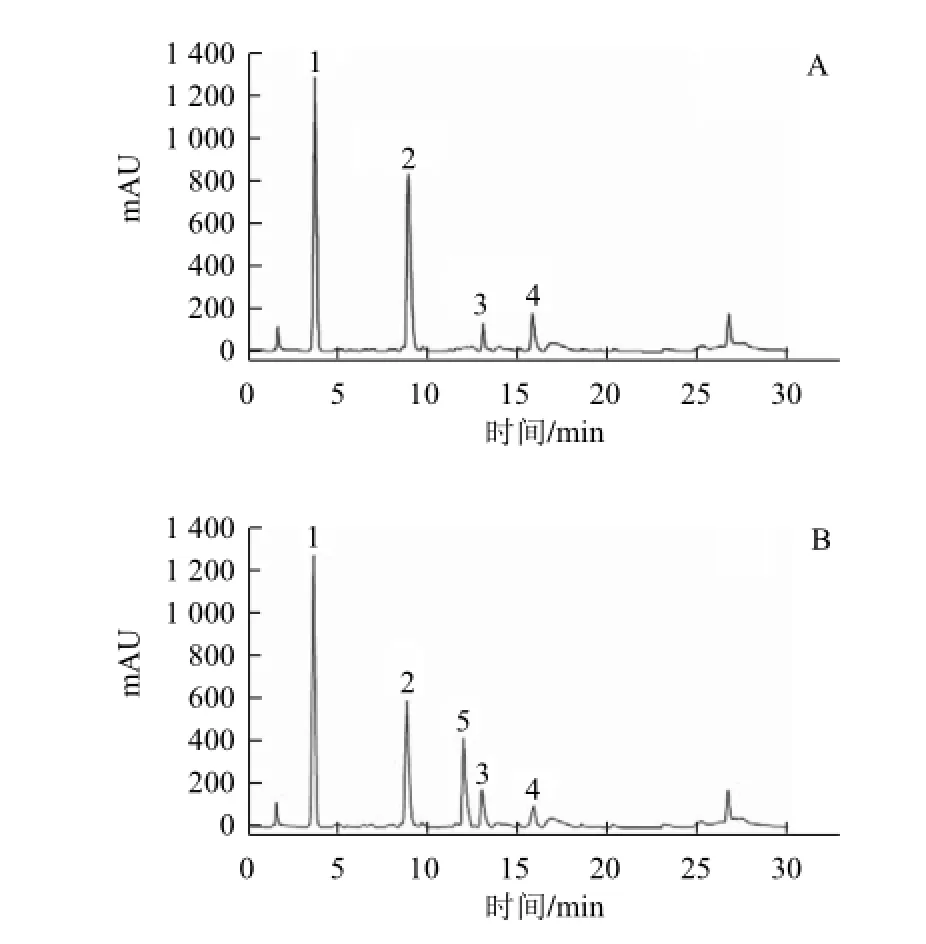
图1 生长5 d的抚顺红(A)和盛丰白(B)幼苗中脱硫芥子油苷的HPLC色谱图Fig.1 HPLC profiles of individual desulpho-glucosinolates in 5-day-o ld sprouts of ‘Fushunhong’ (A) and ‘Shengfengbai’ (B)
以2-烯丙基芥子油苷(sinigrin)为内标物,对抚顺红和盛丰白萝卜苗中已鉴定出的芥子油苷进行定量分析,结果如表1所示。抚顺红和盛丰白萝卜种子中的芥子油苷主要为4-甲基亚磺酰基-3-丁烯基硫代芥子油苷,分别占芥子油苷总量的92.91%和94.12%。随着种子的萌发,4-甲基亚磺酰基-3-丁烯基硫代芥子油苷在抚顺红和盛丰白萝卜苗中的含量逐渐降低,且在盛丰白中的下降速率高于抚顺红中。当萝卜苗生长至7 d时,抚顺红和盛丰白中4-甲基亚磺酰基-3-丁烯基硫代芥子油苷的含量分别为10.20、6.05 μmol/g,较种子中含量分别下降89.23%和93.67%。此外,两个萝卜品种中吲哚-3-甲基芥子油苷和4-甲氧基吲哚-3-甲基硫代芥子油苷的含量也均随着种子的萌发与生长呈现出不同程度的下降趋势。Martinez等[11]在西兰花、萝卜种子发芽过程中也观测到类似的情况,推断由于在种子萌发生长初期,萝卜苗中芥子油苷的相关合成途径还未被激活,幼苗的快速生长以及体内含水量的迅速升高导致了种子中原有的芥子油苷含量的降低。尽管如此,萝卜幼苗中芥子油苷含量仍显著高于成熟的西兰花、萝卜、甘蓝等十字花科蔬菜,是摄取芥子油苷的理想来源[12]。与此同时,由表1可知,在大多数芥子油苷含量随种子萌发过程而逐渐下降的情况下,盛丰白中的4-甲硫基-3-丁烯基硫代芥子油苷含量出现明显的增高趋势。相比于盛丰白种子中1.35 μmol/g的含量,其5 d和7 d幼苗中4-甲硫基-3-丁烯基硫代芥子油苷含量分别增长了9.12倍和11.53倍。Barillari等[13]认为白萝卜幼苗在生长过程中,部分4-甲基亚磺酰基-3-丁烯基硫代芥子油苷通过相关途径转换形成4-甲硫基-3-丁烯基硫代芥子油苷,从而出现了4-甲硫基-3-丁烯基硫代芥子油苷的含量在种子萌发过程中的升高趋势。本实验中盛丰白在种子萌发过程中4-甲基亚磺酰基-3-丁烯基硫代芥子油苷含量的下降速率大于抚顺红的现象也从侧面印证了这一结论。

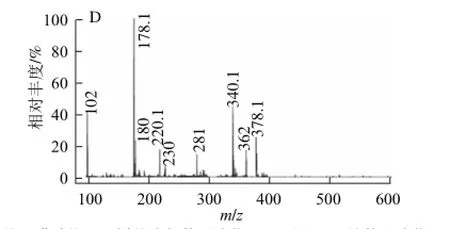
图2 萝卜苗中脱硫芥子油苷的质谱图Fig.2 Mass spectra of desulpho-glucosinolates in radish sprout

表1 萝卜苗生长过程中脱硫芥子油苷含量变化Table1 Changes in the desulpho-glucosinolates content in radish sprouts during germination μmol/g
2.2 花青素含量的变化

图3 萝卜发芽过程中花青素含量的变化Fig.3 Changes in anthocyanins contents in radish sprouts during germination
作为一类广泛存于植物中的色素,花青素具有延缓衰老、预防和改善心血管疾病的功效,因此针对果蔬中花青素的提取和功能研究得到了广泛的关注[14]。由图3可知,经过黑暗条件下两天的避光催芽阶段,抚顺红2 d幼苗中花青素含量较种子中含量下降45.43%。当幼苗转移至 12 h/d的光照条件下培育生长后,其花青素含量出现了一定程度的升高,但仍低于种子中花青素的含量。Li等[15]在研究了光照条件对荞麦苗中花青素积累量的影响后发现,通过FtPAL、FtC4H以及FtF3H等多个相关基因的调控,荞麦苗在黑暗条件下的花青素合成量远低于在光照条件下,这也解释了本实验中抚顺红萝卜苗花青素含量先下降后回升的现象。对于盛丰白而言,虽然其花青素含量从第2天起也有所增加,但主要由于品种的差异[11],其幼苗中花青素含量远低于抚顺红。
2.3 VC含量的变化

图4 萝卜发芽过程中VC含量的变化Fig.4 Changes in vitamin C content in radish sprouts during germination
由图4可知,虽然萝卜种子未检测到VC,但是随着种子的萌发,萝卜苗中VC的含量显著增加,当生长至5 d时,抚顺红和盛丰白幼苗中VC含量分别增加至70.63、50.23 mg/100 g,在此之后的2 d,萝卜苗中的VC含量变化趋于稳定,分别增加至65.81 mg/100 g和52.48 mg/100 g。种子的萌发过程也类似地引起了绿豆、西兰花等幼苗中VC含量极显著的增加[16-17]。 Xu Mao jun等[18]通过研究大豆的发芽过程后认为,种子在萌发过程中其体内半乳糖酸-1,4-内酯脱氢酶(L-galactono-1,4-lactone dehydrogenase,GLDH)活性的增强是引起VC含量显著升高的主要原因。作为VC合成途径中最后一步的关建酶,GLDH在催化半乳糖酸-1,4-内酯通过氧化反应转化为VC的生物途径中发挥了重要作用。
2.4 总酚含量及FRAP值的变化
酚类作为植物的次生代谢产物,在植物的生长过程中主要起到抗病、抗虫等防御功能[19]。另外,在人们的日常饮食中,摄入的酚类物质还有助于降低患各种慢性疾病的风险[20]。发芽过程对萝卜苗中总酚含量的影响如图5所示。

图5 萝卜发芽过程中总酚含量的变化Fig.5 Changes in total phenolics content in radish sprouts during germination
由图5可知,盛丰白种子中总酚含量为403.23 mg GAE/100 g,较抚顺红种子总酚含量高6.02%。种子发芽生长的过程引起了萝卜苗中总酚含量的迅速下降,且两品种的萝卜苗中总酚含量的差距进一步增大。生长至7 d时,抚顺红和盛丰白幼苗中总酚含量分别为132.31、202.84 mg GAE/100 g。Pérez等[21]发现西兰花的发芽过程也能显著引起其总酚含量的降低,推断可能是由于幼苗在生长过程中,有部分酚类物质会通过相关生物途径转化成为木质素——一种利于输导组织的水分运输和抵抗外界不良环境侵袭的芳香性聚合物。尽管发芽过程导致了萝卜苗中总酚含量的下降,但其仍高于成熟蔬菜中酚类化合物含量5~10 倍之多[2]。
与此同时,本实验也利用FRAP法测定了萝卜苗抗氧化能力在发芽过程中的动态变化。虽然发芽过程显著提高了萝卜苗中VC等抗氧化物质的含量,但由图6可知,两种萝卜苗的抗氧化值随着发芽的过程均显著下降,与总酚含量的变化趋势呈现出高度的相似性。鉴于此,通过Origin Lab软件拟合萝卜苗中总酚含量与抗氧化能力之间的关系后发现(图7),抚顺红和盛丰白萝卜苗中总酚含量与其抗氧化能力间有很高的相关性,其R2分别高达0.949 5和0.928 9。类似情况在其他十字花科植物的幼苗中也已被Baenas等[12]证实,其认为酚类化合物作为十字花科植物幼苗最主要的抗氧化物质,决定着幼苗80%~95%的总抗氧化能力。

图6 萝卜发芽过程中FRAP值的变化Fig.6 Changes in FRAP value in radish spr outs during germination
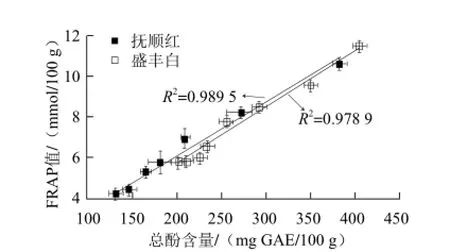
图7 萝卜苗中总酚含量与抗氧化能力之间的关系Fig.7 Correlation between total phenolic contents and FRAP values
3 结 论
抚顺红和盛丰白在从休眠的静态种子发芽成为萝卜幼苗这一生理过程中,其体内大量的相关生物合成及代谢途径被激活,导致了幼苗所含利于人体健康的营养成分组成及含量发生了显著变化。随着幼苗的生长,诸如芥子油苷、花青素以及总酚等营养物质的含量虽然总体呈下降趋势,但其营养价值仍远高于成熟的蔬菜,在药食领域具有广阔的应用前景。尤其是相比于其他十字花科蔬菜,萝卜苗中所特有的4-甲基亚磺酰基-3-丁烯基硫代芥子油苷(glucoraphenin),在人体消化道内降解后形成的一种异硫氰酸盐(sulforaphene),已被证实具有极强的抑癌活性。
在后续实验中,针对如何利用外源诱导因子促进萝卜幼苗中营养物质的积累、以及如何在加工烹饪过程中减少萝卜芽苗菜营养物质损失的相关问题,可开展进一步的探索与研究。
[1] MANCHALI S, CHIDAMBARA MURTHY K N, PATIL B S. Crucial facts about health benefi ts of popular cruciferous vegetables[J]. Journal of Functional Foods, 2012, 4(1): 94-106.
[2] SINGH J, UPADHYAY A K, PRASAD K, et al. Variability of carotenes, vitamin C, E and phenolics in Brassica vegetables[J]. Journal of Food Composition and Analysis, 2007, 20(2): 106-112.
[3] ZIMMERMANN N S, GERENDÁS J, KRUMBEIN A. Identifi cation of desulphoglucosinolates in Brassicaceae by LC/MS/MS: comparison of ESI and atmospheric pressure chemical ionisation-MS[J]. Molecular Nutrition & Food Research, 2007, 51(12): 1537-1546.
[4] TENG S, KEURENTJES J, BENTSINK L, et al. Sucrose-specific induction of anthocyanin biosynthesis in Arabidopsis requires the MYB75/PAP1 gene[J]. Plant Physiology, 2005, 139(4): 1840-1852.
[5] PUGLIESE A G, TOMAS-BARBERAN F A, TRUCHADO P, et al. Flavonoids, proanthocyanidins, vitamin C, and antioxidant activity of Theobroma grandifl orum (Cupuassu) pulp and seeds[J]. Journal of Agricultural and Food Chemistry, 2013, 61(11): 2720-2728.
[6] AINSWORTH E A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nature Protocols, 2007, 2(4): 875-877.
[7] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[8] 腊贵晓, 史琳娜, 方萍, 等. HPLC-PDA-ESI/MS 鉴定芥蓝中脱硫芥子油苷[J]. 食品科学, 2009, 30(20): 411-415.
[9] 腊贵晓, 方萍, 李亚娟, 等. 液相色谱质谱联用分离, 鉴定芥蓝中脱硫芥子油苷[J]. 浙江大学学报: 农业与生命科学版, 2008, 34(5): 557-563.
[10] BENNETT R N, MELLON F A, KROON P A. Screening crucifer seeds as sources of specifi c intact glucosinolates using ion-pair highperformance liquid chromatography negative ion electrospray mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2004, 52(3):428-438.
[11] MARTINEZ V C, PEÑAS E, CISKA E, et al. Time dependence of bioactive compounds and antioxidant capacity during germination of different cultivars of broccoli and radish seeds[J]. Food Chemistry, 2010, 120(3): 710-716.
[12] BAENAS N, MORENO D A, GARCIA V C. Selecting sprouts of brassicaceae for optimum phytochemical composition[J]. Journal of Agricultural and Food Chemistry, 2012, 60(45): 11409-11420.
[13] BARILLARI J, CERVELLATI R, COSTA S, et al. Antioxidant and choleretic properties of Raphanus sativus L. sprout (Kaiware Daikon) extract[J]. Journal of Agricultural and Food Chemistry, 2006, 54(26): 9773-9778.
[14] LI Hongyang, DENG Zeyuan, ZHU Honghui, et al. Highly pigmented vegetables: anthocyanin compositions and their role in antioxidant activities[J]. Food Research International, 2012, 46(1):250-259.
[15] LI Xiaohua, PARK N I, XU Hui, et al. Differential expression of fl avonoid biosynthesis genes and accumulation of phenolic compounds in common buckwheat (Fagopyrum esculentum)[J]. Journal of Agricultural and Food Chemistry, 2010, 58(23): 12176-12181.
[16] ZILELINSKI H, PISKULA M K, MICHALSKA A, et al. Antioxidant capacity and its components of cruciferous sprouts[J]. Polish Journal of Food and Nutrition Sciences, 2007, 57(3): 315-321.
[17] GUO Xinbo, LI Tong, TANG Keuan, et al. Effect of germination on phytochemical profi les and antioxidant activity of mung bean sprouts (Vigna radiata)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(44): 11050-11055.
[18] XU Maojun, DONG Junfang, ZHU Muyuan. Effects of germination conditions on ascorbic acid level and yield of soybean sprouts[J]. Journal of the Science of Food and Agriculture, 2005, 85(6): 943-947. [19] KIM H, CHEN F, WANG X, et al. Effect of methyl jasmonate on phenolics, isothiocyanate, and metabolic enzymes in radish sprout (Raphanus sativus L.)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19):7263-7269.
[20] 陈继承, 何捷, 何国庆. 降血脂功能食品研究进展[J]. 食品科学, 2011, 32(23): 333-338.
[21] PÉREZ B S, MORENO D A, GARCÍA V C. Improving the phytochemical composition of broccoli sprouts by elicitation[J]. Food Chemistry, 2011, 129(1): 35-44.
Dynamic Changes in Nutrients in Radish Sprouts during Germination
ZHOU Chen-guang, ZHU Yi*, LUO Yun-bo
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Changes in the contents of glucosinolates, anthocyanins, vitamin C and total phenolics and ferric reducing antioxidant power (FRAP) value in two radish cultivars known as ‘Fushunhong’ and ‘Shengfengbai’ were investigated during seed germination. The results showed that individual glucosinolates decreased signifi cantly in two radish cu ltivars except for glucoraphasatin in ‘Sheng fengbai’. The phenolic contents in 5-day-old sprouts of ‘Fushunhong’ and ‘Shengfengbai’decreased by 61.62% and 43.93%, respectively, as compared to those of raw seeds. Vitamin C was found to be absent in seeds but its content increased sharply with the progress of germination, reaching 65.81 and 52.48 mg/100 g, respectively, in 7-day-old sprouts of ‘Fushun hong’ and ‘Shengfengbai’.
radish; germination; glucosinolates; antioxidant
TS255.1
A
1002-6630(2014)09-0001-05
10.7506/spkx1002-6630-201409001
2013-06-10
国家自然科学基金青年科学基金项目(31101263)
周晨光(1990—),男,硕士研究生,研究方向为食品生物技术。E-mail:chenguangzhou820@gmail.com
*通信作者:朱毅(1973—),女,副教授,博士,研究方向为果蔬采后保鲜与生物活性物质功效。E-mail:zhuyi@cau.edu.cn
