不同萃取纤维对荔枝冰酒香气分析
2014-01-18薛楚然刘树文徐向文
卢 柯,薛楚然,乔 慧,刘树文,*,徐向文
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.广东为多生物科技有限公司,广东 茂名 525000)
不同萃取纤维对荔枝冰酒香气分析
卢 柯1,薛楚然1,乔 慧1,刘树文1,*,徐向文2
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.广东为多生物科技有限公司,广东 茂名 525000)
采用顶空固相微萃取与气相色谱-质谱联用相结合对荔枝冰酒中的香气成分进行初步分析,通过对不同固相微萃取纤维萃取香气成分的数量、种类以及各类化合物累积峰面积标准化值的比较,评价3 种固相微萃取纤维萃取荔枝冰酒香气成分的效果。结果发现,不同萃取纤维对荔枝冰酒香气成分的萃取效果差别较大,85 μm PA纤维萃取出化合物62 种,75 μm CAR/PDMS萃取出56 种,50/30 μm DVB/CAR/PDMS萃取出52 种。荔枝冰酒中主要香气成分是酯类、醇类、酸类、羰基类和少量的萜烯类,相对含量较高的物质是辛酸乙酯(38.96%)、癸酸乙酯(25.14%)、己酸乙酯(9.31%)、异戊醇(7.89%)、异丁烯酸甲酯(1.52%)、月桂酸乙酯(1.49%)、3-呋喃甲醛(1.26%)、癸酸(1.25%)、苯甲醇(1.21%)、β-大马士酮(1.21%)和苯乙醇(0.30%)。累积峰面积标准化值表明,85 μm PA萃取酸类物质的灵敏度高,但对其他化合物灵敏度都较低;75 μm CAR/PDMS萃取酯类和醇类物质的灵敏度高;50/30 μm DVB/CAR/PDMS萃取醛、酮等羰基类物质的灵敏度高。综合考虑得出结论,75 μm CAR/PDMS纤维最适合对荔枝冰酒香气成分的萃取富集。
气相色谱-质谱法;固相微萃取纤维;荔枝冰酒;香气成分
荔枝(Litchi chinensis Sonn.)为无患子科(Sapindaceae)常绿乔木,是我国南方特有的水果。其色泽鲜艳、清甜可口、营养丰富、并具有独特风味,有“果中珍品”和“岭南佳果”等美誉[1-2]。目前人们对荔枝及其深加工产品如荔枝干、荔枝罐头、荔枝酒等进行深入研究[3-6],并取得了很大的研究成果,为荔枝产业的发展提供科学依据和理论指导。荔枝冰酒作为一种荔枝深加工的新产品,因其香味馥郁、风格更加独特已逐渐被人们所认可和喜爱[7],但文献中却鲜有关于荔枝冰酒香气的研究报道。
固相微萃取(solid phase microextraction,SPME)技术是一种新型的无溶剂样品预处理技术,这种技术集取样、萃取、浓缩和进样为一体,具有操作简单、样品用量少、无需使用溶剂、萃取样品后可直接色谱进样等优点[8],现已广泛应用于食品、环境、医药等领域[9-10],其在荔枝及其相关产品的研究方面也得到广泛的应用。鉴于不同萃取纤维具有不同萃取极性的原理[11],本研究拟选用文献中常用的3 种固相萃取纤维进行荔枝冰酒香气成分富集效果的比较,根据各萃取纤维萃取出香气成分中各物质的种类、数量及相应的灵敏度,选出最适合荔枝冰酒香气成分富集的萃取纤维,并对其香气成分进行初步分析,以期为荔枝冰酒香气后续的研究工作打下基础,更好地为荔枝冰酒的生产实践提供科学理论依据。
1 材料与方法
1.1 材料与试剂
荔枝冰酒(冷金香) 广东为多生物科技有限公司;NaCl(分析纯) 西安三浦精细化工厂。
1.2 仪器与设备
四极杆TRACE DSQ 气相色谱-质谱联用仪 美国Thermo-Finnigan公司;85 μm PA、75 μm CAR/PDMS、50/30 μm DVB/CAR/PDMS固相微萃取纤维、固相微萃取装置、手动进样手柄 美国Supelco公司。
1.3 方法
1.3.1 顶空固相微萃取
在15 mL装有磁力搅拌子的样品瓶中加入1.6 g NaCl和8 mL荔枝冰酒样品,于30 ℃条件下平衡20 min,然后插入已老化好的萃取纤维,密闭样品瓶,于30 ℃条件下萃取30 min,最后将萃取纤维在气相进样口解吸5 min用于气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析,重复实验3 次。
1.3.2 GC-MS分析条件
GC条件:色谱柱为:DB-MAX(30 m×0.25 mm,0.25 μm);以He为载气;流速1 mL/min,不分流进样;升温程序:40 ℃保持3min,以5 ℃/min上升到120 ℃,再以8 ℃/min上升到230 ℃,保持10min;进样口温度250 ℃,检测器温度230 ℃。
MS条件:电子电离源;电子能量70 eV;扫描方式:全扫描;质量扫描范围:30~450 u;离子源温度:230 ℃;检测器电压:350 V。
1.4 数据处理
1.4.1 定性与定量
采用质谱自带的NIST 2.0和Wiley谱库检索定性分析,结合有关文献[12-13]进行人工谱图解析,以确认各种香气物质。采用峰面积归一法对定性出的香气物质进行定量分析。
1.4.2 化合物灵敏度的比较
各类化合物的萃取灵敏度用累积峰面积标准化值(cumulative area normalization value,CANV)[14-15]进行评价,累积峰面积标准化值计算分3步进行,按公式(1)~(3)计算:
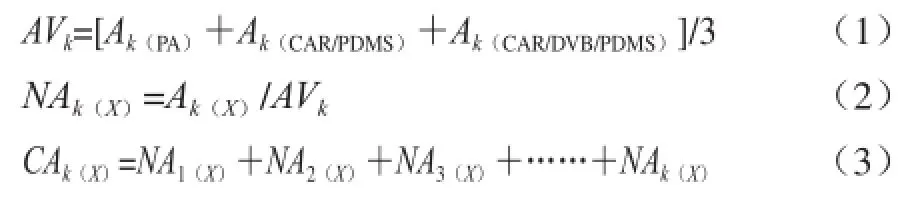
式中:AVk为3 种固相微萃取纤维萃取化合物k测量时的峰面积平均值;Ak(X)为X固相微萃取纤维萃取化合物k测量所得的峰面积绝对值,其中X为PA、CAR/PDMS、CAR/DVB/PDMS 3 种固相微萃取纤维中的任一种;NAk(X)为X固相微萃取纤维萃取化合物k的峰面积标准化值;CAk(X)为X固相微萃取纤维萃取1~k 个化合物累积峰面积标准化值;在同一保留时间下,若某类化合物的累积峰面积标准化值越大,则认为该萃取纤维对某类化合物的萃取灵敏度越高。
2 结果与分析
2.1 不同萃取纤维萃取香气成分数量和含量的比较
3 种萃取纤维对荔枝冰酒香气进行萃取经GC-MS分析所得总离子图如图1~3所示。

图1 PA纤维萃取荔枝冰酒香气总离子图Fig.1 TIC of aroma components of litchi ice wine extracted using PA fiber

图2 CAR/PDMS纤维萃取荔枝冰酒香气总离子图Fig.2 TIC of aroma components of litchi ice wine extracted using CAR/PDMS fiber

图3 DVB/CAR/PDMS纤维萃取荔枝冰酒香气总离子图Fig.3 TIC of aroma components of litchi ice wine extracted using DVB/CAR/PDMS fiber
如表1所示,应用3 种萃取纤维对荔枝冰酒香气成分进行萃取分析,共检测到94 种物质,其中酯类35 种,醇类10 种,酸类6 种,萜烯类5 种,羰基类13 种,烷烃类15 种,其他类10 种。其中85 μm PA纤维从荔枝冰酒样中共萃取出62 种物质,其中酯类物质占71.26%、醇类物质占13.48%、酸类物质占5.05%、羰基类物质占3.86%、萜烯类物质占1.61%、烷烃类物质占2.94%、其他类物质占1.12%;75 μm CAR/PDMS纤维共萃取出56 种物质,其中酯类物质占81.49%、醇类物质占10.05%、酸类物质占2.48%、羰基类物质占3.51%、萜烯类物质占0.58%、烷烃类物质占2.94%、其他类物质占1.12%;50/30 μm DVB/CAR/PDMS纤维共萃取出52 种物质,其中酯类物质占81.66%、醇类物质占5.91%、酸类物质占2.54%、羰基类物质占6.24%、萜烯类物质占0.90%、烷烃类物质占1.04%、其他类物质占0.86%。比较分析3 种萃取纤维所萃取的各物质种类的相对含量可知,荔枝冰酒中含量较高的香气种类依次是酯类、醇类、酸类、羰基类和萜烯类物质,其中酯类物质可以产生明显的果香和花香气味[16];适量的醇类和酸类能使酒体香气表现出复杂性和口味的平衡感[17];萜烯类物质能赋予酒体特殊的果实香气[18]。这些物质协同作用构成酒体的整体香气特征,是酒体中主要的呈香物质种类。结合图4和图5可知,3 种萃取纤维萃取各香气物质的含量和种类差别较大,85 μm PA纤维萃取的高级醇类、酸类、烷烃类及其他类物质的种类数量相对其他2 种萃取纤维均较多,而其萃取酯类物质的种类数量则是介于75 μm CAR/PDMS纤维和50/30 μm DVB/CAR/PDMS纤维之间,为21 种;75 μm CAR/PDMS纤维萃取的酯类物质种类最多,为26 种;而其所萃取的烷烃类物质种类最少,只有3 种,其所萃取的醇类物质种类数量则介于其他2种纤维之间,为8 种;50/30 μm DVB/CAR/PDMS纤维萃取的羰基类物质数量与75 μm CAR/PDMS纤维所萃取的物质种类相同,为8 种;萃取烃类物质的数量介于85 μm PA纤维和75 μm CAR/PDMS纤维之间,3 种萃取纤维均萃取出少量但很重要的萜烯类物质,但萃取萜烯类物质的种类有差异:75 μm CAR/PDMS纤维和50/30 μm DVB/CAR/PDMS纤维均萃取出了香茅醇,而85 μm PA纤维未萃取出;其中85 μm PA纤维萃取出了雪松醇和异薄荷醇,而其他2 种萃取纤维均未检测到。

表1 荔枝冰酒香气成分的GC-MS分析结果Table1 GC-MS analysis of aroma components in litchi ice wine

续表1
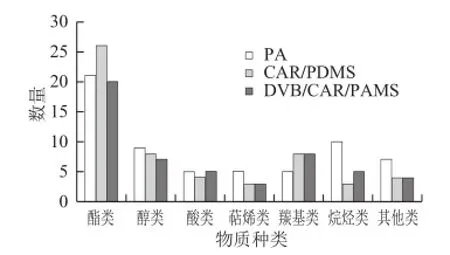
图4 不同萃取纤维萃取荔枝冰酒香气成分数量的比较Fig.4 Comparison of the chemical groups of aroma components identified in litchi ice wine extracted using different extracted fibers

图5 不同萃取纤维萃取荔枝冰酒香气成分相对含量的比较Fig.5 Comparison of the relative contents of aroma components identified in litchi ice wine extracted by different fibers
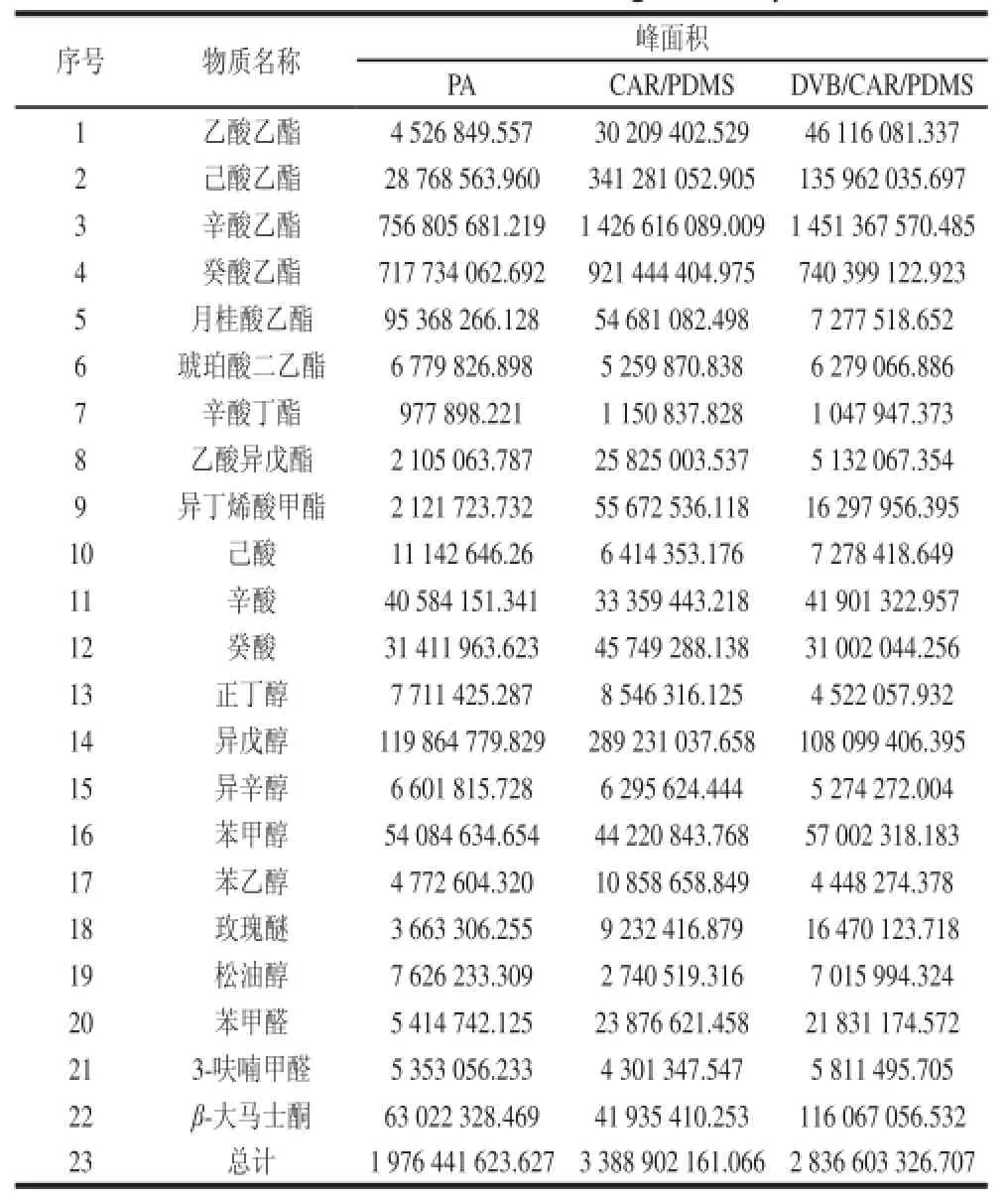
表2 不同萃取纤维对检测结果的影响Table2 Effects of different fiber coatings on analytical results
3 种萃取纤维均检出乙酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯、辛酸丁酯、己酸、辛酸、癸酸、正丁醇、异戊醇、异辛醇、苯甲醇、苯乙醇、玫瑰醚、松油醇和β-大马士酮等25 种物质,其中含量相对较高的物质是辛酸乙酯、癸酸乙酯、苯甲醇、辛酸、己酸乙酯、癸酸、β-大马士酮及萜烯类物质,这些物质是荔枝冰酒的主要香气成分。从表2可以看到,75 μm CAR/ PDMS纤维萃取到这些主要相同物质的总峰面积最高,其次是50/30 μm DVB/CAR/PDMS纤维,85 μm PA纤维萃取到的总峰面积最小,这表明75 μm CAR/PDMS纤维对荔枝冰酒中的香气成分有着最大的富集能力。
综合考虑所萃取出香气成分的种类数量、含量及总峰面积可知,PA纤维不适合荔枝冰酒香气成分的萃取分析,75 μm CAR/PDMS纤维和50/30 μm DVB/CAR/PDMS纤维较为适合荔枝冰酒香气成分的萃取分析。
2.2 不同萃取纤维萃取挥发性物质灵敏度的比较
由图6可以看出,75 μm CAR/PDMS萃取乙醇酯、其他酯类和醇类化合物CANV最大,即萃取酯类化合物的灵敏度最高,而对于酸类化合物CANV最小,即对酸类化合物的灵敏度最低;50/30 μm DVB/CAR/PDMS纤维对醛、酮等羰基类化物的灵敏度最高,这与付蕾等[19]的研究结果较为一致,而萃取酯类化合物的灵敏度介于75 μm CAR/PDMS纤维和85 μm PA纤维之间,对醇类化合物的灵敏度最低,85 μm PA纤维只对酸类化合物表现出较高的灵敏度,而对酯类、醇类、羰基类、萜烯类都表现出较低的灵敏度,进一步说明85 μm PA纤维不适合荔枝冰酒香气成分的富集和萃取,结合表1、2可知,构成荔枝冰酒主要香气成分的化合物是酯类、醇类、酸类以及少量的萜烯类物质,其中酯类物质的相对含量占所有香气成分的绝大部分,75 μm CAR/PDMS纤维萃取主要香气成分的总峰面积是3 种萃取纤维中最大的,其萃取酯类物质的灵敏度是3 种萃取纤维中最高的,而对于醇类、萜烯类、羰基类化合物的萃取能力也表现出较高的灵敏度,因此,3 种萃取纤维中,75 μm CAR/PDMS纤维最适合荔枝冰酒香气成分的萃取分析。


图6 固相微萃取纤维萃取葡萄酒香气成分的累积峰面积标准化值Fig.6 CANV of aroma components extracted using different fibers
2.3 荔枝冰酒香气成分的初步分析
以CAR/PDMS纤维萃取荔枝冰酒的GC-MS分析结果为例进行说明,CAR/PDMS纤维检测出64个峰,共鉴定出56 种物质,占所有峰面积的96.72%,其中酯类26 种,占81.49%;醇类8 种,占10.05%;酸类4 种,占2.48%;羰基类8 种,占3.51%;烷烃类3 种,占1.19%;萜烯类3 种,占0.58%;其他类4 种,共占0.56%。含量排在前10 位的物质依次是辛酸乙酯(38.96%)、癸酸乙酯(25.14%)、己酸乙酯(9.31%)、异戊醇(7.89%)、异丁烯酸甲酯(1.52%)、月桂酸乙酯(1.49%)、3-呋喃甲醛(1.26%)、癸酸(1.25%)、苯甲醇(1.21%)、β-大马士酮(1.21%)。
酯类物质中含量较高的物质是辛酸乙酯(38.93%)、癸酸乙酯(25.14%)、己酸乙酯(9.31%)、异丁烯酸甲酯(1.52%)、月桂酸乙酯(1.49%)、乙酸乙酯(0.82%),辛酸乙酯具有甜香味、花香味、水果味、香蕉味、梨味,类似白兰地香气[20],癸酸乙酯具有果香和舒适的醋味,己酸乙酯具有青苹果味、果香、草莓香和茴香味,月桂酸乙酯、乙酸乙酯具有令人愉悦的果香和花香[21],这些酯类能赋予荔枝冰酒优雅的果香和花香,并与进入酒中的品种香气协调性良好[20]。
醇类物质中含量较高的香气成分是异戊醇(7.89%)、苯甲醇(1.21%)、苯乙醇(0.30%)、异辛醇(0.17%)。适量的醇类物质对形成酒的风味和促使酒体丰满、浓厚起着重要的作用,醇类物质还是酯类物质的前驱物[22]。异戊醇是醇甜和助香剂的主要物质来源,苯甲醇具有苦杏仁味和涩味,苯乙醇属于芳香醇类,是酵母菌的代谢产物,在很低的浓度下能产生很高的玫瑰花、蔷薇和桃子等香味[21],在冰酒总体香气形成中具有不可忽视的作用。实验中还检测到少量的1-辛烯-3-醇,是来源于荔枝果实的品种香气物质,具有泥土气息、药草香味和蘑菇味,对荔枝冰酒典型性香气的形成产生积极的贡献[20]。
酸类物质中含量较高的物质是癸酸(1.25%)、辛酸(0.91%)、己酸(0.18%)。低浓度的酸会赋予荔枝酒清淡的、令人愉快的香味,但浓度过高时反而会对荔枝酒香气品质产生消极的影响[23]。
羰基类物质中含量较高的是3-呋喃甲醛(1.26%)、β-大马士酮(1.14%)、苯甲醛(0.65%),3-呋喃甲醛具有谷物香气[24],β-大马酮是去甲类异戊二烯化合物,具有复杂的花香、热带水果和煮苹果香气,苯甲醛则具有特殊芳香植物气味。3 种物质由于其阈值较低,致使其香气值(浓度/阈值)很高,加之香味独特,可构成荔枝冰酒的特征香气组分。
本实验还检测出萜烯类物质,这类化合物是植物的二次代谢产物,随酿造过程进入到果酒中,赋予果酒特有的品种香气[25]。荔枝冰酒中的萜烯类物质有玫瑰醚(0.46%)、松油醇(0.07%)、香茅醇(0.05%),其中玫瑰醚香气阈值很低,具有浓郁的玫瑰花香味,香茅醇具有柑橘味和类柠檬气味[26],尽管萜烯类物质在酒中的含量相对较低,但由于其嗅觉阈值很低且物质之间存在协同作用[27],对荔枝冰酒特征香气的形成有很大影响。
实验还检测到烷烃类物质、杂环类物质及少量苯环衍生物和酚类物质,又由于这些物质含量较少,再加之相应的阈值较大,其香气值(浓度/阈值)很低,因而对荔枝冰酒特征香气的整体贡献不大。
3 讨 论
通过比较3 种萃取纤维萃取荔枝冰酒香气成分各物质种类、数量、总峰面积及其萃取各类物质的灵敏度,最适合荔枝冰酒香气成分萃取分析的固相微萃取纤维是75 μm CAR/PDMS纤维。荔枝冰酒中主要呈香物质是酯类、醇类、酸类及少量的醛、酮等羰基类和萜烯类,相对含量较多的物质是辛酸乙酯(38.96%)、癸酸乙酯(25.14%)、己酸乙酯(9.31%)、异戊醇(7.89%)、异丁烯酸甲酯(1.52%)、月桂酸乙酯(1.49%)、3-呋喃甲醛(1.26%)、癸酸(1.25%)、苯甲醇(1.21%)、β-大马士酮(1.21%)、苯乙醇(0.30%)。本研究选取了适合荔枝冰酒香气分析的最佳萃取纤维,并对其香气成分进行了初步分析,有必要对影响萃取效果的外界因素(如萃取温度、萃取时间、解吸时间、电解质浓度等)进行进一步研究,为提高荔枝冰酒的质量和品味提供科学依据。
[1] 农业部发展南亚热带作物办公室. 中国热带南亚热带果树[M]. 北京: 中国农业出版社, 1998.
[2] 岳强, 曾新安, 于淑娟, 等. 新鲜荔枝汁营养成分分析[J]. 食品工业科技, 2006, 27(4): 173-174.
[3] CHYAU C C, KO P T, CHANG C H, et a1. Free and glycosidically bound aroma compounds in lychee (Litchi chinensis Sonn.)[J]. Food Chemistry, 2003, 80(3): 387-392.
[4] 蔡长河, 郭际, 曾庆孝. 荔枝及其干制后香气成分的研究[J]. 食品科学, 2007, 28(9): 455-461.
[5] 邓开野. 荔枝与荔枝酒香气物质研究进展[J]. 食品研究与开发, 2011, 32(2): 12-14.
[6] 王贞强, 马波, 迟建, 等. 荔枝酒香气成分的GC/MS分析[J]. 中国农学通报, 2006, 22(8): 135-138.
[7] 黄星源, 郭正忠, 寇兆民. 浅谈冰荔枝酒的生产工艺[J]. 酿酒, 2011, 38(4): 60-62.
[8] KATAOKA H, LORD H L, PAWLISZYN J. Applications of solidphase microextraction in food analysis[J]. Journal of Chromatography A, 2000, 880(12): 35-62.
[9] VAS G, VEKEY K. Solid-phase microextraction: a powerful sample preparation tool prior to mass spectrometric analysis[J]. Journal of Mass Spectrometry, 2004, 39(3): 233-254.
[10] STASHENKO E E, MARTÍNEZ J R. Sampling volatile compounds from natural products with headspace-solid-phase microextraction[J]. Journal of Biochemical and Biophysical Methods, 2006, 70(2): 235-242.
[11] TARA T, PIERGIORGIO C, IVA S, et al. Optimization of wine headspace analysis by solid-phase microextraction capillary gaschromatography with mass spectrometric and flame ionization detection[J]. Food Chemistry, 2005, 93(2): 361-369.
[12] 丛浦珠. 质谱学在天然有机化学中的应用[M]. 北京: 科学出版社, 1987: 595-650.
[13] 汪正范, 杨树民, 吴侔天, 等. 色谱联用技术[M]. 北京: 化学工业出版社, 2001: 63-120.
[14] 陶永胜, 李华. 葡萄酒香气成分萃取中固相微萃取纤维的选择[J].西北农林科技大学学报: 自然科学版, 2009, 37(8): 211-216.
[15] 汪立平, 徐岩, 赵光鳌, 等. 顶空固相微萃取法快速测定苹果酒中的香味物质[J]. 食品与生物技术学报, 2003, 22(1): 1-6.
[16] 邓开野, 黄小红. 发酵温度对荔枝酒香气成分的影响[J]. 中国食品学报, 2013, 13(1): 206-209.
[17] 许喜林, 朱玲, 边金勇, 等. 荔枝果酒香气成分的研究[J]. 酿酒科技, 2009(5): 42-44.
[18] FERREIRA V, LOPEZ R, CACHO J F. Quantitative determination of the odorants of young red wines from different grape varieties[J]. Science of Food Agriculture, 2000, 8(1): 1659-1667.
[19] 付蕾, 刘正生, 孙鑫洋, 等. 4 种纤维头对草莓香气成分的萃取效果[J].中国农业科学, 2010, 43(21): 4473-4481.
[20] 屈文军. 荔枝酒香气成分分析[D]. 北京: 中国农业大学, 2007.
[21] 李华. 葡萄酒品尝学[M]. 北京: 科学出版社, 2005: 36-37.
[22] WU Y, PAN Q, QU W, DUN C. Comparison of volatile profiles of nine litchi (Litchi chinensis Sonn.) cultivars from Southern China[J]. Journal of the Science of Food and Agriculture, 2009, 57(20): 9676-9681.
[23] SHINOHARA T. Gas chromatographic analysis of volatile fatty acids in wines[J]. Agricultural and Biological Chemistry, 1985, 49(7): 2211-2218.
[24] 刘树文. 合成香料技术手册[M]. 北京: 中国轻工业出版社, 2000: 68-91.
[25] 涂崔, 潘长红, 朱保庆, 等. 葡萄与葡萄酒单萜化合物的研究进展[J].园艺学报, 2011, 38(7): 1397-1406.
[26] PETER K C O, TERRY E A. The gas chromatography/olfactory analysis of leechee[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 2282-2286.
[27] RIBÉREAU-GAYON P, GLORIES Y, MAUJEAN A, et al. Handbook of enology: volume 2. The chemistry of wine stabilization and treatments[M]. New York: John Wiley sons Ltd., 2000: 205-230.
Analysis of Aroma Composition of Litchi Ice Wine by Different Extraction Fibers
LU Ke1, XUE Chu-ran1, QIAO Hui1, LIU Shu-wen1,*, XU Xiang-wen2
(1. College of Enology, Northwest A & F University, Yangling 712100, China; 2. Guangdong Weiduo Biotechnology Co. Ltd., Maoming 525000, China)
The aroma compounds of litchi ice wine were analyzed by head-space solid-phase micro-extraction (HSSPME) coupled to gas chromatography-mass spectrometry (GC-MS). The efficiency of three different extraction fibers was evaluated by comparing the number, chemical group and cumulative area normalization value (CANV) of the extracted compounds. The results indicated that the extraction efficiency of aroma compounds were very different in litchi ice wine because of different fibers. Totally 62, 56 and 52 aroma compounds in litchi ice wine were extracted through PA, CAR/ PDMS and DNB/CAR/PDMS, respectively. The major constituents were esters, alcohols, acids, ketones, aldehydes, and a few terpenes. The most important aroma compounds were ethyl caprylate (38.96%), ethyl caprate (25.14%), ethyl caproate (9.31%), isoamyl alcohol (7.89%), methyl methacrylate (1.52%), ethyl laurate (1.49%), 3-furaldehyde (1.26%), decanoic acid (1.25%), benzyl alcohol (1.21%), damascenone (1.21%), and phenethyl alcohol (0.30%). The analysis of cumulative area normalization value indicated that 85 μm PA was more sensitive to extract acids but least sensitive to other compounds, 75 μm CAR/PDMS was more sensitive to esters and alcohols, and 50/30 μm DNB/CAR/PDMS was more sensitive to ketones and aldehydes. Considering all factors above, 75 μm CAR/PDMS was the optimal fiber for the extraction of aroma compounds in litchi ice wine.
gas chromatography-mass spectrometry (GC-MS); solid phase micro-extraction fibers; litchi ice wine; aroma compounds
TS262.7
A
1002-6630(2014)20-0224-06
10.7506/spkx1002-6630-201420045
2014-02-21
广东省教育部产学研结合项目(2011A01003);茂名市重大科技专项(2009B090300133)
卢柯(1987—),男,硕士研究生,研究方向为荔枝及荔枝酒香气分析。E-mail:luke87@126.com
*通信作者:刘树文(1965—),男,教授,博士,研究方向为葡萄酒酿造工艺、葡萄酿酒微生物。E-mail:liushuwen@nwsuaf.edu.cn
