紫苏DGAT1 基因克隆及四尾栅藻表达载体构建
2014-01-14王莹莹刘玉姬妍茹张正海周广麒刘宇峰
王莹莹 刘玉 姬妍茹 张正海 周广麒 刘宇峰
(1.大连工业大学生物工程学院,大连 116034;2.黑龙江省科学院大庆分院,大庆 163319)
二酰甘油酰基转移酶(DGAT)是催化三酰甘油(TAG)合成最后一步的反应酶,也是其合成过程中唯一的限速酶[1],对油脂合成代谢起到正调控作用[2],具有促进TAG 积累的作用[3]。DGAT 广泛存在于动物、植物及微生物中,迄今为止发现该酶 存 在4 种 类 型:DGAT1、DGAT2、WS/DGAT 和CytoDGAT[4]。近年来研究表明,大量表达编码该酶的基因可以明显提高油脂含量,如Jako 等[5]发现在过量表达AtDGAT1 基因的野生型拟南芥中油脂积累量增加,Zheng 等[6]发现过量表达DGAT1 基因玉米可以明显提高玉米种子含油量、胚含油量和油酸含量。紫苏[Perilla frutescens(L.)Britt]为唇形科紫苏属一年生草本植物,药食两用,其油脂含量高达35%-64%[7],并且主要以TAG 形式存在[8],另外在NCBI 网站中也公布了紫苏基因组中DGAT1基因cDNA 的相关信息,所以利用RT-PCR 方法克隆紫苏DGAT1 基因是完全可行的。
四尾栅藻(Scenedesmus quadricanda)属于绿藻门栅藻科,细胞呈纺锤形或长筒形,藻体一般为2、4 或8 个细胞组成的单列群体,繁殖迅速,适应性强,是国内外广泛分布的一种淡水藻类[9]。据已有报道四尾栅藻的含油量不高[10],因此很少选择其作为制备生物柴油的原料,但由于其具有环境适应能力强和生长速度迅速等优点,如果能将其进行品种改良提高含油量,就可以将改良后的四尾栅藻作为原料制备生物柴油,并有望解决微藻生物柴油产业化进程中的瓶颈问题。近年来,国内外学者利用基因工程技术在分子水平上对微藻进行品种改良均得到了较好的效果,Manuell 等[11]将牛乳腺免疫血清蛋白的编码区(M-SAA)与衣藻叶绿体psbA 基因编码区直接替换实现了重组蛋白的表达,所得蛋白总量达5%以上。郭锁莲等[12]利用电击法将酵母絮凝基因FI07 导入天然非絮凝斜生栅藻中,获得了具有絮凝性状的转基因藻细胞。Pasquale 等[13]以带有CaMV35S 启动子的pGEM 7zF 为载体将编码真菌漆酶的poxA1b 基因成功导入到衣藻、针形纤维藻和小球藻中,与野生型相比其异源漆酶的酶活性显著增加。王长海等[14]以pBI121 质粒为载体成功将外源植酸酶基因导入到海水小球藻中,转化后微藻的植酸酶活性比未转化对照样品平均值高4 倍。在国内外研究中,关于紫苏DGAT1 基因克隆及利用植物表达载体pBI121 构建四尾栅藻表达载体的研究还未见报道。本研究将紫苏DGAT1 基因cDNA 片段与植物表达载体pBI121 质粒进行重新拼接,在四尾栅藻中表达DGAT1 基因以改善四尾栅藻油脂含量低的缺点,旨在为利用基因工程方法改良四尾栅藻品种奠定坚实基础,对实现生物柴油产业化开发提供帮助。
1 材料与方法
1.1 材料
1.1.1 植物材料 紫苏种子由黑龙江省科学院大庆分院林甸基地提供。
1.1.2 菌株和质粒 Escherichia coli DH5α,菌种编号81023-1 购自宝生物工程(大连)有限公司;植物表达载体pBI121 购自上海希匹吉生物技术有限公司;四尾栅藻(Scenedesmus quadricanda),藻种编号FACHB-1476 购自中科院水生生物研究所淡水藻种库。
1.1.3 引物的设计和合成 根据NCBI 网站中紫苏DGAT1 基因的cDNA 序列(GenBank 登录号:AF2-98815.1)利用软件DNAMAN 设计PCR 引物,并在引物两端分别加入Xba I 和BamH I 限制性酶切位点,由中美泰和生物技术(北京)有限公司合成。引物序列如下:DGAT1-F:5'-GCATCTAGAATGGCGATCTTGGACTC-3';DGAT1-R:5'-CGGATCCCTACCTTGCACTAGCTTTTC-3'。
1.1.4 主要试剂 Taq 聚合酶,Wide Range DNA Marker,购自中美泰和生物技术(北京)有限公司;Trizol,RevertAid First Strand cDNA Synthesis Kit,SanPrep 柱式质粒小量提取试剂盒,购自生工生物工程(上海)股份有限公司;RNAiso Plus,T4 DNA连接酶,SanPrep 柱式DNA 胶回收试剂盒,TaKaRa MiniBEST DNA Fragment Purification Kit Ver.3.0,pMD19-T Vector Cloning Kit,限制性内切酶Xba I 和BamH I,DNAiso Reagent,琼脂糖购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 紫苏总RNA 的提取方法 用75%乙醇浸泡10 min,再用0.1% DEPC 处理水清洗3 次,最后用无菌滤纸吸干残余水分,称取经过预处理的紫苏种子100 mg 放入已灭菌研钵中,同时加入液氮充分研磨,再加入6 mL RNAiso Plus 提取液按照试剂盒说明书所述步骤提取紫苏总RNA,利用紫外分光光度计测取OD260/OD280比值和1.2%(W/V)琼脂糖凝胶电泳检测提取RNA 的纯度及完整性。
1.2.2 紫苏DGAT1 基因克隆及克隆载体pMDDGAT1 的构建 以紫苏种子提取的RNA 为对象,按RevertAid First Strand cDNA Synthesis Kit 试剂盒所述步骤合成cDNA 第一链,再以此cDNA 为模板,以DGAT1-F 和DGAT1-R 为引物对紫苏DGAT1基因进行PCR 扩增,条件为:94℃ 5 min;94℃ 45 s,54℃ 45 s,72℃ 75 s,35 个循环;72℃ 10 min;4℃终止。将PCR 产物用1.0%(W/V)琼脂糖凝胶进行电泳检测,对PCR 产物切胶回收,得到目的基因DGAT1。将DGAT1 基因连接到pMD19-T 载体,转化大肠杆菌感受态DH5α,涂布于LB/Amp/XGal/IPTG 平板培养基进行蓝白斑筛选,挑取白色菌落,通过菌落PCR 鉴定。最后,将鉴定的阳性克隆送中美泰和生物技术(北京)有限公司测序,将测序结果进行Blast 比对分析。
1.2.3 表达载体pBI121-DGAT1 的构建 将克隆载体pMD-DGAT1 和pBI121 空载体分别用Xba I和BamH I 进行双酶切,反应条件如下:克隆载体pMD-DGAT1 或pBI121 空载体30 μL,限制酶Xba I 和BamH I 各1 μL,10×共用酶切缓冲液10 μL,加无菌水补足至50 μL,37℃水浴锅中酶切2 h。再将双酶切后的产物用1.0%(W/V)琼脂糖凝胶电泳进行分离和检测,切割目的基因DGAT1 片段和开环的载体片段所在凝胶,并按照DNA 胶回收试剂盒所述步骤分别回收后进行连接。反应条件如下:目的基因DGAT1 片段5 μL,开环的载体片段3 μL,buffer 1 μL,T4 DNA 连接酶1 μL,16℃连接过夜。将连接后产物转化感受态大肠杆菌DH5α,涂布于含卡那霉素抗性的LB 固体培养基上,37℃培养12 h 后挑取单菌落于LB 液体培养基中摇床培养。最后将所得转化菌体按照SanPrep 柱式质粒小量提取试剂盒所述步骤提取重组载体pBI121-DGAT1 并用Xba I 和BamH I 进行双酶切验证。
1.2.4 表达载体pBI121-DGAT1 转化四尾栅藻情况的检测 利用电转化方法[15]将构建好的表达载体pBI121-DGAT1 导入四尾栅藻中,涂布于含卡那霉素抗性的BG11 固体培养基并放置于人工气候箱中观察其生长情况。如有四尾栅藻藻落生长,分别挑取数个单藻落接种至BG11 液体培养基中光照摇床培养,编号备用。收集转化后的四尾栅藻藻体,按照DNAiso Reagent 说明书所述步骤提取基因组DNA,再以其为模板,以DGAT1-F 和DGAT1-R 为引物,按1.2.2 所述的扩增条件进行PCR 验证。以未转化的四尾栅藻作对照,将四尾栅藻藻体冷冻干燥,准确称取10 g 干藻粉利用索氏抽提法[16]进行油脂提取。通过比较转化后和未转化的四尾栅藻油脂含量,确定目的基因是否表达,以验证四尾栅藻表达载体pBI121-DGAT1 的构建是否具有应用价值。
2 结果
2.1 紫苏总RNA的提取
从紫苏种子中提取总RNA 经紫外分光光度计检测OD260/OD280比值在1.8-2.0 之间,表明总RNA 几乎无降解。凝胶电泳检测结果(图1)显示,28S、18S rRNA 条带清晰明亮,浓度比约为2∶1,同时5S rRNA 条带较微弱,表明提取的紫苏总RNA 质量和纯度均符合下一步逆转录的试验要求。
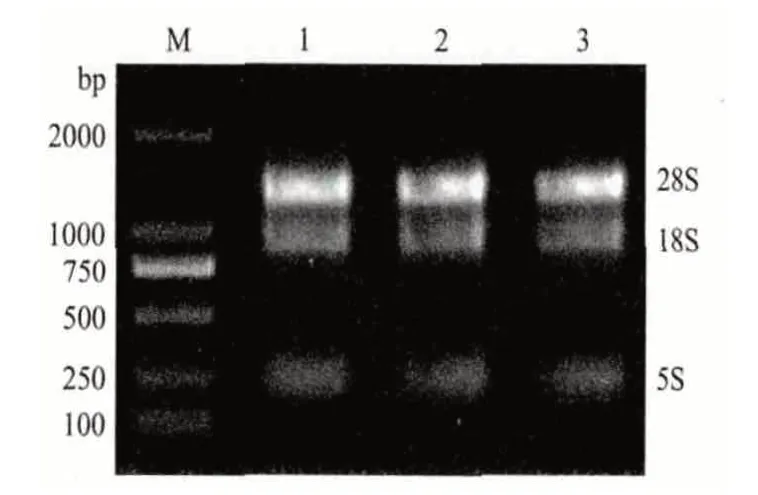
图1 紫苏总RNA 电泳检测
2.2 紫苏DGAT1基因克隆及载体pMD-DGAT1构建
以紫苏RNA 反转录的cDNA 为模板,PCR 扩增结果(图2-A)显示,产物长度约为1 600 bp,与预期大小一致。回收纯化该片段,构建克隆载体pMDDGAT1,菌落PCR 结果(图2-B)显示,扩增产物长度约为1 600 bp,测序显示此片段长度为1 657 bp。通过Blast 比对结果显示此片段与GenBank 中紫苏DGAT1 基因序列的最大同源性为97%,说明克隆得到紫苏DGAT1 基因完整的编码区序列,表明紫苏DGAT1 基因克隆及载体pMD-DGAT1 构建成功。
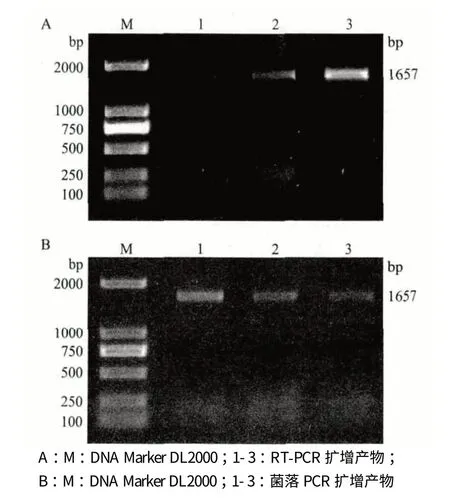
图2 RT-PCR(A)及菌落PCR(B)扩增产物电泳检测
2.3 表达载体pBI121-DGAT1的构建
对克隆载体pMD-DGAT1 和pBI121 空载体进行Xba I 和BamH I 双酶切,分别回收长度约为1 600 bp 和14 700 bp 的DGAT1 基因和pBI121 空载体片段,连接后所得产物转化大肠杆菌DH5α 感受态细胞,从转化菌落中提取得到重组载体,命名为pBI121-DGAT1。将重组载体进行Xba I 和BamH I 双酶切验证。结果(图3)显示,经双酶切得到两条片段长度分别为1 657 bp 和14 729 bp,与连接前长度一致,表明表达载体pBI121-DGAT1 构建成功。
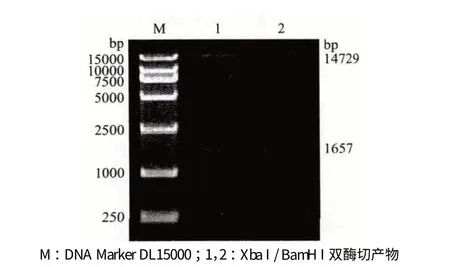
图3 重组载体pBI121-DGAT1 双酶切验证
2.4 表达载体pBI121-DGAT1转化四尾栅藻的检测
利用电转化方法将表达载体pBI121-DGAT1 导入四尾栅藻中,涂布于含有卡那霉素抗性的BG11固体培养基中可观察到有四尾栅藻生长,而未转化的四尾栅藻涂布于含有卡那霉素抗性的BG11 固体培养基中未见生长。以转化后的四尾栅藻基因组DNA 为模板进行PCR 验证,结果(图4)显示,4个转化后的四尾栅藻样品均扩增出大小为1 657 bp的片段,与基因DGAT1 长度一致,表明载体pBI121-DGAT1 已成功转化四尾栅藻。另外,利用索氏抽提法分别测定未转化和转化后四尾栅藻的油脂含量,结果(图5)显示,未转化和转化后四尾栅藻的油脂含量达细胞干重的6.3%和11.8%,转化后四尾栅藻的油脂含量较转化前提高近1 倍,说明DGAT1 基因已经在四尾栅藻中成功表达。
3 讨论
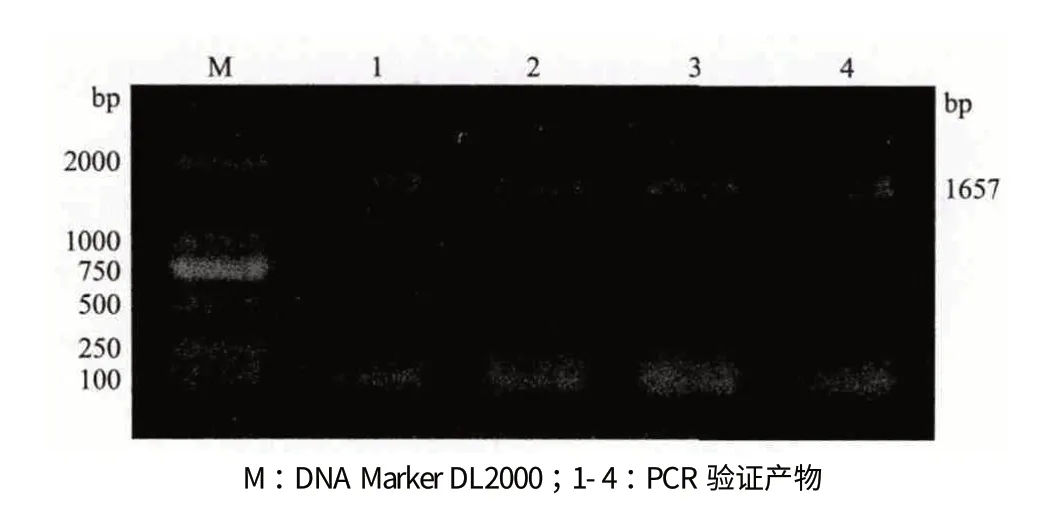
图4 表达载体pBI121-DGAT1 转化四尾栅藻PCR 验证
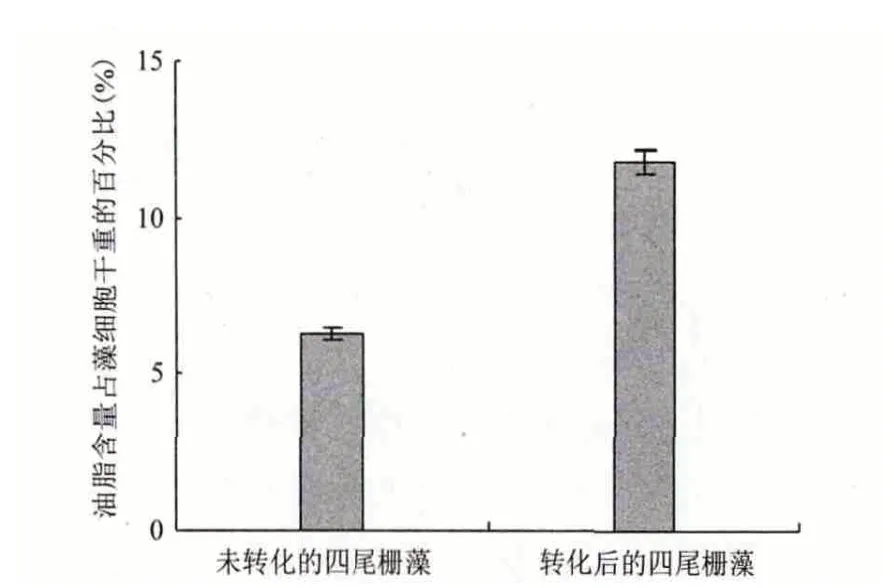
图5 未转化和转化后的四尾栅藻油脂含量对比图
近年来,生物柴油作为一种新型环保可再生能源成为了国内外广泛研究的热点问题。目前制备生物柴油的主要原料是油料作物,但由于其具有生长周期长、产量低和占用耕地等缺点制约了生物柴油的进一步发展。微藻因其具有生长周期短、产量高、不占用耕地等优点而被认为是一种高潜力的生物柴油新型原料[17],但微藻油脂存在单位光照面积产量低和生产成本高等问题,因此如何能有效地提高微藻体内油脂含量成为新一轮的研究热点。微藻油脂合成代谢途径是一个复杂的生理生化过程,涉及到多种酶的协同作用和质体、内质网及细胞质等亚细胞结构的参与,同时与糖类和蛋白质代谢也有着密切的关系[18],所以微藻产油量的提高可以从生化途径和基因工程途径两方面入手。生化途径是一种通过控制营养或培养条件将光合作用产生的代谢流更多地导向脂类的生物合成途径,但由于营养物限制或生理逆境作用而抑制细胞分裂导致生物量下降,因此利用其提高微藻产油量存在很大的局限性。基因工程途径是指在体外将外源基因插入病毒、质粒等载体中构建重组DNA 分子,然后将重组DNA 分子导入受体细胞内,使外源基因在受体细胞内进行复制、转录和翻译的分子操作途径,与生化途径相比利用基因工程途径可以从根本上提高微藻的产油量。因此本研究以紫苏RNA 为模板反转录克隆得到DGAT1 基因,并将其与植物表达载体pBI121 进行重组构建成以CaMV35S 启动子驱动的四尾栅藻表达载体,最后利用电转化方法获得了转基因四尾栅藻。植物表达载体pBI121 本身就带有强大的CaMV35S启动子和卡那霉素抗性基因,实现了基因的表达以及转化子的有效筛选。筛选后获得的四尾栅藻油脂含量与未转化的野生型相比提高了近1 倍,说明DGAT1 基因通过基因工程途径提高四尾栅藻产油量达到了一定的效果,但是转化后的四尾栅藻油脂含量为11.8%,与油脂含量较高的微藻(如硅藻[19])相比差距还是很大,所以在今后的研究中可尝试将多个DGAT1 基因并列连接到一个表达载体中,构建DGAT1 超表达载体,以期实现转基因四尾栅藻产油量的大幅度提高。本研究成功构建DGAT1 四尾栅藻表达载体,并达到了提高四尾栅藻油脂含量的应用效果,为开发高产油微藻新品种提供新方向,也为实现微藻生物柴油产业化生产提供充分的理论依据。
4 结论
以紫苏总RNA 为模板,采用RT-PCR 方法扩增出DGAT1 基因的cDNA 编码区序列并构建克隆载体pMD-DGAT1,经测定克隆所得DGAT1 基因片段长度为1 657 bp,与GenBank 中紫苏DGAT1 基因序列的最大同源性为97%。Xba I/BamH I 双酶切克隆载体pMD-DGAT1 和pBI121 空载体,连接目的片段成功构建四尾栅藻表达载体pBI121-DGAT1,电转化后四尾栅藻的油脂含量较转化前提高近1 倍。
[1] 唐桂英, 柳展基, 徐平丽, 等.花生二酰基甘油酰基转移酶基因克隆与功能研究[J].西北植物学报, 2013, 33(5):857-863.
[2] Li RZ, Yu KS, Hatanaka T, et al. Vernonia DGATs increase accumulation of epoxy fatty acids in oil[J]. Plant Biotechnology Journal, 2010, 8(2):184-195.
[3] Zheng P, Allen WB, Roesler K, et al. A phenylalanine in DGAT is a key determinant of oil content and composition in maize[J]. Nature Genetics, 2008, 40(3):367-373.
[4] 朱红霞, 胡利宗, 等. 三种豆科植物DGAT1 基因家族的分子特征与进化分析[J].生物技术通报, 2011(10):163-166.
[5] Jako C, Kumar A, Wei YD, et al. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physiology, 2001, 126(2):861-874.
[6] Zheng PZ, Allen WB, Roesler K, et al. A phenylalanine in DGAT is a key determinant of oil content and composition in maize[J]. Nature Genetics, 2008, 40(3):257-373.
[7] 王计平, 史华平, 李润植.紫苏种子脂肪酸组成及合成代谢研究进展[J].生物技术通报, 2011(4):31-34.
[8] 牟朝丽, 陈锦屏.紫苏油的脂肪酸组成、维生素E 含量及理化性质研究[J].西北农林科技大学学报:自然科学版, 2006, 34(12):195-198.
[9] 胡鸿钧, 魏印心.中国淡水藻类—系统、分类及生态[M].北京:科学出版社, 2006:650-667.
[10] 胡文军, 罗玮, 李汉广, 等.产油微藻筛选和鉴定及其产油性能的研究[J].中国生物工程杂志, 2012, 32(12):66-72.
[11] Manuell AL, Beligni MV, Elder JH, et al. Robust expression of a bioactive mammalian protein in Chlamydomonas chloroplast[J]. Plant Biotechnol, 2007, 5(3):402-412.
[12] 郭锁莲.转基因絮凝斜生栅藻的构建和自絮凝斜生栅藻细胞絮凝的研究[D].大连:大连理工大学, 2013.
[13] Chiaiesea P, Palomba F, Tatino F, et al. Engineered tobacco and microalgae secreting the fungal laccase POXA1b reduce phenol content in olive oil mill wastewater[J]. Enzyme and Microbial Technology, 2011, 49(6):540-546.
[14] 王长海, 王逸云.植酸酶基因在海水小球藻细胞内的表达[J].哈尔滨工业大学学报, 2008, 8(40):1329-1333.
[15] 王逸云.小球藻外源基因转化系统的建立及其表达植酸酶的研究[D].大连:大连理工大学, 2005.
[16] GB/T 5009.6-2003[Z].食品中脂肪的测定
[17] Gouveia L, Oliveira AC. Microalgae as a raw material for biofuels production[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(2):269-274.
[18] Sato N, Moriyama T. Genomic and biochemical analysis of lipid biosynthesis in the unicellular rhodophyte Cyanidioschyzon merolae:Lack of a plastidic desaturation pathway results in the coupled pathway of galactolipid synthesis[J]. Eukaryot Cell, 2007, 6(6):1006-1017.
[19] Jiang LL, Luo SJ, Fan XF, et al. Biomass and lipid production of marine microalgae using municipal wastewater and high concentration of CO2[J]. Appl Energ, 2011, 88:3336-3341.
