小鼠DEAF1 多克隆抗体的制备及应用
2014-01-14朱小慧盛德乔康乐伍仙凤邵文刘晓艳
朱小慧 盛德乔 康乐 伍仙凤 邵文 刘晓艳
(三峡大学医学院,宜昌 443002)
DEAF1(Deformed epidermal autoregulatory factor-1)最早是从果蝇的核抽提物中纯化得到的,也是果蝇早期胚胎发育所必须的一种序列特异的DNA 结合蛋白,能特异地与变形效应元件结合。与其它的转录因子一样,DEAF1 也有几个非常重要的功能结构域——氨基端的丙氨酸富含区,SAND(Sp100、AIRE-1、NucP41/75 及DEAF-1)结构域,螺旋-环-螺旋基元,MYND(myeloid、Nervy 及Deaf-1)结构域,核定位序列(Nuclear-localization sequence,NLS)和出核序列(Nuclear-export sequence,NES)[1]。SAND 结构域是一个DNA 结合结构域;MYND 结构域则含有两个非DNA 结合的锌指结构,它被认为可介导蛋白质-蛋白质之间的相互作用[2]。
最近的研究发现,转录因子DEAF1 在小鼠胰淋巴结中调控着一系列外周组织抗原(peripheral tissue antigen,PTA)基因的表达,而且,DEAF1 的功能异常与NOD 小鼠1 型糖尿病的发生密切相关[3,4]。最新研究发现,DEAF1 在淋巴结基质细胞还可以通过调控真核翻译起始因子Eif4g3 的表达而在翻译水平上调控很多PTA 基因的表达[5]。PTA 基因在淋巴结中的异位表达并有效提呈是外周免疫耐受建立的重要机制之一[6],DEAF1 可能在这个过程中发挥了重要作用。
本研究拟利用多克隆抗体制备技术来制备小鼠DEAF1 的多克隆抗体,旨在为研究小鼠淋巴结中内源性DEAF1 的表达及DEAF1 调控外周组织抗原表达的分子机制奠定基础。
1 材料与方法
1.1 材料
带有小鼠DEAF1 cDNA 的原核表达质粒pET-28a(+)-mDF1 和真核表达质粒p3xflag-CMV-10-mDF1 由本课题组构建;Monoclonal ANTI-FLAG M2购自Sigma 公司;His-Tag(2A8)Mouse mAb 购于上海Abmart 公司;羊抗鼠IgG(H+L)-HRP 购于北京中杉金桥生物技术公司;293T 细胞株和Caski 细胞株由三峡大学分子生物研究所保存;BalB/C 小鼠购于三峡大学实验动物中心。
1.2 方法
1.2.1 原核蛋白的表达与纯化 将小鼠DEAF1 的原核表达质粒pET-28a(+)-mDF1 转化原核表达菌株E.coli BL21;挑取单克隆,37℃恒温培养12-16 h;按1∶50 比例转接上一步得到的菌悬液至50 mL LB(Kan+)培养液中;37℃,220 r/min 培养2-3 h(菌液OD=0.4-0.6)即对数期时,加入诱导剂IPTG(终浓度为1 mmol/L);37℃,220 r/min 培养10-12 h。
4℃,5 000 r/min 离心10 min 收菌;弃上清,10 mL 1×PBS 重悬沉淀;冰浴超声(功率400 W,超声2 s,间隔2 s,工作60 次,循环6 次);12 000 r/min,4℃离心20 min;上清制样,沉淀用于尿素梯度裂解。
1 mol/L Urea 5 mL 重悬沉淀,冰置裂解30 min;12 000 r/min,4℃离心10 min;上清制样,沉淀用2 mol/L Urea 5 mL 重悬,冰置裂解20 min;12 000 r/min,4℃离心10 min;上清制样,沉淀用3 mol/L Urea 5 mL 重悬,冰置裂解30 min;12 000 r/min,4℃离心10 min;上清制样,沉淀用4 mol/L Urea 5 mL 重悬,冰置裂解10 min;12 000 r/min,4℃离心10 min;上清制样,沉淀用5 mol/L Urea 2 mL 重悬,冰置裂解5 min;12 000 r/min,4℃离心10 min;上清制样后余下的-20℃保存,沉淀用6 mol/L Urea 1 mL 重悬,冰置裂解5 min;12 000 r/min,4℃离心10 min;上清制样后余下的-20℃保存,沉淀用7 mol/L Urea 1 mL重悬,冰置裂解5 min;12 000 r/min,4℃离心10 min;上清制样后余下的-20℃保存,沉淀用8 mol/L Urea 1 mL 重悬;冰置裂解2 h,裂解产物制样后-20℃保存。
将尿素梯度裂解纯度较高的蛋白进行透析,逐步去除尿素;用Millipore 公司提供的50 mL 超滤管浓缩;最后利用全波长酶标仪以BSA 建立的标准曲线做参照,测定蛋白的浓度;所得蛋白-40℃保存。纯化的蛋白用SDS-PAGE 检测和Western blot 鉴定。
1.2.2 动物免疫及多克隆抗血清的制备 以纯化获得的小鼠DEAF1 重组蛋白为抗原与完全弗氏佐剂等体积混合;冰浴超声乳化后,皮下多点注射4-6 周龄的Balb/C 小鼠4 只,每只小鼠50 μg 抗原蛋白。4周后,进行第2 次免疫:等体积混合抗原溶液与不完全弗氏佐剂;冰浴超声乳化后,皮下多点注射,每只小鼠25 μg 抗原蛋白。2 周后,进行第3 次免疫,操作与第2 次免疫相同。1 周后,免疫小鼠断尾取血,通过间接ELISA 法检测其血清的效价。之后,眼球取血效价达标的Balb/C 小鼠,以获得多克隆抗血清。
1.2.3 鼠抗DEAF1 多克隆抗血清用于Western blot检测真核细胞表达的DEAF1 蛋白 瞬时转染小鼠DEAF1 的真核表达质粒p3xflag-CMV-10-mDF1 至人肾上皮细胞系293T 中;48 h 后裂解细胞收取总蛋白制样。SDS-PAGE 电泳后转膜,5%牛奶室温封闭2 h;分别加入鼠抗DEAF1 多克隆抗血清(5%牛奶进行1∶5 000 稀释),β-Actin 鼠源单抗(利用5%牛奶进行1∶3 000 稀释)和Flag-Tag 单抗(利用5%牛奶进行1∶2 000 稀释),4℃孵育过夜;加入TBST洗涤3 次(10 min/次);加入羊抗鼠IgG-HRP(利用TBST 进行1∶5 000 稀释),室温孵育1 h;加入TBST 洗涤3 次(10 min/次);ECL 显影。
1.2.4 鼠抗DEAF1 多克隆抗血清用于免疫荧光 瞬时转染p3xflag-CMV-10-DF1 至人的宫颈癌细胞株Caski 中;24 h 后 重 新 铺24 孔 板;5% CO2培 养 箱37℃恒温培养至细胞处于最佳状态,用于后续试验。
1×PBS 漂洗3 次(5 min/次);4%多聚甲醛(500 μL/孔)固定15 min;1×PBS 漂洗3 次(5 min/次);0.5% Triton X-100(500 μL/孔)处理20 min;1×PBS 漂洗3 次(5 min/次);10%的山羊血清(500 μL/孔)37℃封闭20 min;吸去封闭液,加入制备的鼠抗DEAF1 多克隆抗血清(1×PBS 进行1∶500 稀释)4℃孵育过夜(以1×PBS 作为空白对照,未经免疫的Balb/C 小鼠的血清作为阴性对照);1×PBS漂洗3 次(5 min/次)。37℃避光加入荧光标记的二抗羊抗鼠Rhodamine(200 μL/孔)(1×PBS 进行1∶150 稀释)孵育30 min;1×PBS 漂洗3 次(5 min/次);荧光倒置显微镜观察分析,拍片记录结果。
1.2.5 DEAF1 多克隆抗血清用于免疫沉淀 瞬时转染小鼠p3xFlag-CMV-10-mDF1 至人的宫颈癌细胞株Caski 中;转染48 h 后,胰酶消化收集细胞;加入Western blot 裂解液冰浴裂解获得总蛋白;分组后,加入一抗,4℃孵育过夜。
取80 μL protein A 琼脂糖珠储存液;离心后弃上清,加入Western blot 裂解液洗涤沉淀3 次;加入80 μL Western blot 裂解液重悬沉淀;将重悬后的protein A 琼脂糖珠加到蛋白样品中(20 μL/份),4℃孵育4 h;离心弃上清后,加入Western blot 洗涤沉淀4 次;离心弃上清,沉淀制样;Western blot 检测免疫沉淀的结果。
2 结果
2.1 尿素梯度裂解包涵体纯化重组蛋白DEAF1
大量诱导重组蛋白DEAF1 在E.coli BL 21 中表达10 h(图1);收菌后超声破碎细胞;离心后的沉淀逐级裂解;各级裂解的产物制样后经SDS-PAGE电泳鉴定浓度和纯度,结果(图2)显示,经尿素梯度裂解,8 mol/L Urea 裂解的产物中,重组蛋白DEAF1 的相对含量最高。
2.2 Western blot鉴定重组蛋白的表达与纯化
上样诱导前后以及尿素梯度裂解包涵体7 mol/L尿素裂解的产物,进行SDS-PAGE 电泳;转膜后于5%牛奶中室温封闭2 h;加入6×His 鼠源单抗(5%牛奶进行1∶5 000 稀释)4℃孵育过夜;TBST 洗涤3次(10 min/次);加入羊抗鼠IgG-HRP(TBST 进行1∶3 000 稀释)室温孵育1 h;TBST 洗涤3 次(10 min/次);暗室内ECL 显影,结果(图3)显示,诱导纯化获得的蛋白为重组的DEAF1 蛋白。
2.3 鼠抗DEAF1多克隆抗血清的测定
以纯化获得的小鼠DEAF1 重组蛋白包被96 孔酶标板(100 μL/孔)通过ELISA 法测定小鼠血清的效价。结果(图4)显示,经过3 次免疫,4 只小鼠血清的效价均达到了较高的水平,以2 号小鼠血清的效价为最高,故将其用于后面的试验中。
2.4 DEAF1多克隆抗血清用于Western blot检测真
核表达的DEAF1蛋白
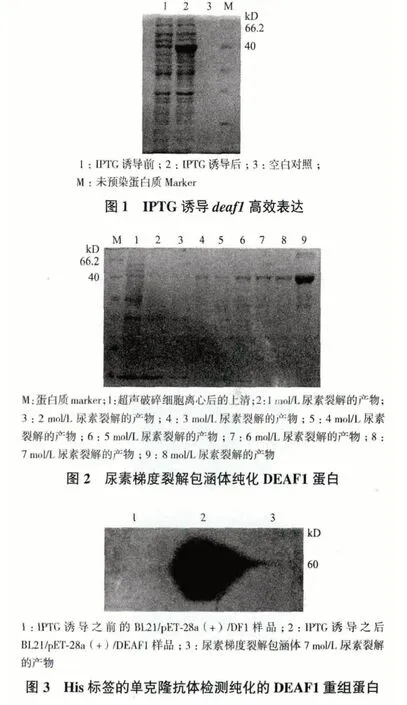
依据1.2.2 所述的方法将所制备的DEAF1 多克隆抗血清用于Western blot 检测293T 细胞中DEAF1的表达情况,结果(图5)显示,所制备的鼠抗DEAF1 多克隆抗血清可有效结合真核表达的DEAF1蛋白,具有较高的特异性。
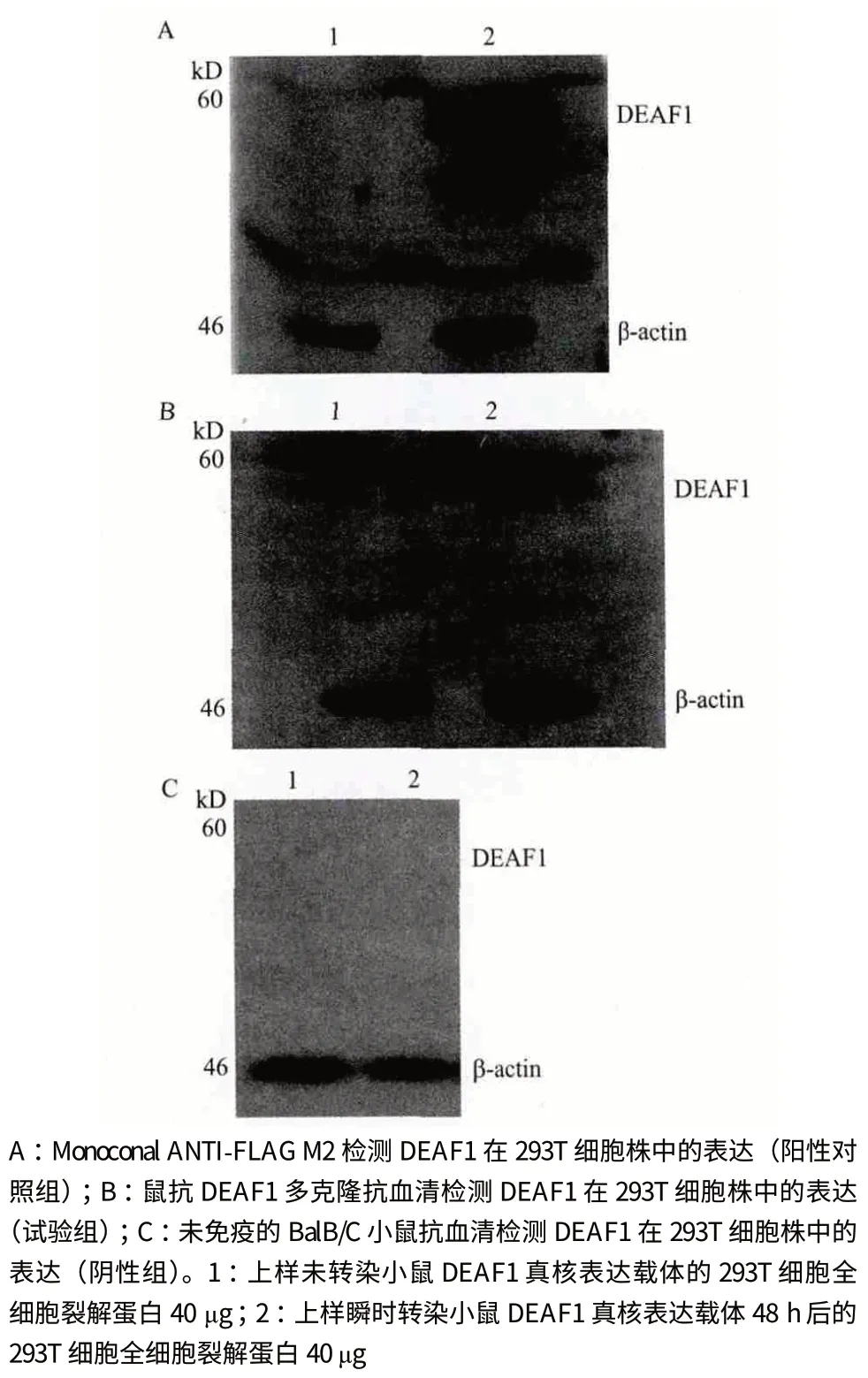
图5 Western blot 检测制备的鼠抗DEAF1 多克隆抗血清对于真核表达的DEAF1 蛋白的特异性和敏感性
2.5 DEAF1多克隆抗血清用于免疫荧光分析
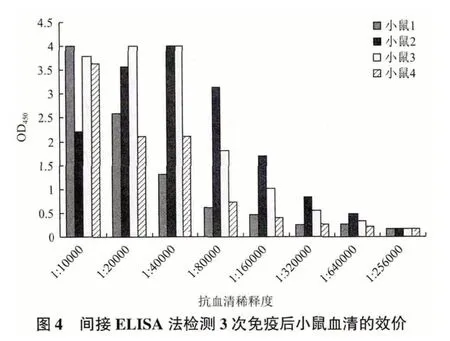
将所制备的DEAF1 多克隆抗血清用于分析DEAF1 在Caski 细胞中的定位,结果(图6)显示,DEAF1 蛋白主要定位于细胞核中,与文献报道相一致,表明所制备的DEAF1 多克隆抗血清具备较高的敏感性。

图6 制备鼠抗DEAF1 多克隆抗体用于免疫荧光法分析人宫颈癌细胞株Caski 中DEAF1 蛋白的表达(1∶500)(400×)
2.6 DEAF1多克隆抗血清用于免疫沉淀试验
除了特异性和敏感性,亲和力也是衡量抗体质量的一个重要指标。为此,本研究将所制备鼠抗DEAF1 多克隆抗血清用于免疫沉淀试验。结果(图7)显示,该鼠抗DEAF1 多克隆抗血清的亲和力足够沉淀Caski 细胞中所表达的DEAF1 蛋白。
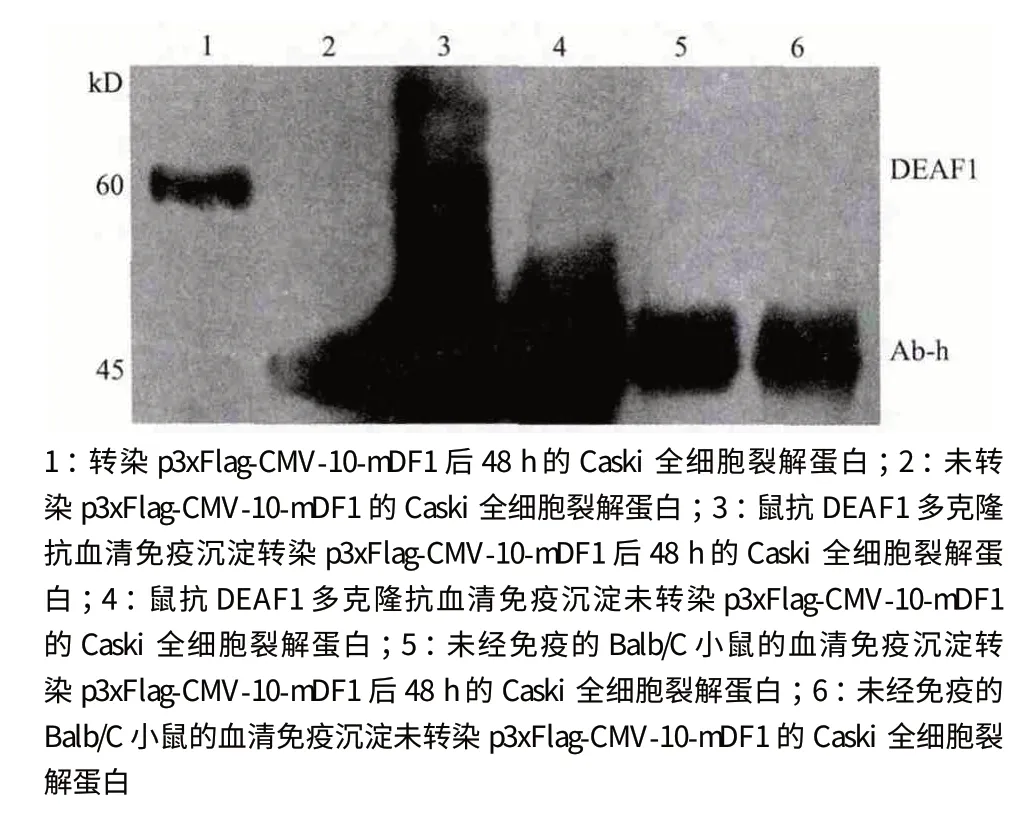
图7 制备鼠抗DEAF1 多克隆抗血清通过免疫沉淀试验检测 Caski,Caski/DEAF1 中的DEAF1 蛋白
3 讨论
最新研究发现,DEAF1 不仅可以直接控制几百种基因的转录,而且可以通过控制真核翻译起始因子Eif4g3 的表达间接控制多种基因的翻译,其功能异常与T1DM 的发生密切相关[3-5]。
已有的关于DEAF1 表达变化的研究只是转录水平,其蛋白水平的变化还不清楚。目前商品化的抗体特异性和敏感性都不是很好,故本研究拟制备合适的DEAF1 抗体,为研究小鼠胰淋巴结中内源性DEAF1 的表达及DEAF1 调控外周组织抗原表达的分子机制打下基础。
本研究将小鼠DEAF1 的原核表达质粒pET-28a(+)-mDF1 转化感受态E. coli BL21 后,经IPTG 诱导可高效表达出DEAF1 重组蛋白;但重组DEAF1蛋白以包涵体形式存在,所以采用了尿素梯度裂解包涵体的方法来纯化重组DEAF1 蛋白;以此重组蛋白为抗原与弗氏佐剂等体积混合后,皮下多点注射Balb/C 小鼠,最终成功制备出鼠抗DEAF1 的多克隆抗血清,经Western blot、免疫荧光、免疫沉淀分析鉴定,该鼠抗DEAF1 的多克隆抗血清具有较高的特异性、敏感度和亲和力,可为进一步开展DEAF1 的蛋白水平研究奠定基础。
另外,本研究所采用的尿素梯度裂解包涵体纯化蛋白的方法是在参照文献[8]的基础上,依据本试验的条件,自行摸索出来的方法。与其他蛋白纯化的方法相比[9-14],该方法不仅操作简单耗时短而且经济实用,所用的药品试剂方便易取,目的蛋白的回收率也比较高。
4 结论
本研究应用分子克隆和原核表达技术获得了原核表达的DEAF1 蛋白,利用改良的尿素梯度裂解法从包涵体中纯化得到了重组DEAF1 蛋白,以此重组蛋白免疫小鼠,制备鼠抗DEAF1 多克隆抗血清。ELISA、Western blot、免疫荧光、和免疫沉淀的结果表明,该多克隆抗血清具有良好的特异性、敏感性和亲和力,可用于内源性DEAF1 的表达及荧光定位分析。
[1] 盛德乔. Deaf1 的功能结构域分析和预测[J].医学分子生物学杂, 2011, 8(5):433-436.
[2] Mueller DL. Mechanisms maintaining peripheral tolerance[J]. Nat Immunol, 2010, 11(1):21-27.
[3] Kodama K, Butte AJ, Creusot RJ, et al. Tissue- and age-specific changes in gene expression during disease induction and progression in NOD mice[J]. Clin Immunol, 2008, 129(2):195-201.
[4] Yip L, Su L, Sheng D, et al. Deaf1 isoforms control the expression of genes encoding peripheral tissue antigens in the pancreatic lymph nodes during type 1 diabetes[J]. Nat Immunol, 2009, 10(9):1026-1033.
[5] Yip L, Creusot RJ, Pager CT, et al. Reduced DEAF1 function during type 1 diabetes inhibits translation in lymph node stromal cells by suppressing Eif4g3[J]. J Mol Cell Biol, 2013, 5(2):99-110.
[6] 伍仙凤, 盛德乔.外周免疫耐受机制的研究进展[J].免疫学杂志, 2013, 29(8):710-714.
[7] Westerberg LS, Klein C, Snapper SB. Breakdown of T cell tolerance and autoimmunity in primary immunodeficiency--lessons learned from monogenic disorders in mice and men[J]. Curr Opin Immunol, 2008, 20(6):646-654.
[8] J.萨姆布鲁克, D.W.拉塞尔, 著, 黄培堂, 等译.分子克隆实验指南[M].第3 版.北京:科学出版社, 2002.
[9] 肖琳, 薛强, 邹明强, 等.睾丸酮丛毛单胞菌ATCC11996 类固醇脱氢酶3α-HSD 高效表达与纯化[J].中国农业大学学报, 2013, 18(1):142-146.
[10] 李敏, 马兰芝, 白杰英, 等.猴免疫缺陷病毒衣壳蛋白 p27 在大肠杆菌中的表达及纯化[J].中国比较医学杂志, 2013, 23(1):1-4.
[11] 李丹, 初阳, 刘雅茹, 等.人源醛酮还原酶7A2 融合蛋白的纯化及其对苯代谢产物的催化活性[J].中国医科大学学报, 2013, 42(1):52-55.
[12] 邵坤彦, 彭宝玉, 叶程, 等.重组谷氨酰胺转胺酶的表达、复性及纯化[J].华中农业大学学报, 2013, 32(1):14-18.
[13] 黄鹏煌, 王泽, 田海山, 等.重组人成纤维细胞生长因子8b原核表达载体的构建和纯化研究[J].中国生物工程杂志, 2013, 33(1):14-19.
[14] 陈勋基, 陈果, 黄全生.玉米ZmCIPK42 原核表达载体构建及蛋白纯化[J].新疆农业科学, 2013, 50(1):33-37.
