假单胞杆菌BS1 转座突变及高产生物表面活性剂突变株初步筛选
2014-01-14侯巨梅韩巍国莉玲刘铜王彦杰
侯巨梅 韩巍 国莉玲 刘铜 王彦杰
(1. 黑龙江八一农垦大学农业部农产品质量安全监督检验测试中心,大庆 163319;2. 黑龙江八一农垦大学农学院植物病理与应用微生物研究所,大庆 163319;3. 黑龙江八一农垦大学生命学院,大庆 163319)
生物表面活性剂(Biosurfactant)是从生物来源分离得到的一类具有降低表面张力、稳定乳化、增加泡沫稳定性等表面特性的物质,通常有亲水基和亲油基两部分[1,2]。生物表面活性剂的表面活性与化学合成的表面活性剂相当,但具有可生物降解的优点,因而不会造成环境危害[3-5]。但是生物表面活性剂自被发现至今,由于受到较高生产成本的限制,只有少数产品走向市场,大多数产品仍处于试验阶段,并没有进行规模化生产。特别是野生发酵菌株生物表面活性剂的产量非常有限,发酵生产的成本较高,导致其经济效益低于化学合成表面活性剂,最终降低其市场竞争力[6,7]。
本研究小组在前期的工作中,从大庆的油井口分离、筛选到一株性能较好产生物表面活性剂的菌株,并通过生化指标和16S rRNA 鉴定为假单胞杆菌BS1[8],虽然通过发酵条件的优化产生物表面活性剂的产量有明显的提高,但是要应用于生产实际中还存在一定的距离。因此本研究以假单胞杆菌BS1为始发菌,利用转座突变技术构建假单胞杆菌BS1突变体,筛选高产表面活性剂突变株,旨在为进一步应用于生产实践及探索其分子代谢途径奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 野生型菌株假单胞杆菌BS1 为供试菌株,保存于植物病理与应用微生物研究所。大肠杆菌(E.coli)RR1(含转座子Tn917 的载体pTV1-OK)由美国Florida 大学Crowley 教授惠赠。
1.1.2 培养基和缓冲液 LB 培养基(g/L):胰化蛋白胨10,酵母提取物5,氯化钠10,琼脂18。缓冲液和高渗溶液:0.1 mol/L 磷酸二氢钠(pH7.0)溶液为缓冲液,加入0.8 mol/L 甘露醇为高渗溶液。SMM原生质体稳定液(mol/L):蔗糖0.5、MgC120.02,顺丁烯二酸0.02,调pH6.5。融合剂:40%聚乙二醇(PEG-4000)的SMM 溶液。溶菌酶液用SMM 溶液配制,终浓度为1 mg/mL,过滤除菌备用。原生质再生培养基:SMM 溶液加1.5% 琼脂。产生物表面活性剂的发酵培养基(g/L):硝酸钠1.5,硫酸铵1.5,磷酸氢二钾1.0,硫酸镁0.5,氯化钾0.5,硫酸亚铁0.01,氯化钙0.002,蒸馏水1 000 mL,液体石蜡5%,pH7.0。
1.2 方法
1.2.1 抗生素敏感性检测 供试菌株假单胞杆菌BS1 为始发菌,分别涂布在含(0、5、10、15 和20 μg/mL)红霉素(Erm)的LB 培养基上,于37℃培养24 h,确定假单胞杆菌BS1 对红霉素最敏感浓度。
1.2.2 质粒转化 将供试菌株假单胞杆菌BS1 在固体LB 培养基上,于37℃活化24 h 后,挑取单菌落置于LB 培养基中于37℃、180 r/min 振荡培养箱中培养,当生长至菌悬液OD600=0.8 时,离心收集菌体。菌体用磷酸缓冲液冲洗后悬浮于10 mL SMM 溶液中,然后加入10 mL 溶菌酶,混匀后于37℃保温30 min,然后用4 000 r/min 离心10 min,弃上清液,用高渗缓冲液洗涤除酶,然后将原生质体悬浮于200 μL 高渗缓冲液中。加入1 μg 质粒pTV1-OK 和1.8 mL 40% PEG 溶液,置36℃水浴保温处理2 min,4 000 r/min 离心10 min,收集菌体,将沉淀充分悬浮于2 mL SMM 溶液中,将原生质体涂布于原生质再生平板上(含50 μg/mL Kan,10 μg/mL Erm),28℃培养箱培养4 d。挑取从平板上长出的菌落,即为含质粒pTV1-OK 的菌体。
1.2.3 转座诱变和突变体库构建 挑取含质粒pTV1-OK 的转化菌株,接种于LB 培养液中(50 μg/mL Kan 和10 μg/mL Erm)中,28℃摇床中培养(180 r/min)24 h 后取50 μL 于10 mL LB 溶液中置于41℃水浴过夜。培养液按1∶100 稀释后涂布于Erm 单抗平板上进行培养。将长出的菌落分别点在Erm 单抗平板以及Erm、Kan 双抗平板的对应位置,挑取在双抗平板上未长而在Erm 单抗平板上长出的菌落,即为转座的菌株。按以上方法进行多次诱导,并将转座子接入含有Erm 的LB 中进行稳定性培养,然后转入甘油中保存,构建假单胞杆菌BS1 转座突变体库。
1.2.4 诱变突变体验证 将假单胞杆菌BS1 和突变体转接到新鲜的LB 中培养,收集菌体,提取基因组,根据Tn917 序列已报道的引物Tn1:5'-AACGACGAAACTGGCTAA-3' 和Tn2:5'-AGATGGAGCTGTCGACTCAC-3' 进 行PCR 反 应[9]。PCR 反 应 体 系(25 μL):Premix Taq 12.5 μL,DNA 模 板1 μL, 引 物Tn1 和 Tn2 各1 μL,ddH2O 9.5 μL。 PCR 扩增条件:94℃ 5 min;94℃ 1 min,52℃ 30 s,72℃ 2 min,共30 个循环;72℃ 10 min。PCR 反应后进行1.0%琼脂糖电泳检测。
1.2.5 高产表面活性剂突变体的筛选 将假单胞杆菌BS1 和转座突变体在牛肉膏蛋白胨斜面上活化24 h 后,用无菌水配制成菌悬液(107cfu);然后以3%的接种量将菌悬液接种于产生物表面活性剂的发酵培养基,置于30℃、180 r/min 振荡培养箱中培养7 d 后,4 000 r/min 离心10 min 收集上清液,进行乳化(E24)性能测定,测定方法参考文献[10]。假单胞杆菌BS1 为对照,试验重复3 次,数据采用DPS7.05 分析。
2 结果
2.1 供试菌株对抗生素敏感性检测
供试菌株假单胞杆菌BS1 分别接种于含有0、5、10、15 和20 μg/mL 红霉素的LB 培养基上。结果(图1)显示,假单胞杆菌BS1 在5 μg/mL 红霉素的LB 培养基上生长被部分抑制,在10 μg/mL 红霉素的LB 培养基上生长能够完全被抑制,因此10 μg/mL 红霉素被确定为最佳筛选转座突变体的浓度。
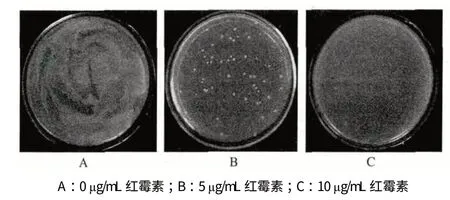
图1 供试菌株对红霉素敏感性检测
2.2 突变体的获得
用pTV1-OK 质粒对原生质进行转化,在含有10 μg/mL 红霉素和50 μg/mL 卡那霉素的原生质体再生平板上长出3 个菌株,通过反复转接抗性平板培养,最终获得3 株能够在双抗平板上稳定生长的菌株,这表明3 株转化子含有pTV1-OK 质粒(图2)。挑取其中一个阳性转化子进行诱导转座突变后,获得了在双抗平板上未长而在Erm 单抗平板上对应位置长出的菌落(图3),结果表明在诱导过程中,温敏型的pTV1-OK 质粒在41℃下过夜时不能复制,产生丢失,使菌株不能够产生Kan 抗性,但是转座子可以发生跳跃而插入到细菌的基因组,因此可以在Erm 单抗平板生长。通过多次转化试验一共获得650个转座突变体。
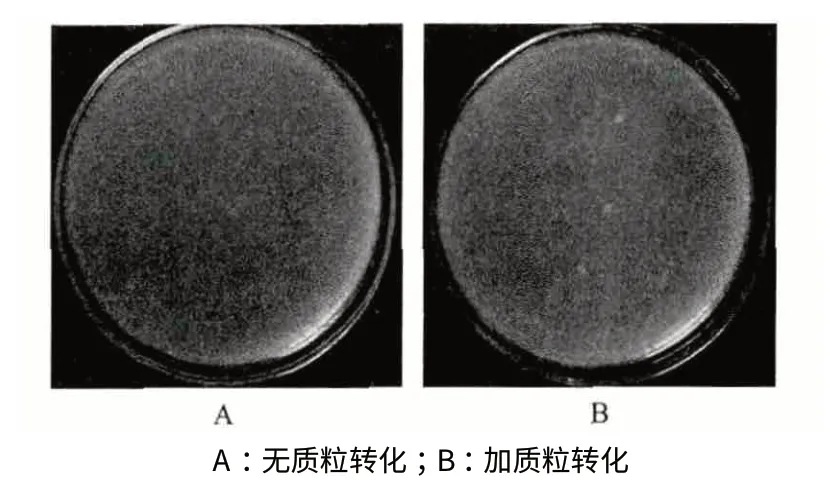
图2 pTV1-OK 质粒转化
2.3 突变体PCR检测
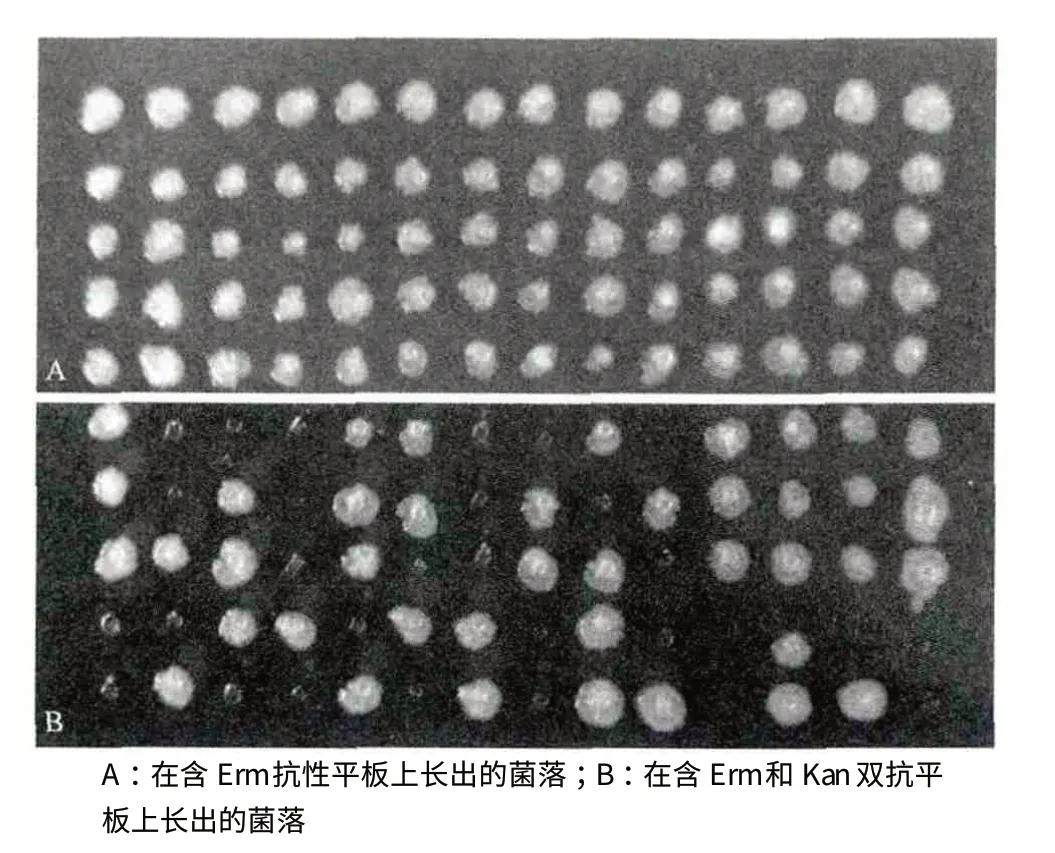
图3 转座突变体的挑选
通过提取菌株假单胞杆菌BS1 及其5 个随机挑取的转座突变株的总DNA,根据已知引物,对5 个突变株进行了PCR 检测。结果(图4)显示,所有突变株均能扩增出Tn917 中一段基因的片段(1 779 bp),与预期片段大小一致,表明Tn917 已成功插入基因组中,而野生菌没有扩增出相应的条带,说明在出发菌中没有Tn917 的插入。
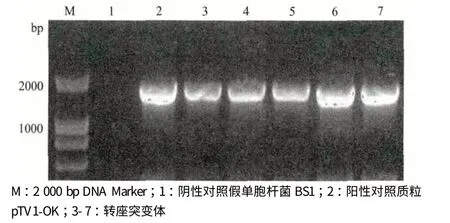
图4 PCR 验证Tn917 的插入
2.4 高产表面活性剂突变株筛选
通过对随机挑取的24 株转座突变体的乳化(E24)性能测定,发现大部分转座突变体与供试菌株的值相差不大,其中突变体T12 的E24 值达到67%,明显高于野生菌株,结果(图5)表明获得一株高产生物表面活性剂的突变体。
3 讨论
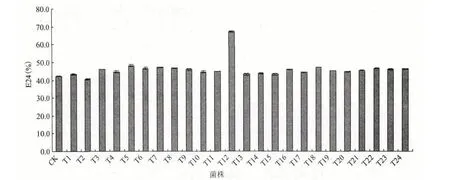
图5 野生菌株和转座突变体的乳化(E24)性能测定
生物表面活性剂由微生物代谢产生,其种类繁多、结构复杂,是一类由脂肪链和肽链组成的具有两亲结构的微生物次级代谢产物——微生物脂肽。由于其特殊的分子结构和多种生物学功能,微生物脂肽在医药、食品、化妆品及微生物采油等多个领域中有重要的应用前景[11,12]。据报道,由紫红诺卡氏菌(Nocardia rhodochrous)产生的海藻糖脂用于地下砂石中石油的回收,其回收率可提高30%[13]。从大庆油田分离的枯草芽孢杆菌(Bacillus subtitles)ZW-3 可产生的脂肽生物表面活性剂,当使用于采油时可提高采收率912%。但是由微生物来生产表面活性剂普遍存在发酵步骤繁杂、产量低、成本高等特点,成为其应用的瓶颈。
假单胞杆菌BS1 是从大庆油田分离的一株产鼠李糖脂的菌株,前期试验通过对培养碳源、接种量、温度、pH 值、盐浓度和培养基装液量的条件的优化,使其鼠李糖脂产生量有明显的提高,但是相对工业要求,其产量相对较低,在应用上还有一定的距离。为了更好的开发和利用该菌株,创建高效、高产、优质的假单胞杆菌BS1 品系成为拟要解决的问题。
转座诱变育种是利用转座子随机插入基因组方式引起基因的突变而获得一系列的重组子,通过筛选重组子获得符合育种目标的菌株。它不仅具有速度快、收效大、方法简单等优点,而且能够有效改善菌种特性、提高产品质量和简化工艺条件等特点。因此目前许多优良的微生物菌株是通过此方法获得的。例如,Koch[14]利用转座子诱变Pseudomonas aevuginosa 获得了提高二倍产量的生物表面活性剂突变株。吴慧玲[15]利用双亲接合的方法将含有Tn5转座子的质粒导入丁香假单胞菌大豆致病变种中,筛选出一株产冠菌素比出发菌高21 倍突变株。齐勇[16]通过转座诱导方法,建立了携带转座子Tn917的巨大芽孢杆菌(Bacillus megaterium1301)突变体库,通过生物测试法筛选出产细胞分裂素比野生型菌株显著提高突变体B1301-22。本研究也利用转座突变获得了650 个突变体库,通过对随机挑取的24个突变体的乳化性能测定,发现其中一株乳化性能比野生型有显著提高。乳化性能是测定生物表面活性剂含量指标之一,这说明试验可能获得一株高产表面活性剂的突变株,同时也表明转座突变能够快速、有效创建高产生物表面活性剂假单胞杆菌BS1新品系,为利用该菌株进行工业化生产奠定基础。
4 结论
本研究利用转座诱变方法成功突变了假单胞杆菌BS1,构建了含650 个转座突变体库,结合PCR技术证明了Tn917 质粒成功插入该菌基因组中。通过对随机挑取的24 个转座突变体的E24 值测定,获得一株乳化性能好的突变株,其E24 值高达67%。
[1] 陈忠喜, 郭书海, 刘广民, 等. 除油生物表面活性剂产生菌的分离及其特性[J]. 哈尔滨工业大学学报, 2007, 39(4):568-588.
[2] Kim SH, Lim EJ, Lee SO, et al. Purification and characterization of biosurfactants from Nocardia sp. L-417[J]. Biotech Appl Biochem, 2000, 31:249-235.
[3] 陈坚, 华兆哲, 伦世仪. 生物表面活性剂在环境生物工程中的应用[J]. 环境科学, 1996, 17(4):84-87.
[4] 王雨来. 新颖的生物表面活性剂[J]. 新技术、新产品、新工艺, 2002, 28(11):28-30.
[5] 杨丽, 李建波. 生物表面活性剂及在油田中的应用[J]. 内蒙古石油化工, 2006, 2:24.
[6] Lang S. Biological amphiphiles(microbial biosurfactant)[ J]. Curr Opini Colloid In, 2002, 7(1/2):12-20.
[7] 丁力孝. 脂肽生物表面活性剂的发酵生产及其结构、性质研究[D]. 杭州:浙江大学, 2004.
[8] Liu T, Hou JM, Zuo YH, et al. Isolation and characterization of a biosurfactant-producing bacterium from Daqing oil-contaminated sites[J]. Afr J Microbiol Res, 2011, 5(21):3509-3514.
[9] 陈永辉, 史贤明. 利用转座子Tn917 构建单核细胞增生李斯特菌菌膜形成突变株[J]. 微生物学报, 2005, 45(6):952-954.
[10] Kiran GS, ThomasTA, Selvin J, et al. Optimization and characterization of a new lipopeptide biosurfactant produced by marine Brevibacterium aureum MSA13 in solid state culture[J]. Bioresour Technol, 2010, 101:2389-2396.
[11] Desai JD, Banat IM. Microbial production of surfactants and their commercial potential[J]. Microbiol Mol Biol Rev, 1997, 61:47-64.
[12] Lang S, Wullbrandt D. Rhamnose lipids-biosynthesis, microbial production and application potential[J]. Appl Environ Microbiol, 1999, 1:22-32.
[13] Rapp P, Bock H, Wager F, et al. Use of trehalose lipids in enhanced oil recovery[J]. Biotechnol, 1977, 81:177-185.
[14] Koch AK, Käppeli O, Fiechter A, et al. Hydrocarbon assimilation and biosurfactant production in Pseudomonas aeruginosa mutants[J]. J Bacteriol, 1991, 173(13):4212-4219.
[15] 吴慧玲, 焦睿, 章家长, 李如虎. Tn5 转座诱变选育冠菌素耐高温生产菌株及其发酵条件研究[J]. 中国农业科技导报, 2009, 11(1):62-67.
[16] 齐勇, 黄玉杰, 李茹美, 等. 巨大芽孢杆菌Bacillus megaterium1301 的转座诱变[J]. 山东农业大学:自然科学版, 2008, 39(3):407-412.
