一株淡色生赤壳菌的生防作用分析及系统发育树构建
2014-01-14陈秀玲李景富张丽莉张俊峰王傲雪
陈秀玲 李景富 张丽莉 张俊峰 王傲雪
(东北农业大学,哈尔滨 150030)
随着市场需求量的增加,果蔬的种植面积越来越大,特别是保护地栽培面积的增加,病害的防控成为生产环节的重中之重。传统的化学防治,不仅造成果蔬上的农药残留,危及人畜健康,而且严重的污染环境,已不符合当前人们对品质生活的要求。同时,化学农药的大量使用,导致了耐药性菌株的出现,使防治效果不断下降[1-3]。运用微生物进行生物防治是一种有效的防治手段,在农业生产中的作用也逐渐体现[4]。近年来,越来越多的微生物被分离和鉴定出来,用于生物防治的研究[5,6]。
真核生物的rRNA 基因是高度重复的串联序列单位,由18S、5.8S 和28S rRNA 联结组成1 个转录单位,彼此被转录单元内间隔区(ITS)分开[7]。其中核糖体RNA 中的ITS 序列的进化速率较快,已被广泛用于探讨属内种间甚至种内个体间的遗传关系。在动物、高等植物、真菌以及藻类等种质鉴定及系统进化研究中发挥了重要作用[8-11]。
本实验室从草炭土中分离得到一株生防真菌,对多种病害均能起到抑制作用。本研究在对该菌生防作用研究的基础上,对其5.8S rDNA-ITS 的基因片段进行扩增分析,构建系统发育树,对其遗传分类地位进行分析,旨在为进一步利用该菌进行生物防治奠定理论基础。
1 材料与方法
1.1 材料
供试生防菌从吉林市郊草炭土中分离得到,供试病原菌番茄灰霉病(Botrytis cinerea)、番茄叶霉病(Cladosporium fulvum)、番茄绵疫病(Phytophthora parasitica)、番茄黄萎病(Vertillium dahliae)、番茄枯萎病(Fusarium wilt)、杨树烂皮病(Valsa sordida Nit.)、杨树枯萎病(Alternaria)、黑穗醋栗叶斑病(Pseudopeziza ribis Kleb.)病原真菌由实验室保存。
1.2 方法
1.2.1 供试生防菌的分离 采用平板分离法,每升分离培养基包含MgSO4·7H2O 0.5 g、K2HPO40.8 g、KCl 0.15 g、NH4NO31 g、葡萄糖3 g 和琼脂20 g。高压灭菌后,加入终浓度为0.5 g/L 的氯霉素制备分离平板,以抑制细菌的生长。取1 g 土样,溶解于9 mL 无菌水中,涂布平板后置于22℃恒温培养箱倒置培养,待长出菌落后,转接到马铃薯葡萄糖琼脂培养基(potato-dextrose agar,PDA)上,进行单孢分离。取纯化的菌落,进行后续试验。
1.2.2 供试菌株抑菌效果分析 利用对峙培养法,对供试菌株生防作用进行研究。生防菌与病原菌分别接种于相同组分的PDA 培养基上活化,然后分别从各活化菌落边缘用打孔器打下10 mm 直径的菌丝饼,将病原菌分别与生防菌对峙培养。生防菌菌丝饼与病原菌菌丝饼间距离为4 cm,并以单独培养的病原菌菌丝饼为对照。每组试验重复进行3 次,对峙培养试验培养皿在22℃恒温培养箱中倒置培养。分别在接种后第4 天、第8 天测量菌落生长直径,计算抑菌率。抑菌率计算公式为:抑菌率(%)=[(对照平均直径-处理平均直径)/对照平均直径]×100%。
1.2.3 供试菌株与番茄灰霉病病原菌共生的扫描电镜分析 供试生防菌与番茄灰霉病菌共培养在同一个培养皿中,两种菌接种间距为1 cm,在共培养的3、4、5、6 和7 d 分别取样,以供试生防菌和番茄灰霉病菌的单独培养为对照,扫描电镜下观察不同培养时间两种菌间的相互作用。
1.2.4 供试菌株基因组DNA 提取 从生长10 d 的PDA 固体培养基上刮取100 mg 菌丝体,在液氮中迅速研磨,基因组DNA 提取采用改良CTAB 法[12]。经5 μL RNaseA(10 mg/mL)的消化后,DNA 沉淀溶于30 μL ddH2O 中,经琼脂糖电泳及分光光度计检测后保存到-20℃备用。
1.2.5 供试菌株5.8S rDNA-ITS 基因片段扩增 5.8S rDNA-ITS 基因片段扩增采用引物ITS4 5'-TCCTCCG- CTTATTGATATGC-3',ITS5:5'-CCTTGTTACGACTTTTACTTCC-3'[13]。PCR 反应体系25 μL,包括DNA模板25 ng,上下游引物各1 μL,PCR 缓冲液(10×)2.5 μL,dNTP(2.5 mmol/L)2.0 μL,0.5 U Taq 酶1.0 μL,用ddH2O 补齐25 μL。扩增条件:94℃变性3 min;94℃变性40 s,52℃退火1 min,72℃延伸 2 min,35 次循环;最后72℃延伸10 min。利用UNIQ-10 柱式DNA 胶回收试剂盒(上海生工生物工程技术服务有限公司)纯化PCR 产物,peasy-T1 cloning vector试剂盒(北京全式金生物技术有限公司)连接、转化后,进行蓝白斑筛选。选取单克隆进行PCR 检测,阳性克隆送至北京六合华大基因科技股份有限公司测序。
1.2.6 序列分析及系统发育树构建 序列比对利用NCBI 数 据 库 的BlastX 工 具(http://www.ncbi.nlm.nih.gov/BLAST/)进行,序列多重比对利用EBI数据库的Clustal 在线工具(http://www.ebi.ac.uk/Tools/clustalw2/index.html)和Clustalx 2.012 软 件 进行[14]。系统发育树构建利用MEGA 5.0(http://www.megasoftware.net/)[15],采用相邻连接法(Neighborjoining,NJ)构建系统发育树,对构建的树进行自检(Bootstrap),重复设定为1 000 次。
2 结果
2.1 供试生防菌的获得及菌株抑菌效果分析
分离到的菌株培养初期菌落为白色,随培养时间的增加逐渐转黄;在光照条件下为粉红色或橘红色。抑菌试验(图1)表明,供试生防菌对供试病原菌都有一定抑制作用,抑菌效果随培养时间的增加而逐渐提高。供试生防菌与病原菌接触后病原菌菌落直径不再增加,而供试生防菌逐渐侵入病原菌生长圈。在培养后8 d 供试生防菌对B. cinerea、P. parasitica、P. ribis Kleb.抑菌率达87.5%,对Vertill- ium dahliae、Alternaria、F. wilt、C. fulvum 和V. sordida Nit.的抑菌率分别为80%、78%、75%、62.8%和62.5%,说明供试生防菌具有一定的抑菌作用。
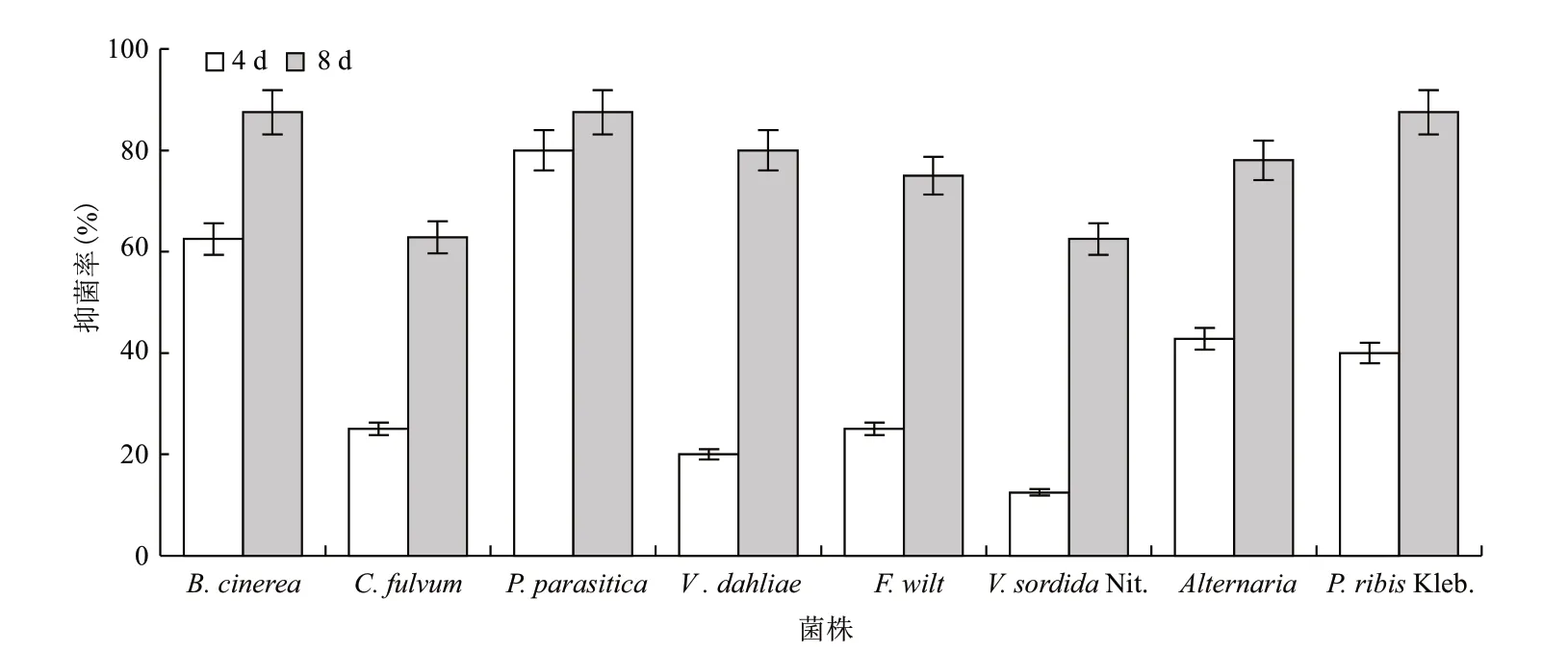
图1 抑菌效果分析
2.2 供试菌株与番茄灰霉病病原菌共生的扫描电镜分析
供试菌株与番茄灰霉病菌共培养时,番茄灰霉病的生长受到明显抑制。在共培养3 d 时,两种菌的菌丝刚刚接触,灰霉病病原菌的生长几乎未受到影响(图2-A)。随着共培养时间的增长(5 d),B. cinerea 的受抑制状况明显加强(图2-B)。到了共培养后期(7 d),灰霉病菌的菌丝体较弱,且无分生孢子产生,而供试生防菌生长旺盛,并且产生大量分生孢子(图2-C)。由此进一步证实番茄灰霉病病原菌的生长受供试生防菌的抑制。
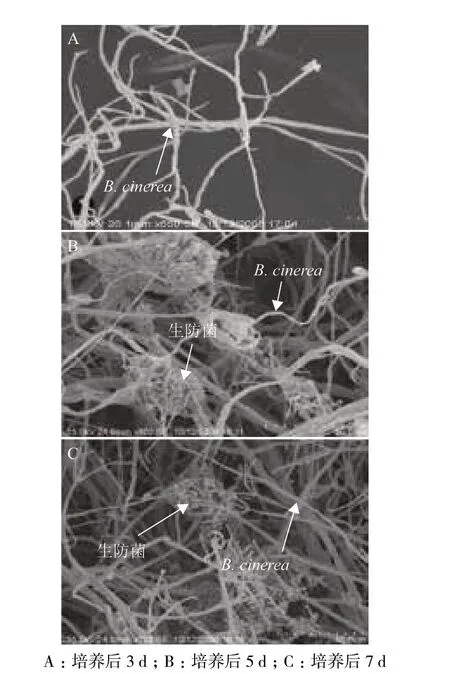
图2 供试菌株与番茄灰霉病菌共生的电镜分析
2.3 菌株DNA的提取
提取出的菌株DNA,稀释10 倍后,经紫外分光光度计测定,OD260/OD280>1.8,DNA 纯度较好。经计算后,DNA 浓度为396.5 ng/μL(表1)。
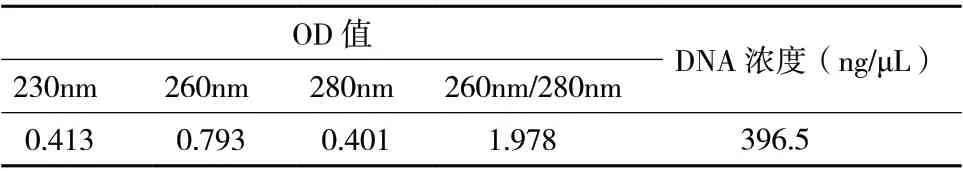
表1 菌株DNA 提取物纯度和含量测定结果
2.4 5.8S rDNA-ITS序列分析
以基因组DNA 为模板,通过PCR 反应,对5.8S rDNA-ITS 和18S rDNA 扩增产物纯化、测序后,得到593 bp 的片段(图3)。
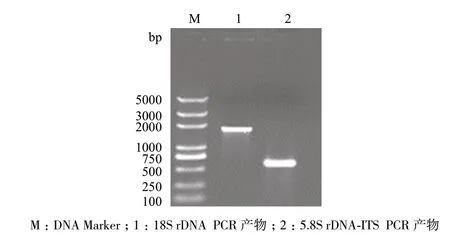
图3 18S rDNA 及 5.8S rDNA-ITS PCR 产物

图4 基于5.8S rDNA-ITS 序列的多序列比对分析
将测序得到的5.8S rDNA-ITS 序列与GenBank/EMBL/DDBJ 数据库中已知菌株的5.8S rRNA-ITS 经BLAST 搜索比对及(http://www.ebi.ac.uk/Tools/clus talw2/ index.html)和(http://www.ch.embnet.org/softw are/BOX_form.html)在线比对,得知5.8S rDNA-ITS序列包括了菌株的部分18S rDNA、全部ITS1、5.8S rDNA、ITS2 序列和部分28S rDNA 序列(图4)。该菌株5.8S rDNA-ITS 与Bionectria ochroleuca xsd08089(淡色生赤壳菌)最为接近,其相似性达94%。结合该菌株的菌落、菌丝及分生孢子的形态特征,初步确定该菌株属于淡色生赤壳菌。将该菌株5.8S rDNA-ITS 序列登陆GenBank,登记号为GU112754,命名为WY-1。
2.5 供试菌株的系统发育分析
在NCBI 数据库中,搜索已报道的具有生防作用的真菌的5.8S rDNA-ITS 序列,进行的系统发育树构建(图5)。以常见的木霉属(Trichoderma)为例,木霉属为无性型,其有性型为肉座菌属(Hypocrea),本研究中利用5.8S rDNA-ITS 序列将T. harzianum、T. viride、T. atroviride、H. pachybasioides 和H. virens 聚为一大类,表明此进化树构建成功。供试菌株WY-1与B. ochroleuca 和Clonostachys rosea 聚为一类,其中C. rosea 为B. ochroleuca 的无性型,进一步证明了供试菌株WY-1 属于淡色生赤壳菌。

图5 基于5.8S rDNA-ITS 序列的系统发育树
3 讨论
淡色生赤壳菌是优良的生防菌,是一类广泛存在于土壤中近似于木霉的植物病原真菌的重寄生菌,可寄生多种植物病原真菌的菌丝和菌核,具有较好的生防潜力,已用于防治多种植物病害。
核糖体RNA 基因(rDNA)序列分析被认为是最能反应物种之间遗传关系的指标之一[16],真菌核糖体内转录间隔区(ITS)是位于核糖体大小亚基rRNA 之间的区域,被5.8S rRNA 基因分隔为ITS1和ITS2 片段。ITS1 和ITS2 是中度保守区域,其保守性基本上表现为种内相对一致,种间差异比较明显。这种特点使ITS 非常适合于真菌物种的分子鉴定以及属内物种间或种内差异较明显的菌群间的系统发育关系分析[17,18]。
本研究通过对供试菌株的5.8S rDNA-ITS 序列的测序结果分析,确定该菌株为淡色生赤壳菌,但该菌株的5.8S rDNA-ITS 序列与GenBank 核酸数据库中的已知淡色生赤壳菌序列只有94%的相似性。说明该菌株在进化过程中基因发生了突变,发育成一株新的淡色生赤壳菌菌株,可用来防治菌核病菌、尖镰孢霉、最终极腐霉等真菌病害,在苗床使用其制成的菌剂,提高育苗与移植的成活率,保持秧苗健壮生长,被认为是以菌治菌最有希望的生物农药。
4 结论
本研究对一株从草炭土中分离的生防菌进行了抑菌作用分析,该菌对番茄灰霉病、番茄叶霉病、番茄绵疫病、番茄黄萎病、番茄枯萎病、杨树烂皮病、杨树枯萎病和黑穗醋栗叶斑病均有抑制作用。利用5.8S rDNA-ITS序列比对分析及系统发育树构建表明,该菌为淡色生赤壳菌,确定了其遗传分类地位。
[1] Palmer CL, Horst RK, Langhans RW. Use of bicarbonates to inhibit in vitro colony growth of Botrytis cinerea[J]. Plant Disease, 1997, 81(12):1432-1438.
[2] Knight SC, Anthony VM, Brady AM, et al. Rationale and perspectives on the development of fungicides[J]. Annual Reviews of Phytopathoogy, 1997, 35:349-372.
[3] Zhang CQ, Hu JL, Wei FL, et al. Evolution of resistance to different classes of fungicides in Botrytis cinerea from greenhouse vegetables in eastern China[J]. Phytoparasitica, 2009, 37:351-359.
[4] Sharma RR, Singh D, Singh R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:A review[J]. Biological Control, 2009, 50:205-221.
[5] Janisiewicz WJ, Pimenta RS, Jurick WM. A novel method for selecting antagonists against postharvest fruit decays originating from latent infections[J]. Biological Control, 2011, 59(3):384-389.
[6] Junaid JM, Dar NA, Bhat TA, et al. Commercial biocontrol agents and their mechanism of action in the management of plant pathogens[J]. Int J Modern Plant& Anim Sci, 2013,1(2): 39-57.
[7] 张志华, 洪葵.核酸序列直接分析在真菌鉴定方面的应用[J].华南热带农业大学学报, 2006, 12(2):39-42.
[8] Mark A, Ragan, Carolyn J, et al. Amolecular phylogeny of the marine red algae(Rhodophyta)based on the nuclear small-subunit rRNA gene[J]. Plant Biology, 1994, 91:7276-7280.
[9] Freshwarer DW, Fredericq S. A gene phylogeny of the red algae(Rhodophyta)based on plastid rbcL[J]. Plant Biology, 1994, 91:7281-7285.
[10] Gurgel CFD, Liao LM, Fredericq S, et al. Systematics of Gracilariopsis(Gracilariales, Rhodophyta)based on rbcL sequence analyses and morphological evidence[J]. Journal of Phycology, 2003, 39(1):154-171.
[11] 李敏, 隋正红, 易恒, 等.龙须菜5.8S rRNA 和ITS 区的克隆与系统学分析[J].中国海洋大学学报, 2009, 39:77-83.
[12] 吴发红, 黄东益, 黄小龙, 等.几种真菌DNA 提取方法的比较[J].中国农学通报, 2009, 25(8):62-64.
[13] White TJ, Bruns TD, Lee SB, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics, [M]//Imis MA. PCR Protocols:A guide to methods and applications. Academic Press, 1990:315-322.
[14] Larkin MA, Blackshields G, Brown NP, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23:2947-2948.
[15] Tamura K, Peterson D, Peterson N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 228(10):2731-2739.
[16] 孙广宇, 彭友良, 李振歧, 等.核苷酸序列分析在真菌系统学研究中的应用[J].西北农林科技大学学报:自然科学版, 2003, 31(6):187-192.
[17] 哈瑞根.食品微生物实验室手册[M].李卫华, 译.北京:中国轻工业出版社, 2004.
[18] 林晓民, 李振岐, 王少先.真菌rDNA 的特点及在外生菌根菌鉴定中的应用[J].西北农业学报, 2005, 14(2):120-125.
