鲤春病毒血症病毒G 蛋白的研究进展
2014-01-14张家林李洋李强
张家林 李洋 李强
(大连海洋大学 农业部北方海水增养殖重点实验室,大连 116023)
鲤春病毒症(Spring viraemia of carp,SVC)是由鲤春病毒血症病毒(Spring viremia of carp virus,SVCV,简称鲤春病毒)引发的危害鲤科鱼类的一种急性、高致死性的传染病。在欧洲、亚洲及北美广泛流行,对鲤科鱼类养殖造成巨大的经济损失[1]。世界动物卫生组织(OIE)将其列为必报的重要疫病,《中华人民共和国进境动物一、二类传染病、寄生虫病名录》(2008)列为一类动物疫病[2]。SVCV属于弹状病毒科(Rhabdoriridae)、水泡性病毒属(Vesiculorirus),为单股负链RNA 病毒。病毒基因组包含5 个开放阅读框(ORF),分别编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)和RNA聚合酶蛋白(L)[3]。其中,糖蛋白(G)是位于病毒囊膜表面的结构及功能蛋白,与病毒的感染[4],免疫识别[5]及病毒内吞[6]等功能密切相关。深入研究G 蛋白对于建立新型检测方法以及鲤春病毒血症的防治有重要意义。
1 G 蛋白结构与生物学功能
G 蛋白由509 个氨基酸残基组成,根据糖基化程度的不同,分子量介于76-88 kD[7]。靠近N 端上游有一段信号肽序列,C 端第476-499 位氨基酸残基之间拥有一个跨膜结构域。Roche 等[8]通过晶体衍射试验表明,G 蛋白是典型的Ⅱ型跨膜糖蛋白,以三聚体形式镶嵌在病毒囊膜表面,折叠成4 个不同的区域,存在5 个可能的糖基化位点。G 蛋白的糖基化主要有两种:O-糖基化和N-糖基化,O-糖基化位点主要位于氨基末端,N-糖基化位点可能位于28、181、338、362 和369 位点[9,10]。图1 为本实验室采用Phyre2 在线工具预测的G 蛋白结构。
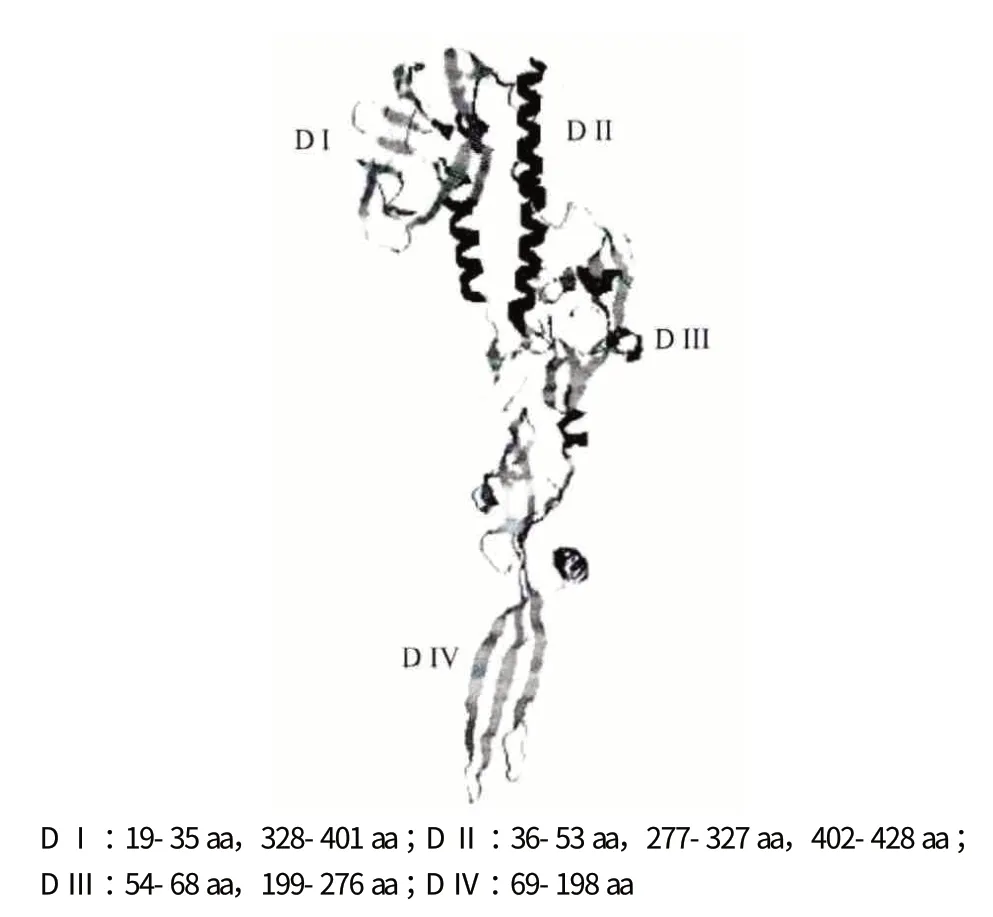
图1 Phyre2 工具预测的G 蛋白结构
病毒感染时,G 蛋白可选择性地与宿主细胞受体结合,在低pH 环境刺激下促使病毒囊膜与宿主细胞融合,核衣壳释放到细胞质中完成内吞[11]。G蛋白可诱导机体产生中和抗体(Viral neutralizing antibody),是研制鲤春病毒基因工程疫苗的重要靶点[12]。G 蛋白还是病毒抗原性和遗传性差异最大的结构蛋白,Stone 等[13]根据G 蛋白基因核苷酸序列以及抗原性差异,将SVCV 基因型分成Ⅰa、Ⅰb、Ⅰc 和Ⅰd 四个亚型,其中Ⅰa、Ⅰd 变异度较高。研究表明:G 蛋白与病毒毒力密切相关,不同毒力毒株G 蛋白的基因序列存在差异。Gaudin 等[14]发现G 蛋白存在R Ⅰ和R Ⅱ两大毒力区域,若同时发生突变,病毒毒力将明显降低。此外,G 蛋白拥有部分高度保守基因序列,可作为鉴别病毒的依据。
2 G 蛋白表达的研究进展
病毒天然蛋白的提取需要一定的设备和工艺程序,往往得率较低,难以大量分离。随着基因工程的发展,采用重组表达技术人工表达病毒蛋白,解决了病毒蛋白难以纯化的难题,为大量制备病毒蛋白提供了条件,有效地避免病毒泄露事故。目前已经有采用重组表达的蛋白制备单克隆抗体(Monoclonal antibody)的报道[15],国内外很多学者致力于重组表达G 蛋白,为研究G 蛋白的功能及制备抗SVCV 单克隆抗体准备材料。
大肠杆菌表达系统是发展最早,应用最广泛的表达系统。通常将构建的重组表达质粒转化至大肠杆菌感受态细胞中,通过IPTG 诱导获得目的蛋白[16]。它不仅操作程序简单、表达周期短,而且其表达产量远高于其他表达系统。张琳等[17]在表达C1 分离株G 蛋白时,将双酶切后的G 基因片段定向克隆至原核表达载体pET21a 上,转化到大肠杆菌BL21(DE3)中,经诱导,目的蛋白以包涵体形式实现高效表达,经包涵体变性、稀释复性、分子筛层析后,纯度达90%以上。杨振慧等[18]构建包含G 蛋白基因的重组表达质粒,转化入BL21(DE3)后实现高效表达,割胶回收包涵体、His 亲和纯化后制备兔抗血清,Western-blot 结果表明G 蛋白的兔抗血清能与病毒细胞培养物发生特异性反应。但是,大肠杆菌表达系统缺乏糖基化、脂肪酸酰化、磷酸化等翻译后修饰,影响目的蛋白的生物活性及功能[19]。
为了解决上述困难,很多学者开始采用真核表达系统表达G 蛋白,研究集中在杆状病毒表达系统及毕赤酵母表达系统上。昆虫/杆状病毒表达系统是当前最具潜力的表达系统,目前已经有近千种异源蛋白在此系统中得到高效表达,重组蛋白折叠正确、有一定的翻译后修饰、易于分离纯化[20]。一般是将目标蛋白编码序列克隆至杆状病毒转移载体上,通过同源重组构建重组病毒DNA,进而感染昆虫细胞产生重组蛋白。Huang 等[21]将连有鲤春病毒G 蛋白基因的重组转移质粒转化到含穿梭载体Bacmid 的感受态细胞DH10Bac 中,成功构建重组子rBacmid-SVCV/G,在脂质体介导下转染sf9 昆虫细胞,获得重组杆状病毒Bac-SVCV/G,采用间接免疫荧光和Western-blot 检测到G 蛋白在昆虫细胞膜上获得表达,并证明了G 蛋白可以介导细胞融合。研究还表明,利用重组杆状病毒Bac-CMV-EGFP 可以高效转导鱼类细胞系,使外源基因稳定、高量的表达。
然而杆状病毒表达系统不能连续表达外源蛋白,毕赤酵母表达系统具有特定的醇氧酶基因(Alcohol oxidase,AOX)启动子,将外源基因通过载体整合到酵母基因组后,以甲醇作为醇氧化酶的诱导剂,诱导AOX 启动子的转录翻译,从而可严格地调控外源基因的表达[22]。它既保留了原核表达系统培养周期短、产物易纯化的优点,又可以对外源蛋白进行一定的加工修饰,可用于大规模生产外源蛋白。付峰等[23]用穿梭载体pGAPZαA/B 构建含鲤春病毒G蛋白基因片段的重组表达载体,经线性化后采用电击法转化至毕赤酵母SMD1168 菌株,斑点印迹结果表明重组酵母菌株成功地表达G 蛋白。
3 G 蛋白在鲤春病毒血症预防上的应用
3.1 在鲤春病毒检测中的应用
目前OIE 规定的检测SVCV 的方法是基于单克隆抗体的间接酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)及间接免疫荧光试验(Indirect immunoinfluscent assay,IFA)。由于鲤春病毒变种多,制备通用的单克隆抗体较为困难,限制了该方法的应用普及。近几年国内外学者主要围绕G 蛋白基因的高度保守区,建立了一些检测SVCV方法。
3.1.1 套式RT-PCR 该方法是在RT-PCR 基础上,通过引入两套引物放大特定的DNA 片段。套式RTPCR 具有灵敏度高、特异性强和检测周期短的优点,但不适合无病检测,易出现假阳性。高隆英等[24]根据鲤春病毒G 蛋白编码基因序列,经过RT-PCR和半套式PCR 扩增出G 蛋白编码框的714 bp 和606 bp 片段,特异性试验表明该方法与其他弹状病毒没有交叉反应,该方法已成为我国检测鲤春病毒的国家标准(GB/T 15805.5-2008);Kim 等[25]在高隆英等研究的基础上进行方法改进,通过引入构建的阳性对照质粒,有效地减少了模板污染引起的假阳性现象。Kountná 等[26]根据G 蛋白基因保守序列设计4 条引物,建立了检测鲤春病毒的套式RT-PCR,该方法与狗鱼幼鱼弹状病毒(PFRV)等其他鱼类病毒无交叉反应,病毒细胞培养后其检测灵敏度达到10-1TCID50mL-1。
3.1.2 荧光定量RT-PCR 荧光定量RT-PCR 技术是在反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR 进程,最后通过标准曲线对未知模板进行定量分析。该方法可对病毒RNA 进行定量检测、灵敏度较套式RT-PCR 高一个数量级,有效避免交叉污染的机会。张利峰等[27]根据SVCV 的G蛋白编码基因保守区序列,建立了快速检测鲤春病毒的荧光RT-PCR 检测技术。灵敏度试验结果表明,将病毒悬液10-6稀释后应用此法仍可检出。为缩短检测时间、提高检测通量,刘宗晓等[28]根据G 蛋白基因序列设计引物,建立了多重实时RT-PCR 方法,能够同时定量检测SVCV、传染性造血器官坏死病毒(IHNV)、病毒性出血败血症病毒(VHSV)3 种弹状病毒,该方法的最低检测限分别为40 个拷贝、220 个拷贝和140 个拷贝,同时通过对80 份样品的检测、抗原捕捉方法和细胞培养试验,证实了方法的准确性,可用于疾病诊断和理论研究。
3.1.3 RT-LAMP RT-LAMP 技术是通过提取病毒RNA,利用逆转录酶的逆转录活性,采用4 条特异性引物及一种具有链置换活性的DNA 聚合酶,在恒定温度下对样品RNA 模板进行扩增。该技术不需要PCR 仪、程序简单快速、可检测到pg 级的病毒RNA。Shivappa 等[29]针对从美国卡罗莱纳州分离到鲤春病毒G 蛋白编码基因设计了4 套引物进行RT-LAMP 扩增,证实建立的RT-LAMP 方法是特异的,灵敏度与RT-PCR 方法近似,最低检测限为101TCID50mL-1。Liu 等[30]根据SVCV 糖蛋白基因的保守序列设计两个内引物和两个外引物,建立了快速检测SVCV 的一步法RT-LAMP 方法,结果表明该法可区分SVCV、PFRV、VHSV、IHNV 等弹状病毒,且具有与半套式RT-PCR 相同的灵敏度,通过与其他检测方法比较,证实RT-LAMP 检测技术更适合SVCV 的现场检测和大规模监控。
3.1.4 其他检测技术 除了上述核酸检测方法之外,G 蛋白作为特异性蛋白抗原,也可直接参与建立病毒免疫诊断方法。ELISA 法是历史上较为经典的诊断方法,目前已经有商品化ELISA 诊断试剂盒面世(鲤春病毒血症抗原检测试剂盒,BIO-X),该方法检测结果准确、直观、重复性好,但步骤较为繁琐费时,需要在酶标仪上完成检测。随着胶体金免疫层析技术和蛋白芯片在水产上的应用,建立基于G 蛋白的新型检测方法成为了今后一个阶段的研究热点,为实现快速、简便、灵敏地检测SVCV 提供了可能。
3.2 在构建DNA疫苗上的应用
目前SVCV 相关疫苗研究集中在灭活疫苗、亚单位疫苗及DNA 疫苗。传统灭活疫苗存在毒力返强的现象[31],而制备通用亚单位疫苗的难点在于G 蛋白的变异度较高。DNA 疫苗是继传统疫苗和基因工程亚单位疫苗之后的第三代新型疫苗,利用基因重组技术直接将抗原蛋白编码的外源基因导入鱼体细胞内,在宿主细胞中表达抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,以达到预防和治疗疾病的目的。它不但具有灭活疫苗的优点,还具有适于大批量生产、结构稳定、相对安全等优点,越来越受到人们的重视[32],具有广阔的应用前景。
欧阳征亮等[33]选取鲤春病毒 G 蛋白基因N 端去信号肽的1 000 bp 的片段,构建了糖蛋白基因的DNA 疫苗,肌肉注射后鱼体产生体液免疫应答和细胞免疫应答,免疫组相对保护率为22%。Emmenegger 等[34]利用分离至北美的鲤春病毒G 蛋白基因构建了DNA 疫苗,冷水刺激环境下进行攻毒试验,结果表明DNA 疫苗可明显降低感染鲤鱼的死亡率,相对免疫保护率为50%-88%。从试验结果来看,该DNA 疫苗具有良好的免疫原性,可作为鲤鱼和其他北美鱼种的预防性疫苗。Kanellos 等[35]构造了鲤春病毒 G 蛋白基因的DNA 疫苗,金鱼免疫试验表明,50%以上试验鱼出现特异性免疫反应,攻毒试验表明疫苗相对免疫保护率为48%。此外,还证明使用含CMV-Intron A 启动子的质粒以及加入先导序列mGM-CSF 和CpG 可明显加强疫苗的保护功效。
如何克服DNA 疫苗的低免疫原性及确保疫苗安全性是研制高效DNA 疫苗的关键。为了提高DNA疫苗免疫应答效果,国内外学者在替换启动子、优化免疫佐剂[36]以及改造宿主等方面进行研究,而DNA 疫苗安全性的讨论主要围绕在外源基因染色体整合问题及可能引发的自身免疫反应。
4 展望
对于G 蛋白结构、功能研究已取得初步进展,但到目前为止,其作用机理的研究还很缺乏。就目前的研究成果来看,G 蛋白是鲤春病毒主要的表面抗原,在病毒侵染宿主的过程中发挥重要作用,可以作为抗病毒药物作用的靶点。已有研究证实:针对G 蛋白的单克隆抗体具有中和活性,能消除病毒的感染能力[37]。但探讨G 蛋白介导病毒入胞的作用机理、制备抗G 蛋白的单克隆抗体具有重要意义,将有助于开发新型病毒诊断试剂及制备高效免疫保护疫苗。在以后的研究中应考虑以下几个方面的问题:(1)加深对蛋白结构、功能及作用机理的研究;(2)利用生物信息学技术分析G 蛋白的抗原表位;(3)寻找G 蛋白突变影响病毒变异的直接证据。随着各种技术手段的不断提高,G 蛋白将在病毒检测、抗病毒研究等方面体现更大的应用价值。
[1] Fijan N. Spring viremia of carp and other viral diseases of warmwater fish[J]. Fish Diseases and Disorders, 1999, 3:177-244.
[2] 王姝, 张利峰, 徐立蒲. 鲤春病毒核酸检测方法研究进展[J]. 检验检疫学刊, 2012, 22(3):49-51.
[3] Ahne W, Bjorklund H, Essbauer S, et al. Spring viremia of carp(SVC)[J]. Dis Aquat Organ, 2002, 52:261-272.
[4] Jorgensen PEV, Olesen NJ, Ahne W, et al. SVCV and PFR viruses:serological examination of 2 isolates indicates close relationship between the two fish rhabdoviruses[M]. Viruses of Lower Vertebrates, 1989:349-366.
[5] 刘荭, 付峰, 黄倢. 鲤春病毒血症病毒中国分离株糖蛋白基因和氨基酸序列的初步解析[J]. 中国病毒学, 2005, 20(6):647-651.
[6] Padhi A, Verghese B. Detecting positively selected codons in the glycoprotein of spring viremia of carp virus(SVCV)isolates from the USA and China[J]. J Fish Dis, 2008, 31:785-791.
[7] Hoffmann B, Schutze H, Mettenleiter T. Determination of the complete genomic sequence and analysis of the gene products of the virus of Spring Viremia of Carp, a fish rhabdovirus[J]. Virus Res, 2002(84):89-100.
[8] Roche S, Albertini J. Structures of vesicular stomatitis virus glycoprotein :membrane fusion revisited[J]. Cellular and Molecular Life Sciences, 2008(65):1716-1728.
[9] Hill B, Underwood B, Smale C, et al. Physico-chemical and serological characterization of five rhabdoviruses infecting fish[J]. Journal of General Virology, 1975, 27(3):369-378.
[10] Clerx J, Horzinek M. Comparative proteinanalysis of non-salmonid fish rhabdoviruses[J]. J Gen Virol, 1978, 40(2):287-295.
[11] 孙芳, 李玉霞. 病毒入胞机制研究方法及其研究进展[J]. 微生物学通报, 2010(1):46-50.
[12] Corbeil S, Lapatra S, Anderson E. Naked DNA vaccination of Atlantic Salmon Psalm to salar against IHNV[J]. Dis Aquat Org, 1999, 39:29-36.
[13] Stone DM, Ahne W, Denham KL. Nucleotide sequence analysis of the glycoprotein gene of putative spring viraemia of carp virus andpike fry rhabdovirus isolates reveals four genogroups[J]. Dis Aquat Org, 2003, 53:203-210.
[14] Gaudin Y, de Kinkelin P, Benmansour A. Mutations in the glycoprotein of viral haemorrhagic septicaemia virus that affect virulence for fish and the pH threshold for membrane fusion[J]. J Gen Virol, 1999, 80:1221-1229.
[15] 张志榜, 陈建飞. 猪流行性腹泻病毒M 蛋白单克隆抗体的制备及鉴定[J]. 中国预防兽医学报, 2011, 33(7):568-570.
[16] 张月, 兰邹然. 猪瘟病毒基因组蛋白结构及蛋白表达技术的研究进展[J]. 中国畜禽种业, 2012, 10:54-57.
[17] 张琳, 丁雅苓, 陈建民, 等. 中国鲤鱼春季病毒血症毒株糖蛋白基因的亚克隆表达与纯化[J]. 中国兽医杂志, 2011, 47(7):10-12.
[18] 杨振慧. 鲤春病毒血症病毒外膜蛋白G 和基质蛋白M. 的原核表达及多克隆抗体的制备[D]. 福州:福建师范大学, 2011:1-44.
[19] 范翠英, 冯利兴, 范金玲. 重组蛋白表达系统的研究进展[J]. 生物技术, 2012, 22(2):76-80.
[20] 刘高强, 章克昌, 王晓玲. 昆虫杆状病毒表达系统的研究与应用进展[J]. 中国生物工程杂志, 2004, 24(7):40-43.
[21] Huang FT, Li Qin, Cui XX, et al. Characterization of Spring Viremia of Carp virus glycoprotein expressed by recombinant baculovirus[J]. Pak Vet J, 2012, 32(3):334-338.
[22] 杨梅, 温真, 林丽玉. 毕赤酵母蛋白表达系统研究进展[J]. 生物技术通报, 2011(4):46-51.
[23] 付峰, 刘荭. 鲤春病毒血症病毒的克隆及其在毕赤酵母中的初步表达[J]. 海洋水产研究, 2007, 28(4):72-76.
[24] 高隆英, 史秀杰, 刘荭. 用RT-PCR 法快速检测鲤春病毒血症病毒基因[J] . 水生生物学报, 2002, 26(5):452-456.
[25] Kim HJ. Improved diagnosis of spring viremia of carp by nested reverse-transcription PCR:development of a chimeric positive control for prevention of false-positive diagnosis[J]. J Virol Methods, 2012, 185(1):39-42.
[26] Koutná M, Veselý T, Psikal I, et al. Identification of spring viraemia of carp virus(SVCV)by combined RT-PCR and nested PCR[J]. Dis Aquat Organ, 2003, 55(3):229-235.
[27] 张利峰, 张鹤晓, 乔卫虹. 荧光RT-PCR 检测鱼类鲤春病毒血症病毒的研究[J]. 检验检疫科学, 2005, 6:22-25.
[28] 刘宗晓, 刘荭, 李慧芳, 等. 一步法环媒恒温扩增(RT-LAMP)技术检测鲤春病毒血症病毒(SVCV)方法的建立和应用[C]. 2007 年中国水产学会学术年会暨水产微生态调控技术论坛论文摘要汇编, 2007.
[29] Shivappa R, Savan T, Kono T, et al. Detection of spring viraemia of carp virus(SVCV)by loop-mediated isothermal amplification(LAMP)in koi carp, Cyprinus caipio L. [J]. J Fish Diseases, 2008, 31(4):249-258.
[30] Liu ZX, Teng Y, Liu H, et al. Simultaneous detection of three fish rhabdoviruses using multiplex real-time quantitative RT-PCR assay[J]. J Virol Methods, 2008, 149(1):103-109.
[31] 马文婷, 张丽. 鲤春病毒血症的诊断及疫苗研究展望[J]. 天津水产, 2008(3):28-31.
[32] 许大明, 汉丽梅, 刘丹. DNA 疫苗在动物疾病预防中的研究进展[J]. 兽医研究, 2010(1):12-15.
[33] 欧阳征亮. 鲤春病毒血症病毒(SVCV)糖蛋白DNA 疫苗的构建及免疫效果的评估[D]. 广州:中山大学, 2006:1-76.
[34] Emmenegger EJ, Kurath G. DNA vaccine protects ornamental koi(Cyprinuscarpio koi)against North American spring viremia of carp[J]. Vaccine, 2008, 26(50):6415-6421.
[35] Kanellos T, Sylvester ID, D'Mello F, et al. DNA vaccination can protect cyprinus carpio against spring viraemia of carp virus[J]. Vaccine, 2006, 24(23):4927-4933.
[36] 白志坤, 冯新畅. DNA 疫苗免疫机制及预防新城疫病毒的研究进展[J]. 东北农业大学学报, 2007, 38(3):416-419.
[37] Chen ZY, Liu H, Li ZQ, et al. Development and charaeterization of monoclonal antibodies to spring viraemia of carp virus[J]. Vet Immunol Immunopathol, 2008, 123(3-4):266-276.
