复合酶法提取黄秋葵嫩果多酚的工艺优化
2014-01-10汪殿蓓李建华
汪殿蓓,李建华
特色果蔬质量安全控制湖北省重点实验室 湖北工程学院,孝感 432000
黄秋葵(Abelmoschus moschatus L.)是锦葵科一年生的草本植物,原产于非洲,果为蒴果,先端细尖略弯曲,形似羊角,又称羊角豆。黄秋葵果实是一种具有较高营养价值和显著保健功能的新型保健蔬菜[1],黄秋葵嫩果中蛋白质、总糖、多糖含量丰富[1,2],研究表明适量摄入黄秋葵果实粉能显著提高衰老小鼠的免疫功能和抗疲劳能力[3],说明黄秋葵嫩果中生物活性成分丰富。目前对黄秋葵嫩果中多糖[4]、果胶[5]等成分的提取工艺均有研究报道,但黄秋葵嫩果中多酚的提取工艺还未见报道。
植物多酚又称植物单宁,是植物体内的复杂酚类次生代谢产物,具有抗氧化、抑制酶活性、抑菌、抗致突变、消炎、降血压等多种生物活性,主要存在于植物体的表皮、根、叶、壳和果肉中[6-8]。多酚在食品及其他领域有着广泛的用途,从植物多酚中筛选功能食品或药品成分是近年研究的热点。本文以纤维素酶、甘露聚糖酶、果胶酶构成复合酶,采用复合酶法对黄秋葵嫩果中多酚提取工艺进行探讨,以期更进一步促进黄秋葵的开发与利用。采用酶法提取植物活性成分具有操作效率高、条件温和、无污染的特点[9]。
1 材料与仪器
2012 年4 月将黄秋葵种子播于湖北工程学院苗圃内,7 月份采摘嫩果,冷冻保存备用。没食子酸溶液、Folin-Ciocalteau 试剂(FC 试剂,自制,磷钼钨酸-碳酸钠显色体系)、蒸馏水、碳酸钠溶液(分析纯)、纤维素酶(宁夏夏盛实业集团公司)、甘露聚糖酶(宁夏夏盛实业集团公司)、果胶酶(湖州礼来生物技术有限公司)。
202-2 型干燥箱(上海市实验仪器总厂);PL203型电子天平(梅特勒-托利多仪器上海有限公司);H-4 数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);Cary 60 紫外可见分光光度计(安捷伦科技(中国)有限公司);康佳BCD-138UTS 冰箱(安徽康佳电器有限公司);ZWL-08B 台式离心机(金坛市鸿科仪器厂);康丽SO200-A 多功能搅拌机(顺德市宝锋电器厂);100~1000 μL 微量移液器。
2 实验方法
2.1 最大吸收波长的检测
将1.0 mL 50 μg/mL 没食子酸溶液加入1.0 mL FC 试剂(1 ∶1),然后加入3.0 mL 7.5%Na2CO3,蒸馏水定容至10.0 mL。20 ℃避光静置l h,在分光光度计下进行500~900 nm 扫描,确定最大吸收波长。
2.2 标准曲线的制作
参照邓义书等[8]的方法,测定并绘制没食子酸标准曲线。取1.0 mL 提取液于10.0 mL 试管中,加水3.0 mL,加0.2 mL FC 试剂,混匀,在30 sec 至8min 内加入0.6 mL 7.5% Na2CO3溶液,混匀,定容至10.0 mL,于45 ℃保温40 min,在测定的最大吸收波长下比色,每样重复测量3 次,取平均值。
2.3 三种酶单独使用时的最佳用量
酶发挥催化作用需要适当温度和pH 值条件,考虑到多酚在高温下容易氧化分解,调整pH 值会加入其它物质,在后续分离纯化中不易去净,本研究选取酶反应温度为40 ℃,自然pH 值(约为6.0)。
取45 只烧杯,分别加入1.00 g 黄秋葵嫩果粉末后,再分别加入30.0 mL 质量百分比为0.1%、0.5%、1.0%、1.5%、2.0%的纤维素酶(C1~C5)、甘露聚糖酶(H1~H5)和果胶酶(M1~M5),自然pH值,置于40 ℃恒温摇床中,200 rpm 提取1 h,迅速冷却至室温过滤,测定多酚含量(n=3),据此确定纤维素酶、甘露聚糖酶、果胶酶单独使用时的最佳用量。
2.4 正交试验设计
黄秋葵嫩果去杂后均浆,均质状态下称取3.00 g 置于50.0 mL 的试管中,加纯水27.0 mL,45 ℃提取2 h,离心,取上清液按上述方法测定黄秋葵多酚提取量。在30.0 mL 提取体系中,设计3 因素3 水平的正交试验,选用正交表L9(34)进行试验设计(表2),确定纤维素酶、甘露聚糖酶、果胶酶这三种酶的最佳组合比例(用量)。
2.5 响应曲面法优化复合酶提取工艺
在复合酶提取法中,提取时间、液料比以及提取温度对多酚的提取有较大的影响。在正交试验确定复合酶用量的基础上,用Design-Expert 软件中的中心组合设计(Central Composite Design,CCD)模块,设计了一组3 因素3 水平的实验(full CCD 设计),以确定提取时间、液料比以及提取温度对黄秋葵多酚提取的影响(表1)。
准确称取1.00 g 黄秋葵嫩果粉末,按照中心组合设计试验中设置的不同提取条件分别进行浸提,离心收集各个提取条件下得到的提取液,测定其多酚含量。每个处理重复3 次。

表1 试验的因素及水平编码Table 1 Factors and levels of response surface analysis
2.6 数据处理
实验数据采用Design Expert 软件进行多元回归及方差分析。
3 结果与分析
3.1 最大吸收波长
实验结果表明多酚(以没食子酸表示)在可见光区有一明显的吸收峰,仪器随机软件显示,波峰所在波长为768 nm。
3.2 没食子酸标准曲线
以吸光度值y 与没食子酸标准溶液浓度(x,mg/mL)绘制没食子酸标准曲线,其回归方程为y=0.015x+0.061,决定系数R2值为0.9950,表明没食子酸质量浓度与吸光度值具有良好的线性关系。
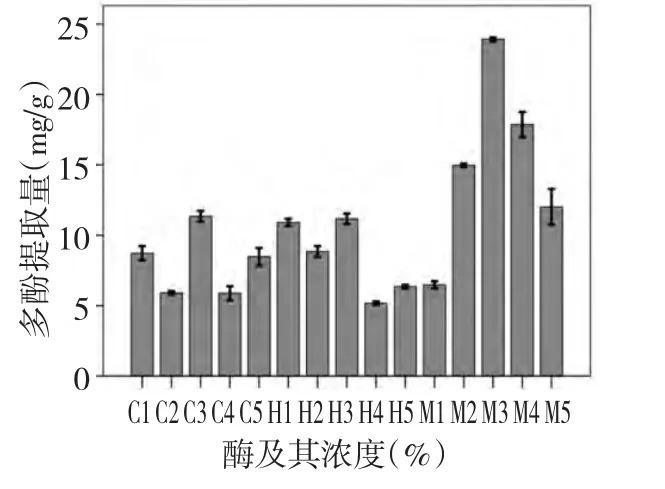
图1 三种酶在不同浓度下的多酚提取量Fig.1 Concentrations of polyphenols extracted by three enzymes at five concentrations
3.3 三种酶的最佳反应浓度
在不同浓度的纤维素酶(C1~C5)、甘露聚糖酶(H1~H5)和果胶酶(M1~M5)作用下,黄秋葵多酚含量如图1,结果显示,三种酶在浓度C3、H3、M3,即质量百分比为1.0%、浓度为10.0 mg/g 时提取的多酚含量最高。
3.4 正交试验结果
在30.0 mL 提取体系中,以三种酶单独作用时的最佳量即浓度1.0%(10.00 mg/g)为基准,设置3个水平—1.0%、2.0%、3.0%进行正交试验,结果表明,纤维素酶、甘露聚糖酶、果胶酶的最佳组合为C2H3M1,即每g 提取体系中加纤维素酶0.0050 万单位,甘露聚糖酶0.0075 万单位,果胶酶0.0025 万单位。

表2 正交设计及试验结果Table 2 Design and test results of orthogonal experiments
3.5 响应曲面分析试验方案及结果
以提取温度、液料比和提取时间为变量,用响应曲面法分析由2.0%纤维素酶、3%甘露聚糖酶和1%果胶酶组成的多酶复合体提取黄秋葵嫩果多酚的最佳工艺条件。以每克黄秋葵嫩果中总多酚提取量为响应值(Y),响应曲面分析试验设计及结果如表3 所示。

表3 响应曲面分析试验设计与结果Table 3 Design and results of response surface analysis

3.6 模型的建立及显著性检验
应用Design expert 软件对表3 中的数据进行多元回归拟合,得到黄秋葵嫩果多酚提取量对提取温度(A)、提取时间(B)、和液料比(C)的三次多项回归方程:

对所得模型进行显著性检验,回归方程系数及其显著性检验结果见表4。从表4 可以看出,该回归模型P<0.01,表明回归方程模型极显著;失拟项P=0.966 >0.05,表明失拟项不显著。方程的复相关系数R2为0.9930,为0.9814,说明模型回归方程的拟合程度良好,可用来分析和预测黄秋葵多酚的提取工艺。
从表4 的方差分析可知,回归模型的一次项中A(温度)、B(液料比)差异极显著,二次项中AC 项差异显著,BC、A2、B2、C2差异极显著,三次项中A2B、A2C 差异极显著,C(时间)项差异不显著,这表明不同的提取因素与黄秋葵多酚提取量不是简单的线性关系。

表4 回归模型的方差分析Table 4 Variance analysis of fitted cubic polynomial model

注:**差异极显著,* 差异显著。Note:** indicated very significant difference,* indicated significant difference.
3.7 响应曲面分析与工艺优化
根据回归方程绘出响应曲面图,以确定提取温度、提取时间和液料比三个因素对黄秋葵多酚提取效果的影响及这三个因素间的相互作用,响应曲面图如图2 和图3。提取温度与液料比之间交互作用不显著。
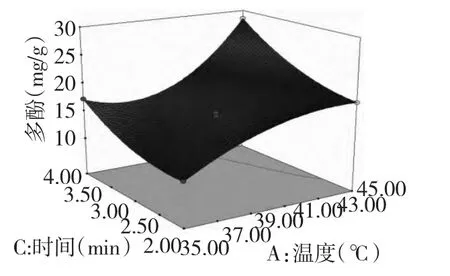
图2 提取温度和提取时间的响应曲面图Fig.2 Response surface plot of cross-interaction between extraction temperature and time on extraction yield of polyphenol from okra

图3 液料比和提取时间的响应曲面图Fig.3 Response surface plot of cross-interaction between liquid-solid ratio and extraction time on extraction yield of polyphenol from okra
响应面可以直接反应出各因子对响应值影响的大小,响应曲面法的图形是响应值Y 对应自变量A、B、C 构成的一个三维空间图,从响应面分析图上可以看出其在反应过程中的相互作用而确定合适的工艺条件[10]。如果响应面坡度相对平缓,表明其可以忍受处理条件的变异,而不影响到响应值的大小。相反,如果坡度非常陡峭,那么表明响应值对于处理条件改变非常敏感。由图2 和图3 可以看出,提取温度和液料比对黄秋葵多酚提取具有极显著影响,提取温度与提取时间、液料比与提取时间的两两交互作用显著,提取温度与提取时间、提取时间与液料比三次方项之间存在着显著的交互作用。
根据响应曲面优化的结果,黄秋葵嫩果多酚提取优化工艺条件为:提取温度44.97 ℃,液料比(mL∶g)58.80∶1,提取时间3.99 h,预测多酚提取值为29.193 mg/g。
3.8 验证实验
对响应曲面法获得的优化工艺条件进行验证,鉴于实际操作的可行性,提取工艺条件改为提取温度45 ℃,液料比(mL∶g)60∶1,提取时间4 h,实验测得黄秋葵嫩果多酚含量为29.156 mg/g,与预测值非常接近,说明通过响应曲面法优化的黄秋葵多酚提取工艺具有实践应用价值,是有效可行的。
4 结论
本试验在单因素实验和正交试验的基础上,获得2.0%纤维素酶、3.0%甘露聚糖酶和1.0%果胶酶的多酶复合体;应用响应曲面分析法对复合酶法黄秋葵嫩果多酚提取工艺进行优化,得到黄秋葵嫩果多酚提取量对提取温度(A)、提取时间(B)、和液料比(C)的三次多项回归方程:Y=-610.496 +34.129 A -1.604 B +239.13 C -12.988 AC +0.109 BC -0.419 A2+0.013 B2+1.845 C2-0.000024 A2B+0.164 A2C,该模型具有良好的预测效果。
根据回归分析结果得到复合酶法提取黄秋葵嫩果多酚的优化工艺为:提取温度44.97 ℃,液料比(mL∶g)58.80∶1,提取时间3.99 h,预测多酚提取值为29.193 mg/g。通过实践验证,该工艺条件有效可行,具有推广应用价值。复合酶法提取植物活性成分,具有无污染、条件温和、抽取效率高的特点,而且本试验中复合酶采用水溶解,兼顾了食品安全,因此该工艺可为黄秋葵多酚的批量生产提供参考。
1 Xue ZZ(薛志忠),Liu SY(刘思雨),Yang YH(杨雅华).Research progress on application value and development of Okra.Storage Process(保鲜与加工),2013,13(2):58-60.
2 Huang AG(黄阿根),Chen XH(陈学好),Gao YZ(高云中),et al.Determination and analysis of ingredient in Okra.J Food Sci(食品科学),2007,28:451-455.
3 Olatunji II,Ijiwole T,Awobajd FO.Evaluation of the deleterious effect of aqueous fruit extract of Abelmoschus esculentus(okra fruit)on some male reproductive parameters in Sprague dawley rats.J Phytol,2009,1:461-468.
4 Zhu ZP(祝子坪),Li N(李娜).Study on the detection method of okra polyphenols content.Jiangsu Agric Sci (江苏农业科学),2012,40:241-242.
5 Huang JB(黄剑波),Sun ZH(孙哲浩),Zhang YH(张英慧),et al.Study on extraction of pectin from Okra.Mod Food Sci Technol (现代食品科技),2011,23(2):51-53.
6 Shi EH(石恩慧),Guo KJ(郭凯军),Li H(李红),et al.Castanea mollissima Blume polyphenols:extraction technology optimization and its antioxidant activity.Acta Zoonutri Sin(动物营养学报),2013,25:406-411.
7 Zhang HJ(张海均),Jia DY(贾冬英),Sun H(孙慧),et al.Inhibitory effect of polyphenol extract from pomegranate peel and its purified fractions on α-glucosidase activity.Nat Prod Res Dev(天然产物研究与开发),2012,24:1253-1256.
8 Deng YS (邓义书),Bao HR(包海蓉),Qi ZG(齐知耕).Comparative study between different extraction methods of total polyphenols from mulberry dregs.Hunan Agric Sci(湖南农业科学),2010,15:106-108.
9 Lin ZQ(林志钦),Peng B(彭彬),Zeng SX(曾绍校),et al.Optimization of enzymatic extraction of flavonoids in Lotus germ by response surface analysis.J Chin Inst Food Sci Technol(中国食品学报),2012,12(3):45-51.
10 Shi TY(石太渊),Mao HY(毛红燕),Ma T(马涛),et al.Optimization of ultrasound-assisted extraction process of flavonoids from Liao Schisandra chinensis (Turcz.)Bail.China Brew (中国酿造),2011,227(2):96-99.
