1-辛基-3-甲基咪唑二氰铵盐/硫酸铵双水相体系分离纯化银杏黄酮
2014-01-10许雪磊李芬芳谭志坚
许雪磊,李芬芳,谭志坚
中南大学化学化工学院,长沙 410083
双水相体系最先由瑞典伦德大学Albertsson 于1956 年提出,并应用于生物活性物质的分离纯化,经过半个多世纪的发展,双水相体系在生物化学、细胞生物学、生物化工等领域得到广泛的应用[1,2]。双水相体系实质是把两种聚合物或者一种聚合物与无机盐以适当的浓度溶解在水中形成互不相溶的两相。然而,该技术在分离过程中存在一些问题,如易乳化,粘度大,分相时间长,成相聚合物成本高,聚合物回收难等[3]。
离子液体,是指在室温或者接近室温时由离子构成呈液态的物质,一般由有机阳离子和无机阴离子构成。作为一种新型的绿色溶剂,离子液体具有其它溶剂无法比拟的优点,如蒸汽压低、热稳定性和化学稳定性高、熔程宽、溶解能力强、具有可设计性等[3-5]。
离子液体双水相体系最先由Rogers[5]提出并应用于分离过程;He[6]用亲水性离子液体[C4mim]Cl-K2HPO4双水相体系从人尿中萃取分离睾酮、表睾酮;Li[7]等也用[C4mim]Cl-K3PO4从罂粟壳中提取鸦片生物碱;Tan[8]等用[C4mim][BF4]-NaH2PO4分离纯化芦荟多糖。本文通过建立亲水性离子液体1-辛基-3-甲基咪唑二氰铵盐[C8mim][N(CN)2]与(NH4)2SO4双水相体系,研究分离纯化银杏黄酮的最佳条件,实验结果令人满意。
1 材料与仪器
1.1 主要试剂和材料
离子液体 1-辛基-3-甲基咪唑二氰铵盐([C8mim][N(CN)2]),纯度>99%(中凯化工有限公司);芦丁(阿拉丁试剂);市售银杏叶(产自长沙);所需试剂均为分析纯,实验用水为二次去离子水。
1.2 仪器
电子天平FA2004(上海舜宇恒平科技仪器有限公司);紫外可见分光光度计755s(上海棱光技术有限公司);pH 计PHS-3C 型(上海精密科学仪器有限公司);电热恒温水浴锅GL-HH-S11-8 型(上海圣科仪器设备有限公司);旋转粘度计NDJ-79 型(上海森地科学仪器设备有限公司)
2 实验方法
2.1 标准曲线的绘制
称取芦丁10 mg 用60%的乙醇溶于100 mL 容量瓶中即(0.100 mg/mL),精密吸取芦丁标准溶液0、2.5、5.0、7.5、10.0 及12.5 mL,分别置于25 mL容量瓶中各加入30%乙醇使成12.5 mL,各精密加入5%的NaNO20.75 mL,摇匀后放置6 min,再各加入10%Al(NO3)30.75 mL。摇匀放置6 min 后,再加入1 mg/mL NaOH 5 mL,摇匀,用30%乙醇定容,混匀后放置15 min,得系列浓度为:0、0.01、0.02、0.03、0.04、0.05 mg/mL 的标准品工作液。以第一瓶作空白,在510 nm 波长下进行比色测定。用最小二乘法作线性回归,回归曲线:Y=10.24785X +0.00892,R=0.9995。
2.2 双水相体系萃取银杏总黄酮及其测定
向10 mL 的离心管中加入2.0 mL 二次蒸馏水,1 g 离子液体,0.5 mL 黄酮溶液,一定质量的盐。为了消除离子液体、盐的干扰,参比溶液加入相同的相成分除了黄酮溶液。混合物充分搅拌以至于盐完全溶解,很快溶液形成两相,上相富含离子液体及黄酮,杂质留在盐相中,记录上、下相的体积。用注射器将离子液体移至另一个10 mL 的离心管中,按上述方法测溶液的吸光度,从而计算出浓度。

Vt、Vb分别是上、下相的体积;

Ct、Cb分别是黄酮在上、下相的浓度;

V
t
、C
t
分别是上相的体积及黄酮浓度,m
s
总黄酮的质量。
3 结果与讨论
3.1 离子液体用量对萃取效率的影响
向体系中加入2.0 mL 二次蒸馏水,1.4 g(NH4)2SO4,0.5 mL 银杏黄酮溶液,改变离子液体的用量在0.6~1.4 g(13.33%~26.41%)之间。结果如图1 所示,随着离子液体含量的增加,萃取效率增大,当向体系中加入1.0 g 离子液体时,萃取效率达90.59%;继续增大离子液体的量时,萃取效率增加的不明显,考虑到节约离子液体用量,实验中离子液体的加入量为1.0 g。

图1 离子液体加入量的影响Fig.1 Effect of the amount of ionic liquid on extraction efficiency of G.biloba flavonoids
3.2 (NH4)2SO4浓度对萃取效率的影响

图2 不同质量分数的(NH4)2SO4对银杏黄酮萃取效率(E%)、分配系数(Kd)、相比(R)的影响Fig.2 Effect of different mass fractions of (NH4)2SO4on extraction efficiency (E%),partition coefficient(Kd)and phase ratio (R)of G.biloba flavonoids
向体系中加入2.0 mL 二次蒸馏水,1 g 离子液体,0.5 mL 银杏黄酮溶液,改变盐的用量,结果如图2 所示,在盐含量1.0~1.8 g(20.00%~31.03%)之间,随着盐含量的增加,萃取效率增大,是因为随着盐含量的增加,盐析能力增强。然而继续增加盐含量时萃取效率反而减小,可能由于盐浓度过大产生盐析效应的结果。分配系数的大小是由于体系中IL/黄酮、盐/黄酮、水/黄酮分子之间的相互竞争的结果。实验中盐的加入量为1.4 g,即18.52%[C8mim][N(CN)2]和15.93% (NH4)2SO4。
3.3 温度对萃取效率的影响
按照实验方法,固定其他条件。结果如图3 所示,随着温度的升高,萃取效率降低,相体积比减小,是因为随着温度的升高,水从离子液体相转移到盐相,导致上相体积减小,下相体积增大,所以上下相体积比减小;下相体积增大,盐浓度减小,盐析能力降低,温度升高离子液体在水中的溶解度增大,疏水性降低,所以萃取效率降低。

图3 不同温度对银杏黄酮萃取效率(E%)、相比(R)的影响Fig.3 Effect of temperature on extraction efficiency (E%)and phase ratio (R)
3.4 溶液酸度对萃取效率的影响
在其它条件固定不变的情况下,体系中加入不同pH 值的B-R 缓冲溶液。结果表明酸度对萃取效率影响不大,实验结果如图4 所示。银杏黄酮溶液显弱酸性,酸性条件下更有利于萃取的发生。实验测得盐相的pH 值为4.77,因此,体系中的pH 值不需要调节。
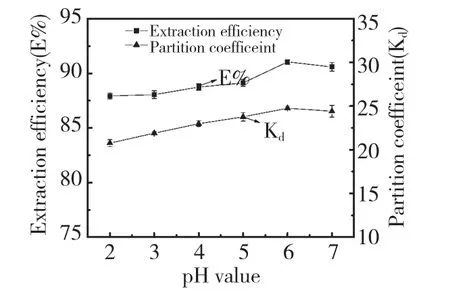
图4 对银杏黄酮萃取效率(E%)、分配系数(Kd)的影响Fig.4 Effect of pH value on extraction efficiency (E%)and partition coefficient (Kd)
3.5 离子强度对银杏黄酮萃取效率的影响
如图所示,随着NaCl 量的增加,萃取效率和分配系数是先增大后减小,NaCl 量为1.5 mmol 时均达到最大。这是因为NaCl 在两相中具有不同的分配系数,随着NaCl 质量的增加,两相间电位发生变化,从而使银杏黄酮的分配系数增大;但是增加到一定程度时,萃取极性增强,银杏黄酮的溶解度减小,所以萃取效率和分配系数减小。因此,最佳NaCl 的量为1.5 mmol。

图5 不同离子强度对银杏黄酮的萃取效率(E%)、分配系数(Kd)的影响Fig.5 Effect of NaCl on extraction efficiency(E%)and partition coefficient (Kd)
3.6 无机盐的回收
将富含(NH4)2SO4的下相溶液,加入甲醇后能够将无机盐结晶回收。当甲醇与下相溶液的体积比为2 时,回收率能够达到91.00%,再增加甲醇,回收率增大的不是很明显。
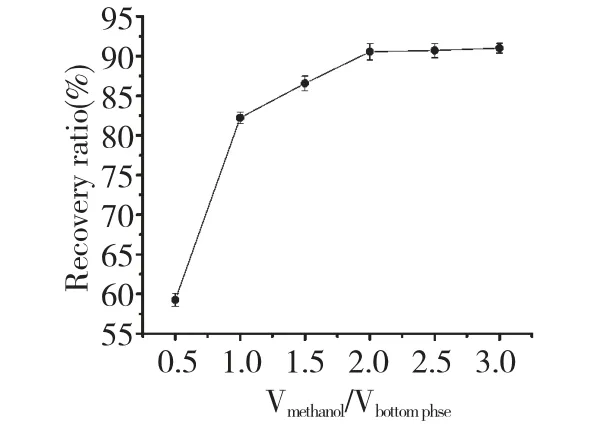
图6 甲醇与盐相的体积比对(NH4)2SO4回收率的影响Fig.6 Effect of volume ratio of methanol added to bottom phase on recovery rate of (NH4)2SO4
3.7 与其它双水相分离纯化银杏黄酮的对比
与传统的PEG、表面活性剂等双水相体系相比,离子液体盐双水相体系在分离纯化银杏黄酮时,萃取效率高,粘度低。

表1 银杏黄酮在不同双水相体系中的萃取效率及其上、下相的粘度Table 1 The extraction efficiency and viscosity of different ATPSs
4 结论
[C8mim][N(CN)2]/(NH4)2SO4双水相体系分离纯化银杏黄酮时萃取效率高,体系的粘度低。体系由18.52% [C8mim][N(CN)2],25.93%(NH4)2SO4构成,加入1.5 mmol NaCl,在室温下进行萃取时萃取效率最佳。同时实验过的富含(NH4)2SO4下相溶液,加入甲醇结晶回收。
1 Albertsson PA.Partition of Cell Particles and Macromolecules.3rd ed.New York:Wiley-Interscience,1986.
2 Xing JM(邢健敏),Li FF(李芬芳),Zhao HX(赵红霞),et al.Preparation of nicotine by aqueous two phase system/reverse extraction.Nat Prod Res Dev (天然产物研究与开发),2009,21:489-491.
3 Chen J,Liu HZ,Wang B,et al.Application of spontaneous suction phase-dispersing (SSPD)extractors in the extraction of penicillin G.Appl Biochem Biotechnol,2002,97:660-671.
4 Seddon KR.Ionic liquids for clean technology.Chem Tech Biotechnol,1997,68:351-356.
5 Gutowski EK,Broker AG,Rogers DR,et al.Controlling the aqueous miscibility of ionic liquids:Aqueous biphasic systems of water-miscible ionic liquids and water-structuring salts for recycle,metathesis,and separations.J Am Chem Soc,2003,125:6632-6633.
6 He CY,Li SH,Liu HW,et al.Extraction of testosterone and epitestosterone in human urine using aqueous two-phase systems of ionic liquid and salt.J Chromatogr A,2005,1082:143-149.
7 Li SH,He CY,Liu HW,et al.Ionic liquid-based aqueous two-phase system,a sample pretreatment procedure prior to high-performance liquid chromatography of opium alkaloids.J Chromatogr B,2005,826:58-62.
8 Tan ZJ,Li FF,Xu XL,et al.Simultaneous extraction and purification of aloe polysaccharides and proteins using ionic liquid based aqueous two-phase system coupled with dialysis membrane.Desalination,2012,286:389-393.
