海洋真菌Penicillium sclerotiorum FS50 的化学成分研究
2014-01-08陶美华李乐军陈玉婵霍光华章卫民
陶美华,李乐军,陈玉婵,霍光华,章卫民*
1省部共建华南应用微生物国家重点实验室 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室广东省微生物研究所,广州 510070;2 江西农业大学生物科学与工程学院,南昌 330045
海洋微生物长期生活在海洋环境中,具有应对高盐、弱碱性、低营养、缺氧等恶劣环境的能力,在其生长过程中能够产生有别于陆生微生物的次级代谢产物,其中海洋真菌因其生长速度快、易于培养、可通过大规模发酵实现工业化生产等优势受到人们的广泛关注。海洋真菌的次生代谢产物结构类型多样,主要包括聚酮类、萜类、甾体、生物碱、肽类及其它含氮化合物等[1],其中不乏活性显著、结构新颖的化合物[2]。海洋真菌已成为继海洋放线菌之后的又一研究热点。
为了从海洋真菌中寻找结构新颖的活性代谢产物,本课题组对分离自南海沉积物的海洋真菌进行了抗肿瘤、抗菌活性筛选,发现菌核青霉Penicillium sclerotiorumFS50 对肿瘤细胞MCF-7 的抑制率为97.6%,对金黄色葡萄球菌的抑制率为72.8%[3]。本研究在此基础上对菌株FS50 的次级代谢产物进行深入研究,从该菌株的液体发酵产物中共分离得到9 个化合物,分别鉴定为penicilazaphilone B(1)、sclerotioramine(2)、紫檀醇(3)、亚油酸甘油酯(4)、(3β,5α,6β,22E)-6-methoxyergosta-7,22-diene-3,5-diol(5)、啤酒甾醇(6)、对羟基苯乙酮(7)、酪醇(8)、邻苯二甲酸二(2-乙基)己酯(9)(图1)。其中化合物3 为首次从青霉属中分离得到,化合物2、4、5、6、8、9 为首次从菌核青霉中分离得到。化合物3同时存在于发酵液及菌丝体中,化合物1、7 为从发酵液中获得,化合物2、4、5、6、8、9 为从菌丝体中获得。
1 仪器与试剂
AVANCE III 型500 MHz 核磁共振波谱仪,Bruker 公司;PZ1000B 旋转式大容量普通摇床,武汉瑞华仪器设备有限公司;RE-2000 型旋转蒸发仪,上海亚荣生化仪器厂;超净工作台,上海恒益科技有限公司;LC-20AT 型高效液相色谱仪,日本岛津公司;柱层析硅胶(100~200 目、200~300 目),青岛海洋化工厂;高效薄层硅胶板Silica gel 60 F254,Merck 公司;C18反相硅胶(40~75 μm),Fuji Silysia Chemical Ltd.;凝胶Sephadex LH-20(18~110 μm),Amersham Biosciences;溶剂及试剂均为分析纯,购自广州化学试剂厂。
2 菌种与发酵培养
菌株FS50 于2009年12月分离自南海(21°30.736'N,116°54.842'E)336 米深处的沉积物,经鉴定为菌核青霉(Penicilliumsclerotiorum)[3]。发酵培养基为马铃薯葡萄糖(PD)液体培养基:马铃薯200 g/L,葡萄糖20 g/L,KH2PO43 g/L,MgSO41.5 g/L,海盐15 g/L,维生素B110 mg/L,pH 自然。用接种针挑取适量活化好的菌体接种到装有250 mL PD 液体培养基的500 mL 锥形瓶中,在28 ℃、130 rpm 条件下摇床培养3 d,获得种子液。将种子液按照5%的接种量接种到装有250 mL PD 液体培养基的500 mL 锥形瓶中,培养条件与种子液相同,培养时间为7 d,共发酵100 L。
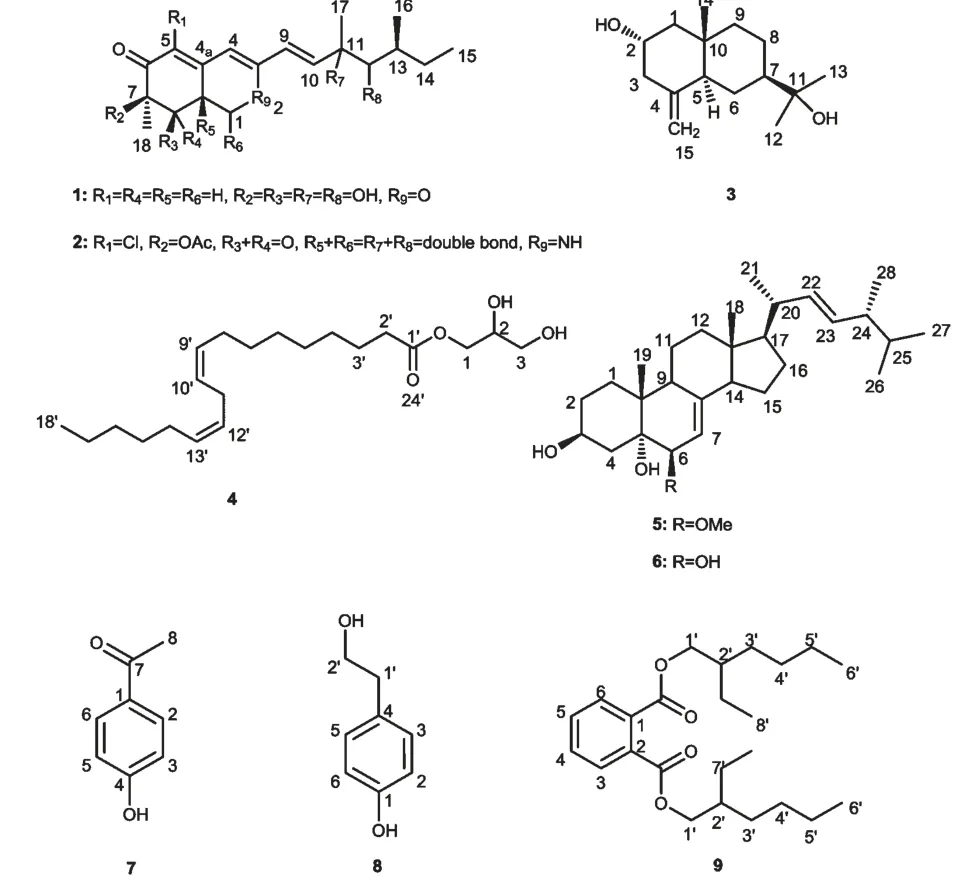
图1 化合物1~9 的结构式Fig.1 Chemical structures of compounds 1-9
3 提取与分离
发酵产物经过滤得发酵液和菌丝体,发酵液用乙酸乙酯按1∶1 比例萃取4 次,40 ℃下减压浓缩得浸膏28 g;菌丝体置于50 ℃烘箱中烘干后粉碎,甲醇浸泡并用超声波破碎细胞壁,共浸提4 次,收集甲醇提取液浓缩至无醇味,加适量水悬浮,再用乙酸乙酯萃取5 次,40 ℃减压浓缩得浸膏98 g。发酵液提取物浸膏过正相硅胶柱,以石油醚/乙酸乙酯(50∶1→1∶2)及氯仿/甲醇(15∶1→1∶1)梯度洗脱,得到组分F-A~F-C。石油醚/乙酸乙酯(5∶1)洗脱得到的F-B 组分经凝胶柱二氯甲烷/甲醇(1∶1)洗脱得到组分F-B-1,再经半制备HPLC 甲醇/水(50∶50→70∶30)梯度洗脱,分别得到化合物7(15.5 mg)和3(2.3 mg)。氯仿/甲醇(10∶1)洗脱下来的组分F-C 用甲醇/水(70∶30)洗脱得到化合物1(17.3 mg)。菌丝体提取物浸膏过正相硅胶柱得到6 个组分J-A~JF。石油醚/乙酸乙酯(8∶1)洗脱得到组分J-A 经凝胶柱二氯甲烷/甲醇(1∶1)洗脱得到化合物3(30.0 mg)。石油醚/乙酸乙酯(3∶1)洗脱得到组分J-B 以甲醇/水(50∶50)为洗脱剂经C18反相柱洗脱得到组分J-B-3,再以二氯甲烷/甲醇(1∶1)为洗脱剂的凝胶柱纯化得到油状无色化合物4(11.3 mg)。石油醚/乙酸乙酯(3∶1)洗脱得到的组分J-C 以二氯甲烷/甲醇(1∶1)为洗脱剂经凝胶柱得到组分J-C-1,组分J-C-1 再经石油醚/乙酸乙酯(3∶1→1∶1)正相柱梯度洗脱得到组分J-C-1-1 和白色粉末状化合物8(43.3 mg),组分J-C-1-1 再经甲醇/水溶液(80∶20)过C18反相柱得到油状化合物9(35.4 mg)。石油醚/乙酸乙酯(1∶1)洗脱下来的组分J-D 以半制备HPLC 甲醇/水溶液(50∶50)洗脱得到无色晶状化合物5(15.6 mg)。氯仿/甲醇(15∶1)洗脱得到的组分J-E 和J-F 分别经凝胶柱二氯甲烷/甲醇(1∶1)纯化得到白色粉末状化合物6(10.0 mg)和红色粉末状化合物2(34.3 mg)。
4 结构鉴定
化合物1 黄色粉末状物质ESI-MSm/z:353[M+H]+,351[M-H]-,分子式为C19H28O6;1H NMR (500 MHz,MeOD)δ:4.77 (1H,dd,J=10.7,5.4 Hz,Ha-1),3.78 (1H,dd,J=13.5,10.7 Hz,Hb-1),5.75 (1H,s,H-4),5.69 (1H,d,J=2.1 Hz,H-5),3.06 (1H,m,Ha-8),3.39 (1H,d,J=9.6 Hz,Hb-8),6.19 (1H,d,J=15.6 Hz,H-9),6.67 (1H,d,J=15.6 Hz,H-10),3.41 (1H,d,J=2.2 Hz,H-12),1.71 (1H,m,H-13),1.43 (1H,m,Ha-14),1.29 (1H,m,Hb-14),0.91 (3H,t,J=7.4 Hz,H-15),0.87 (3H,d,J=6.8 Hz,H-16),1.32 (3H,s,H-17),1.38 (3H,s,H-18);13C NMR (125 MHz,MeOD)δ:69.6 (C-1),161.8 (C-3),104.5 (C-4),154.1 (C-4a),116.4 (C-5),198.9 (C-6),75.2 (C-7),75.4 (C-8),36.8 (C-8a),122.1 (C-9),143.1(C-10),76.2 (C-11),80.4 (C-12),35.8 (C-13),29.5 (C-14),11.7 (C-15),13.8 (C-16),25.8 (C-17),19.0 (C-18)。以上数据与文献报道基本一致[4],故鉴定化合物1 为penicilazaphilone B。
化合物2 红色粉末状物质EI-MSm/z:389[M]+,分子式为C21H24ClNO4;1H NMR(500 MHz,MeOD)δ:8.16 (1H,s,H-1),7.17 (1H,s,H-4),6.86 (1H,d,J=15.5 Hz,H-9),7.03 (1H,d,J=15.5 Hz,H-10),5.73 (1H,d,J=9.7 Hz,H-12),2.53 (1H,m,H-13),1.46 (1H,m,Ha-14),1.34(1H,m,Hb-14),0.90 (3H,t,J=7.4 Hz,H-15),1.03 (3H,d,J=6.6 Hz,H-16),1.92 (3H,s,H-17),1.52 (3H,s,H-18),2.14 (3H,s,H-20);13C NMR (125 MHz,MeOD)δ:145.1 (C-1),152.9 (C-3),111.5 (C-4),148.0 (C-4a),100.7 (C-5),184.8 (C-6),85.8 (C-7),194.9 (C-8),115.7 (C-8a),118.3 (C-9),145.7 (C-10),133.8 (C-11),147.7 (C-12),35.7 (C-13),30.7 (C-14),11.9 (C-15),19.8 (C-16),12.4 (C-17),23.4 (C-18),171.3 (C-19),20.2 (C-20)。以上数据与文献报道基本一致[5],故鉴定化合物2 为sclerotioramine。
化合物3 白色粉末状物质ESI-MSm/z:238[M]+,261 [M+Na]+,分子式为C15H26O2。1H NMR(500 MHz,MeOD)δ:3.78 (1H,m,H-2),1.96(1H,t,J=11.7 Hz,H-5),1.17 (3H,s,H-12),1.17(3H,s,H-13),0.71 (3H,s,H-14),4.82 (1H,d,J=1.5 Hz,Ha-15),4.57 (1H,d,J=1.5 Hz,Hb-15);13C NMR (125 MHz,MeOD)δ:51.2 (C-1),68.0(C-2),46.7 (C-3),149.2 (C-4),50.0 (C-5),41.5(C-6),49.9 (C-7),25.3 (C-8),22.6 (C-9),35.5(C-10),72.8 (C-11),26.8 (C-12),26.3 (C-13),17.0 (C-14),107.6 (C-15)。以上数据与文献报道的基本一致[6],故鉴定化合物3 为紫檀醇。
化合物4 无色油状物质1H NMR (500 MHz,CDCl3)δ:4.21 (1H,dd,J=4.6,11.6 Hz,Ha-1),4.16 (1H,dd,J=6.2,11.6 Hz,Hb-1),3.94 (1H,m,H-2),3.70 (1H,m,Ha-3),3.61 (1H,m,Hb-3),2.36 (2H,t,J=7.6 Hz,H-2'),1.63 (2H,m,H-3'),5.36 (4H,m,H-9',H-10',H-12',H-13'),2.78(2H,t,J=6.5 Hz,H-11'),2.06 (4H,m,H-8',H-14'),0.90 (3H,t,J=6.9 Hz,H-18');13C NMR (125 MHz,CDCl3)δ:66.0,64.2 (C-1,C-3),71.1 (C-2),35.0,32.4,30.4,30.2,30.0,29.9,28.1,28.0,26.5,25.8,23.4 (C-2',C-3',C-4',C-5',C-6',C-7',C-8',C-11',C-14',C-15',C-16',C-17'),131.1,130.9,128.9,128.8 (C-9',C-10',C-12',C-13'),14.9 (C-18'),175.2 (C=O)。以上数据与文献报道的基本一致[7],故鉴定化合物4 为亚油酸甘油酯。
化合物5 白色粉末状物质EI-MSm/z:444[M]+,分子式为C29H48O3;1H NMR (500 MHz,CDCl3)δ:1.56 (4H,br m,H-1,H-11),1.87 (4H,br m,Ha-2,H-9,H-14,H-24),1.47 (4H,br m,Hb-2,H-15,H-25),4.06 (1H,m,H-3),2.14 (1H,m,Ha-4),1.76 (2H,br m,Hb-4,Ha-16),3.18 (1H,d,J=5.0 Hz,H-6),5.41 (1H,m,H-7),2.04 (2H,br m,Ha-12,H-20),1.30 (3H,m,Hb-12,Hb-16,H-17),0.61(3H,s,H-18),1.01 (3H,s,H-19),1.03 (3H,d,J=6.6 Hz,H-21),5.17 (1H,dd,J=15.3,7.7 Hz,H-22),5.20 (1H,dd,J=15.3,7.7 Hz,H-23),0.84(6H,d,J=6.4 Hz,H-26,H-27),0.93 (3H,d,J=6.8 Hz,H-28),3.40 (3H,s,-OCH3);13C NMR (125 MHz,CDCl3)δ:33.6 (C-1),31.8 (C-2),68.7 (C-3),40.5 (C-4),77.2 (C-5),83.3 (C-6),115.8(C-7),144.5 (C-8),44.7 (C-9),38.1 (C-10),23.0 (C-11),40.2 (C-12),44.7 (C-13),55.8 (C-14),23.7 (C-15),28.8 (C-16),56.8 (C-17),13.2(C-18),19.2 (C-19),41.3 (C-20),22.0 (C-21),136.3 (C-22),133.0 (C-23),43.7 (C-24),33.9(C-25),20.8 (C-26),20.5 (C-27),18.5 (C-28),59.2 (OCH3-6)。以上数据与文献报道的一致[8],故鉴定化合物5 为(3β,5α,6β,22E)-6-methoxyergosta-7,22-diene-3,5-diol。
化合物6 白色粉末状物质TLC 分析显示该化合物具有甾醇类化合物的特征斑点,与实验室啤酒甾醇标准品进行TLC 分析,采用二氯甲烷:甲醇、石油醚:乙酸乙酯、甲醇:水3 种不同的展开体系展板,其Rf 值均一致,混合点不分离,故确定为啤酒甾醇。
化合物7 白色粉末状物质ESI-MSm/z:135[M-H]-,137[M+H]+,分子式为C8H8O2。1H NMR(500 MHz,MeOD)δ:7.88 (2H,d,J=8.8 Hz,H-2,H-6),6.84 (2H,d,J=8.8 Hz,H-3,H-5),2.52(3H,s,H-8);13C NMR (125 MHz,MeOD)δ:129.6(C-1),131.6 (C-2,C-6),115.7 (C-3,C-5),163.5(C-4),199.1 (C-7),25.7 (C-8)。以上数据与文献报道的基本一致[9],故鉴定化合物7 为对羟基苯乙酮。
化合物8 白色粉末状物ESI-MSm/z:137[MH]-,分子式为C8H10O2。1H NMR (500 MHz,MeOD)δ:6.72 (2H,m,H-2,H-6),7.03 (2H,m,H-3,H-5),2.72 (2H,t,J=7.2 Hz,H-1'),3.69 (2H,t,J=7.2 Hz,H-2');13C NMR (125 MHz,MeOD)δ:156.2 (C-1),115.6 (C-2,C-6),130.4 (C-3,C-5),130.5 (C-4),38.9 (C-1'),64.1 (C-2')。以上数据与文献报道基本一致[10],故鉴定化合物8 为酪醇。
化合物9 无色油状物质ESI-MSm/z:391[M+H]+,分子式为C24H38O4。1H NMR (500 MHz,CDCl3)δ:7.71 (2H,dd,J=5.7,3.3 Hz,H-3,H-6),7.54 (2H,dd,J=5.7,3.3 Hz,H-4,H-5),4.23(4H,m,H-1'),1.69 (2H,m,H-2');13C NMR (125 MHz,CDCl3)δ:133.3 (C-1,C-2),131.7 (C-3,C-6),129.7 (C-4,C-5),69.0 (C-1'),31.2 (C-2'),39.6 (C-3'),29.8 (C-4'),23.8 (C-5'),14.9 (C-6'),24.6 (C-7'),11.8 (C-8'),168.6 (-COO-)。以上数据与文献报道一致[11],故鉴定化合物9 为邻苯二甲酸二(2-乙基)己酯。
5 讨论
从菌核青霉FS50 的发酵产物中共分离鉴定出9 个化合物。化合物3 为首次从青霉属中分离得到,化合物2、4、5、6、8、9 为首次从菌核青霉中分离得到。化合物1 和2 为嗜氮酮类化合物,这类化合物具有广泛的生物活性,包括抗细菌、抗真菌、抗病毒、抗氧化、细胞毒、杀线虫和抗炎等[12]。化合物3为倍半萜类化合物,具有抗肿瘤作用,在25 μg/mL时对MCF-7、SF-268、NCI-H460、HCT-116 和AGS 肿瘤细胞株有抑制作用[13],此外还有抗真菌,昆虫拒食活性[14,15]。化合物5 和6 为甾醇类化合物,文献报道化合物5 对细胞株A549、SK-OV-3、SK-MEL-2、XF498 和HCT15 具有较好的细胞毒活性[16]。
1 Saleem M,Ali MS,Hussain S,et al.Marine natural products of fungal origin.Nat Prod Rep,2007,24:1142-1152.
2 Bugni TS,Ireland CM.Marine-derived fungi:a chemically and biologically diverse group of microorganisms.Nat Prod Rep,2004,21:143-163.
3 Zhang L(张玲),Zhang QB(张庆波),Chen YC(陈玉婵),et al.Preliminary identification of 18 marine fungal strains from the South China Sea and screening of their fermentation products for cytotoxic and antibacterial activities.J Trop Oceanogr(热带海洋学报),2013,32:49-53.
4 Arunpanichlert J,Rukachaisirikul V,Sukpondma Y,et al.Azaphilone and isocoumarin derivatives from the endophytic fungusPenicillium sclerotiorumPSU-A13.Chem Pharm Bull,2010,58:1033-1036.
5 Wang X,SenaFilho JG,Hoover AR,et al.Chemical epigenetics alters the secondary metabolite composition of guttate excreted by an atlantic-forest-soil-derivedPenicillium citreonigrum.Nat Prod Rep,2010,73:942-948.
6 Nasini G,Piozzi F.Pterocarpoland triterpenes fromDaemonoropsdraco.Phytochemistry,1981,20:514-516.
7 Okuyama E,Hasegawa T,Matsushita T,et al.Analgesic components ofSaposhnikoviaroot(Saposhnikovia divaricata).Chem Pharm Bull,2001,49:154-160.
8 Gao H,Hong K,Zhang X,et al.New steryl esters of fatty acids from the mangrove fungusAspergillus awamori.Helv Chim Acta,2007,90:1165-1178.
9 Ding HY,Lin HC,Teng CM,et al.Phytochemical and pharmacological studies on ChinesePaeoniaspecies.J Chin Chem Soc,2000,47:381-388.
10 Capasso R,Cristinzio G,Evidente A,et al.Isolation,spectroscopy and selective phytotoxic effects of polyphenols from vegetable waste waters.Phytochemisty,1992,31:4125-4128.
11 Rao GN,Kumar PM,Dhandapani VS,et al.Constituents ofCassia auriculata.Fitoterapia,2000,71:82-83.
12 Osmanova N,Schultze W,Ayoub N.Azaphilones:a class of fungal metabolites with diverse biological activities.Phytochem Rev,2010,9:315-342.
13 Liu YB,Mulabagal V,Forbes CSB,et al.Inhibition of lipid peroxidation,cyclooxygenase enzyme and human tumor cell proliferation by compounds in herbal water.Mol Nutr Food Res,2009,53:1177-1186.
14 Morimoto M,Fukumoto H,Hiratani M,et al.Insect antifeedants,pterocarpans and pterocarpol,in heartwood ofPterocarpus macrocarpusKruz.Biosci Biotechnol Biochem,2006,70:1864-1868.
15 Kusuma IW,Azuma M,Darma T,et al.Isolation and identification of antifungal compounds from amboyna wood.Holzforschung,2005,59:170-172.
16 Kwon HC,Zee SD,Cho SY,et al.Cytotoxic ergosterols fromPaecilomycessp.J300.Arch Pharm Res,2002,25:851-855.
