黄花蒿青蒿酸制备及其生物稳定性研究
2014-01-08徐定华唐雯熙张晓蓉刘继旋
徐定华,唐雯熙,张晓蓉*,李 杰,刘继旋
1吉首大学植物资源保护与利用湖南省高校重点实验室;2 吉首大学生物资源与环境科学学院,湖南吉首 416000
青蒿酸是黄花蒿(Artemisia annuaL.)植物中倍半萜类成分之一[1-4],化学构象适宜,具有重要的药用和开发价值,我国资源丰富。研究表明青蒿酸具有较好的抗肿瘤活性,对人肝癌细胞SMMC-7721、人白血细胞K562、白血病P388 等多种癌细胞具有杀伤作用[5,6]。还可减少C/EBPδ mRNA 的水平,抑制hAMSCs 的生脂分化[7]。青蒿酸为青蒿素生物合成重要前体,有望低成本体外转化为青蒿素,近年来青蒿酸制备技术也随之发展,已有多种青蒿酸分离纯化工艺报道,如采用反相高效液相色谱法分离青蒿酸[8],产物纯度大于96%;采用皂化-硅胶柱层析法从青蒿酸提取母液制备青蒿酸[9],纯度达95%。也有报道通过单流程工艺制备较高纯度青蒿酸[10]。国外有报道通过酵母转基因技术生物合成青蒿酸。虽然已有多种青蒿酸制备工艺报道,目前青蒿酸尚未实现工业化,一些关键技术还有待解决;有关青蒿酸生物稳定性未见相关报道。青蒿酸分子含有一个羧基,4,5-位以及11-位碳双键易断裂,通过紫外光断裂11-位双键,插入一个甲基和2 个氢,生成二氢青蒿酸,青蒿酸在光氧化条件下氧化其4,5-位双键,生成烯丙过氧氢,提供氯化氢条件,甲酯化生成青蒿酸甲酯,分子中双键使青蒿酸具有一定不稳定性[11-13]。基于青蒿酸重要的开发应用价值,本文探究了溶剂法、吸附分离法制备青蒿酸,对产品进行了表征,分析了青蒿酸的生物稳定性,以期为青蒿酸的工业开发与利用提供实验参考。
1 材料与方法
1.1 材料、试剂与仪器
黄花蒿(Artemisia annuaL.)为野外采集,由吉首大学陈功锡教授鉴定。青蒿酸标准品(HPLC >99%,批号120628,四川省维克奇生物科技有限公司)。
岛津高压液相色谱仪(LC-10AT,天津岛津液压有限公司),干燥箱(上海博讯实业有限公司),申光熔点仪(WRR,上海精科),紫外分光光度计(天津岛津液压有限公司),紫外灯(253.7 nm,30 W),高分辨质谱仪(MAT95XP,美国Thermo Finnigan 公司),96 孔细胞培养皿,甲醇(HPLC,上海国药),乙腈(HPLC,上海国药),其它试剂均为国产分析纯,实验用水均为超纯水。
1.2 实验方法
1.2.1 青蒿酸制备工艺
将1000 g 黄花蒿植物于60 ℃干燥至恒重,粉碎,过40 目筛,甲醇浸提24 h/次,3 次,植物∶甲醇=1∶10、1∶10、1∶5(g/mL)。合并滤液,浓缩,浸膏乙醚溶解,并加入碱液24 h 反应后,收集碱液层,浓HCl 调pH=1,24 h 反应,再加入乙醚,萃取,收集乙醚,浓缩,浸膏硅胶柱层析分离,收集青蒿酸流份,浓缩,乙酸乙酯溶解浸膏,-20 ℃结晶,收集青蒿酸结晶,真空干燥,备用。
1.2.2 青蒿酸表征
1.2.2.1 青蒿酸溶液配制
精确称量青蒿酸标准品及青蒿酸样品各10 mg,色谱甲醇溶解,容量瓶定量至10 mL,母液浓度为1 mg/mL,备用。实验用青蒿酸标准品溶液及青蒿酸样品溶液均采用色谱甲醇稀释。
1.2.2.1 熔点测定
取5 mg 青蒿酸晶体于50 ℃干燥至恒重,研磨,于熔点仪中测定其熔点,重复3 次。
1.2.2.2 UV-vis 表征
青蒿酸甲醇溶液于比色皿扫描分析,波长范围200~450 nm 扫描,以甲醇为空白对照,测定青蒿酸最大吸收峰。
1.2.2.3 TLC 分析
展层剂:石油醚-乙酸乙酯-丙酮(80∶19∶1,v/v/v);显色剂:香草醛-无水乙醇-浓硫酸(0.5 g∶9 mL∶1 mL);显色温度:100~110 ℃;显色时间:5~10 min。
1.2.2.4 HPLC 检测
精密吸取青蒿酸样品溶液10 μL,注入液相色谱仪,紫外检测器测定峰面积。色谱柱条件:wondas II C18(4.6 mm × 250 mm,5 μm);流动相:乙腈-0.1%乙酸水溶液(7∶3,v/v);流速为1 mL/min;柱温为30 ℃,紫外检测波长为203 nm。
青蒿酸浓度计算公式如下:

1.2.2.5 质谱分析
青蒿酸溶解于乙醚溶液用于质谱检测分析。质谱检测条件为毛细管温度180 ℃,喷雾电压5 kV,离子透镜补偿电压15 V,碰撞能量20%~42%,壳气为氮气,毛细管电压38 V,注射泵流速3 μL/min。
1.2.3 生物稳定性检测
光照条件:取三组供试青蒿酸样品溶液,第一组采用自然光照室温保存,第二组用锡箔纸包裹避光室温保存。第三组供试样品溶液分别以每孔300 μL 加入96 孔板,室温紫外灯下照射,光照距离20 cm,取样待检。
温度条件:取三组供试青蒿酸样品溶液,第一组4 ℃条件下避光保存,第二组室温条件下避光保存,第三组60 ℃条件下避光保存,取样待检。
保存时间:供试青蒿酸溶液,室温避光保存。植物样品为野外采集,自然阴干,室温避光贮藏,植物青蒿酸含量检测采用甲醇室温提取,1年保存时间。
HPLC 法检测生物活性,青蒿酸标准品溶液及样品溶液浓度均为0.08 mg/mL。
2 结果与分析
2.1 青蒿酸制备工艺
黄花蒿青蒿酸制备工艺流程如图1 所示。制备工艺设计了有机溶剂提取、反萃取-萃取粗分离、吸附柱分离及结晶、真空干燥等4 个操作单元制备。青蒿酸分子中含有一个羧基,属于极性分子,制备工艺选用极性较强的有机溶剂甲醇提取。青蒿酸呈弱酸性,为弱电解质,工艺采用5% NaOH 皂化及浓HCl 还原,利用反萃取及乙醚萃取粗分离。通过硅胶柱吸附分离法以及石油醚结晶精制,得到青蒿酸产品。通过该工艺产物得到青蒿酸结晶350 mg,制备工艺的产率为61.7%,青蒿酸制备工艺物料平衡及产品收率总结于表1。

图1 青蒿酸制备工艺流程图Fig.1 Preparation process of artemisinic acid
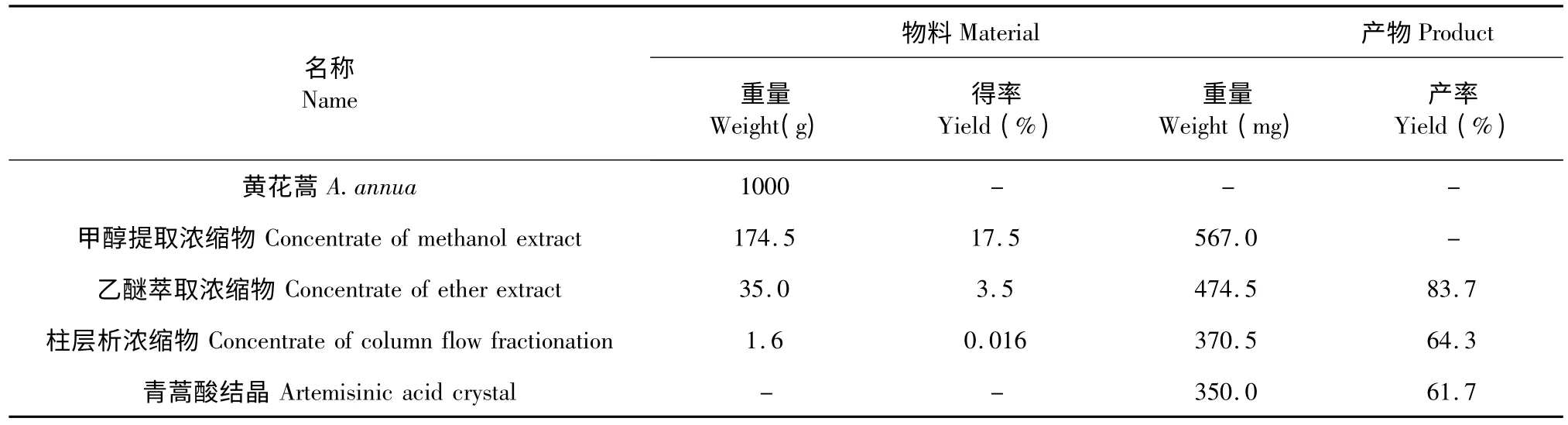
表1 青蒿酸制备工艺物料平衡及产品收率Table 1 Material balance and product yield of artemisinic acid by preparation process
2.2 青蒿酸表征
采用HPLC 法对产物青蒿酸进行了纯度检测,对青蒿酸晶体进行了UV-vis、熔点、TLC、质谱表征,结果如图2 所示。产物青蒿酸纯度为96% (图2 A)。青蒿酸晶体透明,小立方形(图2B 插图所示)。青蒿酸晶体甲醇溶解后,紫外检测表明最大吸收峰为220 nm;青蒿酸结晶熔点为130(132 ℃;TLC 检测表明青蒿酸的Rf值为0.42(图2 C 箭头所示);质谱检测其质子峰为[M]+234(图2 D),与文献报道一致[1]。

图2 青蒿酸表征Fig.2 Characterization of artemisinic acid
2.3 青蒿酸生物稳定性分析
2.3.1 温度稳定性分析
青蒿酸具有适宜化学构象,不仅可生物转化为青蒿素,且具有重要的药用用途,保持其生物稳定性是其开发利用的前体。因此,探究了4 ℃、室温、60℃等温度条件下青蒿酸生物稳定性。采用TLC 法、HPLC 法对3 种温度条件下保存0、12 h、2、5、15、30 d 的青蒿酸含量动态变化进行了定性定量分析。TLC 分析结果显示,4 ℃、室温、60 ℃条件下保存0、12 h、2、5、15、30 d 后青蒿酸斑点清晰可见,Rf值均为0.46(图略)。进一步采用HPLC 法对不同温度条件下保存的青蒿酸含量进行定量检测,结果如图3 A、B、C 所示。由检测结果可知,4 ℃、室温、60 ℃条件下保存0、12 h、2、5、15、30 d 青蒿酸HPLC 检测保留时间均为12.6 ± 0.2 min。根据公式计算可知,3 种条件下青蒿酸浓度基本保持不变,分别为0.08、0.08 ±0.01 mg/mL 以及0.075 ±0.05 mg/mL,可见青蒿酸在4~60 ℃温度条件下具有较好的生物稳定性。

图3 不同温度保存条件青蒿酸含量HPLC 分析Fig.3 Content analysis of artemisinic acid preserved under different temperatures by HPLC
2.3.2 光稳定性分析
以避光条件为对照,研究了青蒿酸对紫外光及自然光的生物稳定性。TLC 分析结果显示,自然光照条件保存0、12 h、2、5、15、30 d 青蒿酸斑点仍清晰可见,与避光保存青蒿酸标准品斑点显示一致。将青蒿酸进行紫外光照0、2、4、6、8、10、12 h,TLC 检测发现青蒿酸斑点随着紫外照射时间延长,斑点逐渐变小,颜色变淡,6 h 后青蒿酸斑点完全消失(图略)。进一步对自然光及紫外光处理的青蒿酸含量进行HPLC 检测,结果如图4 所示。由图4 A 检测结果可见,自然光照条件下青蒿酸吸收峰与避光保存标准品吸收峰一致,含量稳定,检测浓度保持在0.07~0.08 mg/mL。紫外光照处理后(图4 B),青蒿酸含量随着紫外光照时间延长逐渐降低,紫外光照2 h 后青蒿酸浓度降为0.04 mg/mL,4 h 后降为0.02 mg/mL,紫外光照8 h 后青蒿酸几乎完全被光解。以上结果表明,自然光照条件下青蒿酸具有较好的稳定稳定性,青蒿酸对紫外光非常敏感。
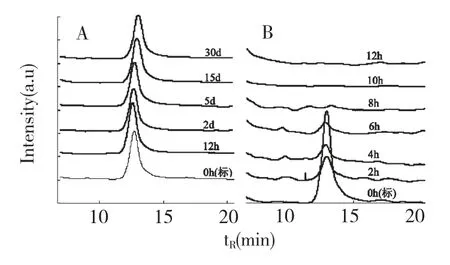
图4 不同光照保存条件青蒿酸含量HPLC 分析Fig.4 Content analysis of artemisinic acid preserved under different lights by HPLC
2.3.3 青蒿酸保存时间分析
室温避光贮藏条件下,对体外及植物体内保存的青蒿酸生物稳定性进行了分析。HPLC 检测结果如图5 所示。由图5A 检测结果显示,在体外保存1年后,青蒿酸吸收峰与标准品吸收峰一致,含量稳定,浓度保持在0.07~0.08 mg/mL。由图5B 检测结果可知,植物体在自然条件下保存1年后,青蒿酸含量基本稳定,浓度约为1.5%~1.6%,生物稳定性良好。以上结果表明,植物体内外保存一年时间青蒿酸生物活性稳定良好。

图5 植物体内外保存青蒿酸含量HPLC 分析Fig.5 Content analysis of artemisinic acid preserved in and out of plant by HPLC
3 讨论
青蒿酸具有重要的开发利用价值。本文探究了青蒿酸制备工艺,通过该工艺可高效制备青蒿酸产品,纯度达96%。产物青蒿酸紫外最大吸收峰为220 nm,熔点为130~132 ℃,质谱[M]+234。生物稳定性分析表明,4~60 ℃以及自然光照条件下,保存30 d 青蒿酸生物稳定性的保持良好,含量保持0.08 mg/mL 不变。但紫外光对青蒿酸具有极强的破坏作用,紫外照射6 h 后青蒿酸基本检测不出,有报道青蒿酸在紫外条件下,4,5-位以及11-位碳双键断裂发生氧化反应[8],该结果与文献相符。室温条件下,青蒿酸在植物体内外保存1年含量基本稳定,生物稳定性好。青蒿酸良好的生物稳定性为其开发利用提供了广阔前景。
1 Deng DA (邓定安),Zhu DY (朱大元),Gao YL (高耀良),et al.Study on structure of artemisinic acid.Chin Sci Bull(科学通报),1981,19:1209-1211.
2 Deng DA (邓定安),Cai JC (蔡俊超).Derivatives of artemisic acid with antitumor activity.Organ Chem(有机化学),1991,5:540-543.
3 Tu YY(屠呦呦),Zhu QC (朱启聪),Shen X (沈星).Study on chemical composition of shoot ofArtemisia annuaL.Tradit Chin Med J(中药通报),1985,10(9):35-37.
4 Deng SJ (邓思娟),Li CY (李春远),Chen S (陈实),et al.Allelochemicals isolation and structure identification ofArtemisia annuaL.J South China Agric Univ(华南农业大学学报),2008,29(3):42-46.
5 Sun WC (孙玮辰),Han JX (韩家娴),Yang WY (扬蔚怡),et al.Antitumor activities of 4 derivatives of artemisic acid and antemisic Bin vitro.Acta Pharmucol Sin(中国药理学报),1992,13:541-543.
6 Zhou SW (周生伟),Wang SY (王莎莉),Ya P (亚平).Inhibitory effects of artemisinic acid on proliferation of K562 cellsin vitro.J Chongqing Med Univ(重庆医科大学学报),2006,31:159-162.
7 Ro DK,Paradise EM,Ouellet M,et al.Production of the antimalarial drug precursor artemisinic acid in engineered yeast.Nature,2006,440:940-943.
8 Liu SQ (刘硕谦),Liu ZH (刘仲华),Tian N (田娜),et al.Phase high performance liquid chromatography separation and purification of artemisinin,dihydro artemisinin acid and artemisinic acid.CN201110038895.
9 Liu ZQ (刘志强).A kind method of extract artemisinic acid from artemisinin crystallization mother liquor.CN 102702220B.
10 Peng XD (彭学东),Zhang H (张海),Zhao JZ (赵金召),et al.A simple new process of extraction and purification artemisinin and artemisinin acid fromArtemisia annualeaf.CN 103087075A.
11 Liu SQ (刘硕谦),Tian N (田娜),Li J (李娟),et al.Advances in studies on combinatorial biosynthesis of artemisinin.Chin Tradit Herb Drugs(中草药),2007,38:1425-1431.
12 Zeng QP (曾庆平),Pao F (鲍飞).Research achievements in the synthetic biology and metabolic engineering of artemisinin.Chin Sci Bull(科学通报),2011,56:2289-2297.
13 Kong JQ (孔建强),Wang W (王伟),Cheng KT (程克棣),et al.Research progresses in synthetic biology of artemisinin.Acta Pharm Sin(药学学报),2013,48:193-205.
