α-蒎烯基苯基噻二唑类化合物的合成及杀菌活性
2014-01-08李龙生段文贵林桂汕
李龙生,岑 波,段文贵,林桂汕
广西大学化学化工学院,南宁 530004
松节油是我国(尤其是广西)的天然优势资源,其主要成分是α-蒎烯。α-蒎烯本身及其衍生物表现出除草、抗菌[1]、杀虫[2]和驱避等多种生物活性,基于α-蒎烯分子四元环和双键官能团的改性,合成具有生物活性及其他功能的化合物已成为有机合成化学和林产化学的研究热点之一。含氮、硫杂环化合物具有广泛的生物活性,在新型高效农药和医药研究中具有重要地位。1,3,4-噻二唑是一类含二个氮原子和一个硫原子的芳香性五元杂环,其生物活性与噻二唑环上的“碳氮硫”骨架结构有着密切的关系,广泛应用于农药和医药领域,如在农药方面具有杀虫[3]、抗菌[4]和植物生长调节等生物活性,在医药方面具有抑菌、抗结核和抗细胞毒性[5]等生物活性。近年来,本课题组在松节油基新型生物活性化合物的合成方面作了许多研究工作,取得了系列研究成果[6-8]。本文在实验室已有的基础上,继续开展对α-蒎烯的改性研究。即以α-蒎烯为原料,经多步反应,将1,3,4-噻二唑活性基团引入到α-蒎烯的亚结构中去,设计并合成一系列新型α-蒎烯基苯基噻二唑类化合物,并测试其对五种植物病菌的杀菌活性,旨在为α-蒎烯的深度开发和利用提供新的途径。目标化合物的合成路线如图1 所示。
1 材料与方法
1.1 仪器和试剂
AVANCE AV 600 MHz 核磁共振仪(瑞士Bruker 公司);TSQ Quantum Access MAX 液相色谱-质谱联用仪(美国Thermo Scientific 公司);Nicolet Nexus 470 FT-IR 红外光谱仪(美国Nicolet 公司);X-4 数字显示显微熔点测定仪(温度计未经校正)。
α-蒎烯(广西梧州松脂股份有限公司,GC 测定质量分数为97%);马来酸酐(西陇化工股份有限公司,分析纯);甘氨酸(国药集团化学试剂有限公司,分析纯);取代苯甲酸(上海晶纯生化科技股份有限公司,分析纯);氨基硫脲(国药集团化学试剂有限公司,分析纯);其他试剂均为市售分析纯试剂。

图1 α-蒎烯基苯基噻二唑化合物的合成路线Fig.1 Synthetic route of α-pinene-based phenyl-thiadiazole compounds
1.2 α-萜品烯马来酸酐加成物3 的合成
参照文献[9]制备α-萜品烯马来酸酐加成物3。
1.3 N-羧甲基萜品烯马来酰亚胺4 的合成
在50 mL 两口烧瓶中加入0.90 g(12.0 mmol)甘氨酸,6 mLN,N-二甲基甲酰胺(DMF)和12.0 mmol 三乙胺,将2.34 g(10.0 mmol)α-萜品烯马来酸酐加成物3 溶于6 mL DMF 中,用恒压滴液漏斗滴加到两口瓶中,30 min 滴加完毕,磁力搅拌下升温至回流,回流反应约4 h。薄层色谱(TLC)监测至没有加成物3 后停止反应,冷却至室温。再将反应液倒入250 mL 的分液漏斗中,以10%的氢氧化钠溶液调pH 值至9~10,用20 mL 二氯甲烷多次萃取,分液取上层水溶液,再用稀盐酸溶液调节pH 至5~6,少量二氯甲烷萃取2~3 次,取有机层,无水Na2SO4干燥,减压蒸馏出二氯甲烷,再以PET/EtOAc 2:1 为洗脱剂进行柱层析提纯,得到化合物4,为白色固体,收率68%。
1.4 N-羧甲基萜品烯马来酰亚胺基酰氯5 的合成
在50 mL 两口瓶中加入2.91 g(10.0 mmol)化合物4,将10 mL 二氯亚砜通过恒压滴液漏斗常温下缓慢滴加到两口瓶中,30 min 滴加完毕,磁力搅拌下升温至65 ℃,反应3~4 h。TLC 监测至没有化合物4 后停止反应,减压蒸馏出过量的二氯亚砜,得到化合物5,为棕黄色粘稠液体。
1.5 2-氨基-5-取代苯基-1,3,4-噻二唑6a~6i 的合成
2-氨基-5-取代苯基-1,3,4-噻二唑6a~6i 的合成参见文献[10]并以6a 为例。在三口瓶中分别加入10.0 mmol 苯甲酸和12.0 mmol 氨基硫脲,磁力搅拌下滴加15 mL POCl3,控温80 ℃反应80 min 后向三口瓶中缓慢加入30 mL 蒸馏水,再升温至110 ℃反应2 h。反应液冷却后倒入50 mL 蒸馏水中,用20% NaOH 溶液中和至pH 8,析出大量白色固体,真空过滤,滤饼用蒸馏水洗涤两次,干燥得到粗品。用混合溶剂DMF/H2O 1∶2 重结晶,得到化合物6a,为白色粉末。6b~6i 用同样方法合成。
1.6 目标产物α-蒎烯基苯基噻二唑7a~7i 的合成
以7a 为例。在50 mL 圆底烧瓶中加入10.0 mmol 化合物6,15 mL1,4-二氧六环和1.4 mL(10.0 mmol)三乙胺,磁力搅拌均匀,常温条件下缓慢滴加溶于10 mL 1,4-二氧六环的11.0 mmol 化合物5,30 min 滴加完毕,常温反应2~4 h,TLC 监测反应进程。反应结束后将反应液倒入50 mL 蒸馏水中,析出棕黄色固体,真空过滤,干燥,得到粗产品,再以PET/EtOAc 3∶1 为洗脱剂进行柱层析提纯,得到目标产物7a,收率78%。7b~7i 用同样方法合成。
1.7 目标产物7a~7i 的杀菌活性测试
采用离体法进行测试:将供试药剂溶解在丙酮内,然后用200 mg/L sorporl-144 乳化剂稀释成500 mg/L 的药液。取1 mL 药液注入培养皿内,再加入9 mL PSA 培养基,制成浓度为50 mg/L 的含药平板。将培养好的供试菌用打孔器打取直径为5 mm的菌饼置于含药平板内,每皿三块呈等边三角形放置。以无菌蒸馏水代替供试药剂作空白对照。将各平板于24 ±1 ℃培养箱内培养48 h 后,计量各平板菌丝扩展直径,并与对照相比较,计算相对抑制百分率。活性分级指标为A 级≥90%;70% ≤B 级<90%;50%≤C 级<70%;D 级<50%。
2 结果与讨论
2.1 中间体4 和目标产物的表征
N-羧甲基萜品烯马来酰亚胺4 白色固体,收率68%,mp.153~154 ℃;IR (KBr)νmax3036,2959,2939,2870,2730,1751,1677 cm-1;1H NMR(DMSO-d6,600 MHz)δ:10.39~9.63 (1H,m,COOH),5.90 (1H,d,J=8.5 Hz,7-H),5.82 (1H,d,J=8.5 Hz,8-H),3.92 (2H,s,15-H),3.07(1H,d,J=7.9 Hz,2-H),2.74 (1H,d,J=7.9 Hz,5-H),2.47~2.42 (1H,m,11-H),1.52~1.46(1H,m,9a-H),1.43~1.38 (1H,m,10a-H),1.36(3H,s,14-H),1.19~1.15 (1H,m,9b-H),1.13~1.08 (1H,m,10b-H),1.01 (3H,d,J=6.8 Hz,13-H),0.90 (3H,d,J=6.9 Hz,12-H);13C NMR(CDCl3,150 MHz)δ:49.8(C-5),46.1(C-2),44.2(C-15),43.1(C-1),37.5(C-6),34.8(C-10),29.3(C-11),22.5(C-9),21.0(C-14),18.3(C-13),17.0(C-12)。
α-蒎烯基苯基噻二唑7a 白色固体,收率78%,mp.157~158 ℃;IR (KBr)νmax3183,3039,2960,2932,2873,2741,1772,1707,1546,1326,1306 cm-1;1H NMR (CDCl3,600 MHz)δ:13.50 (1H,s,NH),7.89 (2H,d,J=1.1 Hz,20-H,24-H),7.47(3H,dd,J=5.0,1.9 Hz,21-H,22-H,23-H),6.09(1H,d,J=8.5 Hz,7-H),6.01 (1H,d,J=8.5 Hz,8-H),4.65 (2H,s,NCH2),3.11 (1H,d,J=8.1 Hz,2-H),2.73 (1H,d,J=8.0 Hz,5-H),2.65~2.57 (1H,m,11-H),1.56-1.49 (4H,m,C14-H,9a-H),1.48-1.43 (1H,m,10a-H),1.35 (1H,m,9b-H),1.28 (1H,m,10b-H),1.10 (3H,d,J=6.8 Hz,13-H),0.99 (3H,d,J=7.0 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),176.6 (C-3),164.9 (C-16),163.5 (C-17),160.1 (C-18),136.6 (C-7),135.9 (C-8),131.0 (C-19),130.2(C-21,C-23),129.3 (C-22),127.5 (C-20,C-24),50.8 (C-5),46.9 (C-2),43.8 (C-15),41.0 (C-1),37.0 (C-6),34.4 (C-10),29.8 (C-11),23.1(C-9),22.8 (C-14),18.56 (C-13),17.0 (C-12);ESI-MSm/z:450.8[M+H]+。
α-蒎烯基-3-氟苯基噻二唑7b 浅黄色固体,收率82%,170 ℃分解;IR (KBr)νmax3186,3038,2960,2934,2873,2742,1774,1707,1545,1329,1307 cm-1;1H NMR (CDCl3,600 MHz)δ:13.36 (1H,s,NH),7.65 (1H,d,J=13.3 Hz,20-H),7.62 (1H,d,J=9.0 Hz,24-H),7.44 (1H,dd,J=14.8,6.9 Hz,22-H),7.17 (1H,t,J=9.2 Hz,23-H),6.10(1H,d,J=8.5 Hz,7-H),6.02 (1H,d,J=8.5 Hz,8-H),4.64 (2H,s,NCH2),3.12 (1H,d,J=8.0 Hz,2-H),2.74 (1H,d,J=8.0 Hz,5-H),2.61(1H,dt,J=13.7,6.8 Hz,11-H),1.56~1.49(4H,m,14-H,9a-H),1.49-1.44 (1H,m,10a-H),1.38-1.33 (1H,m,9b-H),1.30 (1H,m,10b-H),1.10 (3H,d,J=6.8 Hz,13-H),0.99 (3H,d,J=6.9 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1(C-4),176.6 (C-3),164.9 (C-16),163.9 (C-17),162.3 (C-18),160.3 (C-21),136.6 (C-7),135.9(C-8),132.1 (C-19),131.0 (C-23),123.3 (C-24),118.0 (C-20),114.2 (C-22),50.8 (C-5),46.9 (C-2),43.8 (C-15),40.1 (C-1),37.1 (C-6),34.4 (C-10),29.8 (C-11),23.1 (C-9),22.8(C-14),18.6 (C-13),17.0 (C-12);ESI-MSm/z:466.7[M-H]+。
α-蒎烯基-2-氯苯基噻二唑7c 白色固体,收率75%,mp.151~152 ℃;IR (KBr)νmax3183,3038,2960,2933,2872,2740,1774,1706,1570,1327,1309 cm-1;1H NMR (CDCl3,600 MHz)δ:13.47 (1H,s,NH),8.12 (1H,d,J=7.5 Hz,24-H),7.52 (1H,d,J=9.2 Hz,21-H),7.44-7.37 (2H,m,22-H,23-H),6.07 (1H,d,J=8.5 Hz,8-H),6.00 (1H,d,J=8.5 Hz,7-H),4.65 (2H,s,NCH2),3.10 (1H,d,J=8.1 Hz,2-H),2.72 (1H,d,J=8.0 Hz,5-H),2.63-2.56 (1H,m,11-H),1.54-1.48 (4H,m,14-H,9a-H),1.47-1.42 (1H,m,10a-H),1.37-1.32 (1H,m,9b-H),1.30-1.25 (1H,m,10b-H),1.09 (3H,d,J=6.8 Hz,13-H),0.98 (3H,d,J=7.0 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),175.6 (C-3),164.8 (C-16),161.7 (C-17),159.7(C-18),136.6 (C-7),135.9 (C-8),132.6 (C-19),131.6 (C-20),131.2 (C-22),130.7 (C-21),129.1(C-24),127.4 (C-23),50.76 (C-5),48.9 (C-2),43.8 (C-15),41.0 (C-1),37.0 (C-6),34.4 (C-10),29.8 (C-11),23.1 (C-9),22.8 (C-14),18.6(C-13),16.8 (C-12),ESI-MSm/z:484.8 [M +H]+。
α-蒎烯基-3-氯苯基噻二唑7d 浅黄色固体,收率79%,mp.195~196 ℃;IR (KBr)νmax3185,3039,2958,2930,2872,2740,1774,1705,1571,1308 cm-1;1H NMR (CDCl3,600 MHz)δ:13.12 (1H,s,NH),7.93 (1H,s,20-H),7.74 (1H,d,J=7.9 Hz,24-H),7.45 (1H,d,J=8.0 Hz,22-H),7.42(1H,m,23-H),6.10 (1H,d,J=8.5 Hz,8-H),6.03 (1H,d,J=8.5 Hz,7-H),4.63 (2H,s,NCH2),3.12 (1H,d,J=8.0 Hz,2-H),2.74 (1H,d,J=8.0 Hz,5-H),2.60 (1H,dq,J=13.7,6.8 Hz,11-H),1.57-1.50 (4H,m,14-H,9a-H),1.49~1.44 (1H,m,10a-H),1.39-1.33 (1H,m,9b-H),1.32~1.26 (1H,m,10b-H),1.10 (3H,d,J=6.7 Hz,13-H),0.99 (3H,d,J=6.9 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),176.6 (C-3),164.9 (C-16),162.1 (C-17),160.2 (C-18),136.7 (C-7),135.9 (C-8),135.4 (C-19),131.8(C-21),131.0 (C-23),130.6 (C-22),127.2 (C-20),125.7 (C-24),50.8 (C-5),46.9 (C-2),43.8(C-15),41.0 (C-1),37.1 (C-6),34.4 (C-10),29.8 (C-11),23.1 (C-9),22.8 (C-14),18.6 (C-13),17.0 (C-12);ESI-MSm/z:484.8[M+H]+。
α-蒎烯基-3-甲基苯基噻二唑7e 白色固体,收率79%,mp.207~208 ℃;IR (KBr)νmax3195,3036,2960,2932,2874,2742,1771,1705,1572,1328,1309 cm-1;1H NMR (CDCl3,600 MHz)δ:13.53~13.25 (1H,m,NH),7.71 (1H,s,20-H),7.69 (1H,d,J=12.0 Hz,24-H),7.36 (1H,m,23-H),7.28 (1H,d,J=12.1 Hz,22-H),6.09 (1H,d,J=8.5 Hz,8-H),6.02 (1H,d,J=8.5 Hz,7-H),4.65 (2H,s,NCH2),3.10 (1H,d,J=8.1 Hz,2-H),2.73 (1H,d,J=8.0 Hz,5-H),2.65~2.58(1H,m,11-H),2.42 (3H,s,21-H),1.54~1.49(4H,m,14-H,9a-H),1.48~1.42 (1H,m,10a-H),1.37~1.26(1H,m,9b-H),1.30-1.25(1H,m,10b-H),1.11 (3H,d,J=6.8 Hz,13-H),0.99 (3H,d,J=7.0 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),176.6 (C-3),164.8 (C-16),163.8(C-17),159.9 (C-18),139.1 (C-19),136.6 (C-7),135.9 (C-8),131.8 (C-19),130.1 (C-22),129.2 (C-23),128.1 (C-20),124.7 (C-24),50.8(C-5),46.9 (C-2),43.8 (C-15),41.1 (C-1),37.1(C-6),34.4 (C-10),29.8 (C-11),23.1 (C-9),22.8 (C-14),21.5 (Ar-CH),18.6 (C-13),17.0(C-12);ESI-MSm/z:464.8[M+H]+。
α-蒎烯基-4-甲基苯基噻二唑7f 白色固体,收率82%,mp.229~230 ℃;IR (KBr)νmax3186,3037,2960,2933,2873,2740,1774,1707,1548,1329,1309 cm-1;1H NMR (CDCl3,600 MHz)δ:13.14 (1H,s,NH),7.77 (2H,d,J=8.2 Hz,20-H,24-H),7.27 (2H,d,J=7.0 Hz,21-H,23-H),6.08 (1H,d,J=8.5 Hz,7-H),6.01 (1H,d,J=8.5 Hz,8-H),4.60 (2H,s,NCH2),3.10 (1H,d,J=8.1 Hz,2-H),2.72 (1H,d,J=8.0 Hz,5-H),2.60 (1H,td,J=13.6,6.8 Hz,11-H),2.41 (3H,s,Ar-CH3),1.55-1.49 (4H,m,14-H,9a-H),1.45(1H,m,10a-H),1.35 (1H,m,9b-H),1.29 (1H,m,10b-H),1.10 (3H,d,J=6.7 Hz,13-H),0.99(3H,d,J=6.9 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),176.6 (C-3),164.7 (C-16),163.7 (C-17),159.7 (C-18),141.4 (C-22),136.6(C-7),135.9 (C-8),130.0 (C-19),127.4 (C-21,C-23),127.4 (C-20,C-24),50.8 (C-5),46.9 (C-2),43.8 (C-15),41.0 (C-1),37.1 (C-6),34.4(C-10),29.8 (C-11),23.1 (C-9),22.8 (C-14),21.4 (Ar-CH),18.6 (C-13),17.0 (C-12);ESI-MSm/z:464.8[M+H]+。
α-蒎烯基-3-硝基苯基噻二唑7g 浅黄色固体,收率71%,mp.164~165 ℃;IR (KBr)νmax3173,3037,2961,2933,2873,2736,1770,1704,1535,1350,1302 cm-1;1H NMR (CDCl3,600 MHz)δ:13.27 (1H,s,NH),8.74 (1H,t,J=1.9 Hz,20-H),8.33 (1H,d,J=8.2 Hz,22-H),8.20 (1H,d,J=7.7 Hz,24-H),7.68 (1H,t,J=8.0 Hz,23-H),6.11 (1H,d,J=8.5 Hz,7-H),6.04 (1H,d,J=8.5 Hz,8-H),4.66 (2H,s,NCH2),3.13 (1H,d,J=8.0 Hz,2-H),2.75 (1H,d,J=8.0 Hz,5-H),2.60 (1H,dq,J=13.7,6.8 Hz,11-H),1.56-1.50(4H,m,14-H,9a-H),1.49-1.44 (1H,m,10a-H),1.39-1.34 (1H,m,9b-H),1.33-1.27 (1H,m,10b-H),1.10 (3H,d,J=6.8 Hz,13-H),0.99 (3H,d,J=7.0 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),176.7 (C-3),164.9 (C-16),161.1(C-17),160.6 (C-18),148.8 (C-21),136.6 (C-7),135.9 (C-8),133.0 (C-19),131.8 (C-24),130.5 (C-23),125.3 (C-20),122.2 (C-21),50.8(C-5),47.0 (C-2),43.9 (C-15),40.1 (C-1),37.1(C-6),34.4 (C-10),29.8 (C-11),23.1 (C-9),22.8 (C-14),18.6 (C-13),17.0 (C-12);ESI-MSm/z:493.8[M-H]+。
α-蒎烯基-4-硝基苯基噻二唑7h 黄色固体,收率60%,mp.185~186 ℃;IR (KBr)νmax3183,3036,2959,2932,2872,2738,1776,1705,1525,1345,1306 cm-1;1H NMR (CDCl3,600 MHz)δ:12.76 (1H,s,NH),8.34 (2H,d,J=8.8 Hz,21-H,23-H),8.09(2H,d,J=6.9 Hz,20-H,24-H),6.12 (1H,d,J=8.5 Hz,7-H),6.04 (1H,d,J=8.5 Hz,8-H),4.61(2H,s,NCH2),3.13 (1H,d,J=8.1 Hz,2-H),2.75 (1H,d,J=8.0 Hz,5-H),2.60 (1H,dt,J=13.7,6.9 Hz,11-H),1.57-1.51 (4H,m,14-H,9a-H),1.50-1.43 (1H,m,10a-H),1.38 (1H,m,9b-H),1.34-1.30 (1H,m,10b-H),1.11 (3H,d,J=6.8 Hz,13-H),1.00 (3H,d,J=6.9 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.1 (C-4),176.6 (C-3),164.7 (C-16),163.7 (C-17),159.7 (C-18),148.4 (C-22),139.0 (C-19),136.6 (C-7),135.9(C-8),128.2 (C-21,C-23),127.4 (C-20,C-24),50.8 (C-5),46.9 (C-2),43.7 (C-15),41.1 (C-1),37.1 (C-6),34.4 (C-10),29.8 (C-11),23.1(C-9),22.8 (C-14),18.6 (C-13),17.0 (C-12);ESI-MSm/z:493.8[M-H]+。
α-蒎烯基-3,5-二硝基苯基噻二唑7i 浅黄色固体,收率65%,mp.176~177 ℃;IR (KBr)νmax3168,3038,2961,2934,2874,2733,1775,1706,1545,1345,1299 cm-1;1H NMR (CDCl3,600 MHz)δ:13.03 (1H,s,NH),9.12 (1H,t,J=2.0 Hz,22-H),9.04 (2H,d,J=2.0 Hz,20-H,24-H),6.12(1H,d,J=8.5 Hz,7-H),6.04 (1H,d,J=8.5 Hz,8-H),4.65 (2H,s,NCH2),3.15 (1H,d,J=8.0 Hz,2-H),2.77 (1H,d,J=8.0 Hz,5-H),2.62-2.54 (1H,m,11-H),1.58-1.52 (1H,m,9a-H),1.47 (4H,m,14-H,10a-H),1.40-1.35 (1H,m,9b-H),1.32 (1H,m,10b-H),1.10 (3H,d,J=6.7 Hz,13-H),1.00 (3H,d,J=6.9 Hz,12-H);13C NMR (CDCl3,150 MHz)δ:177.2 (C-4),176.7 (C-3),165.0 (C-16),161.1 (C-17),159.1 (C-18),149.2 (C-21,C-23),136.7 (C-7),135.9 (C-8),133.6 (C-19),126.9 (C-20,C-24),120.1 (C-22),50.8 (C-5),46.9 (C-2),40.9 (C-15),37.1 (C-1),34.3 (C-6),29.8 (C-9),23.1 (C-10),22.8(C-14),18.5 (C-13),17.0 (C-12);ESI-MSm/z:538.7[M-H]+。
2.2 中间体4 的合成
由于甘氨酸本身存在显弱碱性的氨基和显酸性的羧基,在溶剂中容易自身形成内盐而影响氮原子的亲核性以至减慢反应速率。故在DMF 作溶剂的环境下,加入与甘氨酸等摩尔的三乙胺与之成盐,再与加成物3 反应,能明显加快反应进程。试用了冰醋酸和DMF 作溶剂,发现在DMF 作溶剂时,可得到化合物4。
2.3 目标产物7 的合成
在目标产物7 的合成过程中,分别试用了二氯甲烷、丙酮和二氧六环作溶剂。实验发现,化合物6在二氯甲烷或丙酮中的溶解度都很小,且TLC 没有监测到有目标产物生成。而化合物6 在二氧六环中有一定的溶解性,且二氧六环能与水混溶,在反应结束时可以通过水洗的方式除掉溶剂和反应中生成的三乙胺盐酸盐,步骤简单有效。综合考虑,最终选用二氧六环作溶剂。
2.4 目标产物的杀菌活性
由表1 可知,在50 μg/mL 浓度下,所有目标化合物7a~7i 对黄瓜枯萎、花生褐斑、苹果轮纹、番茄早疫和小麦赤霉这五种植物病菌都显示一定的抑制活性。尤其对苹果轮纹病菌的抑制活性较好,其中化合物7d(R=3-Cl)的抑制率达92.6%(A 级活性水平),化合物7a(R=H)、7b(R=3-F)、7c(R=2-Cl)和7g(R=3-NO2)的抑制率分别为87.8%、73.0%、76.7%和87.8%(B 级活性水平);化合物7a(R=H)对花生褐斑病菌的抑制率达91.8%(A级活性水平);化合物7d(R=3-Cl)对黄瓜枯萎病菌的抑制率为76.7%(B 级活性水平);化合物7c(R=2-Cl)和7d(R=3-Cl)对番茄早疫病菌的抑制率均达到73.2%(B 级活性水平)。所有的目标化合物对小麦赤霉病菌均只有较弱的抑制活性。总体上,苯环上有吸电子基团的化合物比有供电子基团的化合物表现出更好的杀菌活性。
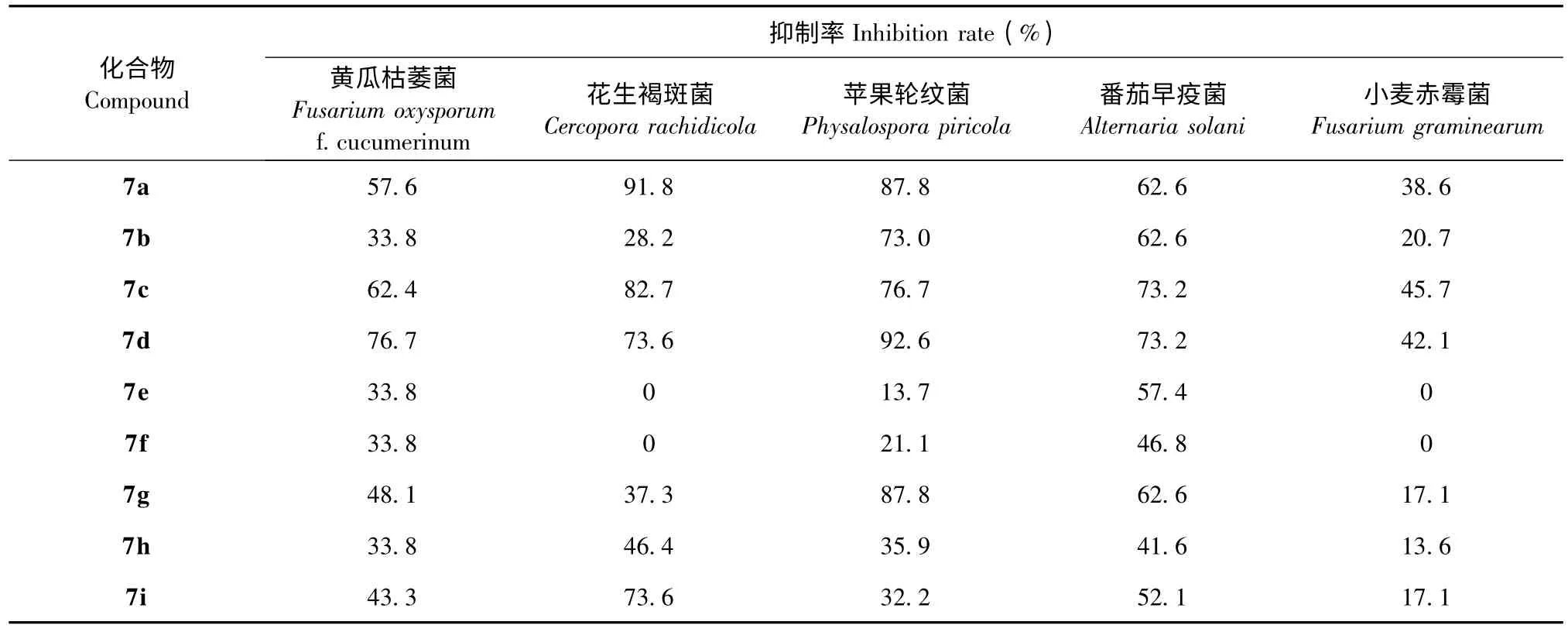
表1 目标产物7a~7i 的杀菌活性Table 1 Fungicidal activities of compounds 7a~7i
3 结论
以松节油的主要成分α-蒎烯为原料,经新型中间体N-羧甲基萜品烯马来酰亚胺,合成得到9 个未见报道的α-蒎烯基苯基噻二唑类化合物。初步探索了合成条件,并利用多种手段对目标化合物进行了分析和表征。初步的生物活性测试结果表明,化合物7a(R=H)和7d(R=3-Cl)的杀菌活性均达到A 级活性水平,是值得进一步研究的先导化合物。
1 Ozek G,Demirci F,Ozek T,et al.Gas chromatographic-mass spectrometric analysis of volatiles obtained by four different techniques from Salvia rosifolia Sm.,and evaluation for biological activity.J Chromatogr A,2010,1217:741-748.
2 Yang YQ(杨益琴),Wang SF(王石发),Li YP(李艳苹),et al.Synthesis of nitrogen-containing derivatives from α-pinene and their nematieidal activity against pinewood nematode.Acta Chim Sinica(化学学报),2009,67:2463-2474.
3 Li XH(李兴海),Ling Y(凌云),Yang XL(杨新玲).Synthesis of novel benzoyl ureas containing thiadiazole and their insecticidal activity.Chemistry(化学通报),2003,66:322,333-336.
4 Li Q,Ren JM,Dong F,et al.Synthesis and antifungal activity of thiadiazole-functionalized chitosan derivatives.Carbohy Res,2013,373:103-107.
5 Shen LH,Li HY,Shang HX,et al.Synthesis and cytotoxic evaluation of new colchicines derivatives bearing 1,3,4-thiadiazole moieties.Chin Chem Let,2013,24:299-302.
6 Ma XL(马献力),Huang JX(黄建新),Duan WG(段文贵),et al.Synthesis and fungicidal activity of α-terpinenemaleimide-based acylhydrazone derivatives.Chin J Org Chem(有机化学),2012,32:1077-1083.
7 Ma CH(马长花),Cen B(岑波),Duan WG(段文贵),et al.Synthesis and biological activities of pinic acid-based dithioureas.Chem Ind Forest Prod(林产化学与工业),2013,33:37-44.
8 Lin GS(林桂汕),Zou RX(邹荣霞),Duan WG(段文贵),et al.Synthesis and herbicidal activities of novel pinic acidbased diacylhyazone compounds.Chin J Synth Chem(合成化学),2013,21:513-517.
9 Luo CQ(罗常泉),Duan WG(段文贵),Cen B(岑波),et al.Synthesis of α-pinene-maleic anhydride adduct.Biomass Chem Eng(生物质化学工程),2006,40(3):25-28.
10 He BJ(何冰晶),Tao XF(陶雪芬).Synthesis of 1-amino-5-(p-hydroxyphenyl)-1,3,4-thiadiazole and its salicylaldehyde Schiff base.Chin J Synth Chem(合成化学),2008,16:233-236.
