大孔树脂分离纯化陈皮中多甲氧基黄酮类化合物
2014-01-08阳秀娟
刘 韶,阳秀娟
1中南大学湘雅医院药学部,湖南长沙 410008;2 桂林医学院附属医院临桂院区药剂科,广西桂林 541100
陈皮是芸香科柑橘属植物橘(Citru reticulataBlaneo)及其栽培变种的干燥成熟果皮[1],其性温、辛、味苦,归肺、脾经,具有理气健脾、燥湿化痰的功效[2]。陈皮中含有多种多甲氧基黄酮类成分,其中川陈皮素和橘皮素含量较高。近年来发现多甲氧基黄酮类成分具有抗癌、抗肿瘤、抗炎、抗氧化、抗诱变等生物活性逐渐成为热点[3-5],因此,对含多甲氧基黄酮陈皮进行纯化研究很有必要。但该类研究报道不多[6,7],多研究其所含的另一类黄酮,如陈皮苷。大孔树脂是一种多孔的聚合物吸附剂,现已广泛应用于中药中有效部位的纯化研究[7],本文以川陈皮素和橘皮素为评价指标,筛选陈皮中多甲氧基黄酮类的大孔树脂分离纯化工艺。
1 材料与方法
1.1 仪器与材料
电子天平(德国Sartorius 公司);旋转蒸发仪(郑州长城R-1001N);恒温水浴锅(余姚市亚星仪器仪表有限公司);Agilent-1100 型液相色谱仪器(包括G1311A 四元梯度泵、G1313A 自动进样器、G1311A 柱温箱、G1313A 二极管阵列检测器,美国安捷伦科技有限公司)。
陈皮(产地:江西,批号:201207061),经中南大学湘雅医院药学部刘韶主任药师鉴定为芸香科柑橘属植物橘(Citru reticulataBlaneo)的干燥成熟果皮;D101 型大孔吸附树脂(天津市光复精细化工研究所);DM130 型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);川陈皮素和橘皮素对照品(陕西永健制药有限公司,纯度≥98%);乙腈(色谱纯);乙醇(分析纯);纯化水(自制)。
1.2 川陈皮素和橘皮素的含量测定
1.2.1 色谱条件[8,9]
色谱柱为XB-C18(5 μm,4.6 mm ×250 mm);流动相为乙腈-水(50∶50);流速为1.0 mL/min;检测波长330 nm;柱温为25 ℃;进样量为10 μL。
1.2.2 对照品溶液的制备和标准曲线的绘制
精密量取川陈皮素标准品25 mg,置50 mL 容量瓶中,加适量无水乙醇,使之溶解,再加无水乙醇定容至刻度,摇匀、即可。精密量取川陈皮素标准溶液1、2、4、6、8、10 mL 分别置10 mL 容量瓶中,各加无水乙醇混匀,再定容至刻度、摇匀。用HPLC 测定峰面积,以峰面积为纵坐标,浓度为横坐标绘制标准曲线,得线性方程。
精密量取橘皮素标准品12.5 mg,置25 mL 容量瓶中,加适量无水乙醇,使之溶解,再加无水乙醇定容至刻度、摇匀,即可。精密量取橘皮素标准溶液0.2、0.5、1、2、3、4 mL 分别置10 mL 容量瓶中,各加无水乙醇混匀,再定容至刻度、摇匀。用HPLC 测定峰面积,以峰面积为纵坐标,浓度为横坐标绘制标准曲线,得线性方程。
1.2.3 样品溶液的制备
称取陈皮药材500 g,以85%的乙醇10 倍量提取2 次,每次提取1h,过滤,合并滤液,将滤液旋转蒸发,回收乙醇,再用30%乙醇溶解,并定容至1000 mL 作为样品液,放冰箱(4 ℃)中备用。
1.2.4 精密度、稳定性、重现性试验
取同一对照品溶液,重复进样6 次,测定川陈皮素、橘皮素的峰面积,计算精密度的RSD。取供试品溶液,自溶液配制后分别在0、2、4、8、12、24 h 各进样10 μL,测定川陈皮素、橘皮素峰面积,计算稳定性的RSD。精密称定陈皮粉末6 份,每份约1 g,按“1.2.3”项下方法处理,进行重现性实验,以峰面积计算,得到川陈皮素、橘皮素峰面积的RSD。
1.3 大孔树脂预处理
将未处理的大孔树脂用适量95%乙醇浸泡过夜,倒出乙醇,用纯化水洗,并湿法装柱,再用纯化水洗至流出液无醇味,备用。
1.4 大孔树脂的种类筛选
将已预处理的D101、DM130 型大孔树脂分别称取1 g 于带磨口塞的锥形瓶中,各加入适量陈皮样品液,静置过夜,过滤后得吸附后溶液。往过滤后的树脂中,各加95%乙醇适量,静置过夜,过滤后得解吸后溶液。重复试验3 次,用HPLC 法测定各样品中的川陈皮素和橘皮素,按下式分别计算吸附量和解吸率。
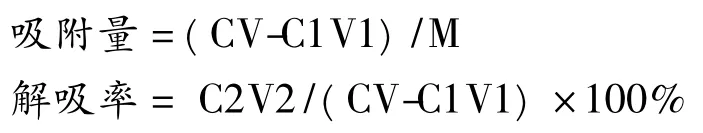
式中:C、V 分别是陈皮样品液的浓度(mg/mL)和体积(mL),C1、V1 分别是吸附后溶液的浓度(mg/mL)和体积(mL),M 是树脂的质量(g),C2、V2 分别是解吸液的浓度(mg/mL)和体积(mL)[6]。
1.5 洗脱剂乙醇浓度的确定
取约20 g 已预处理的D101 型大孔树脂3 份,湿法装柱,取陈皮样品液70 mL 上柱,用2 BV 水和3 BV 30%乙醇分别洗脱除去杂质,再将第一份树脂柱用6 BV 70%乙醇继续洗脱,第二份树脂柱用6 BV 80%乙醇继续洗脱,第三份树脂柱用6 BV 95%乙醇继续洗脱,分别吸取每份的上样液、流出液和洗脱液测定,按文献方法[10]计算川陈皮素、橘皮素的吸附量及洗脱率。
1.6 洗脱剂用量的考察
取约20 g 已预处理的D101 型大孔树脂湿法装柱,取陈皮样品液70 mL 上柱,用2 BV 水和3 BV 30%乙醇分别洗脱除去杂质,再用6 BV 80%乙醇洗脱,每2 BV 一份,共3 份。依次吸取上样液、流出液和洗脱液测定,并计算川陈皮素、橘皮素的洗脱率。
1.7 上样液浓度的考察
取约20 g 已预处理的D101 树脂两份分别湿法装柱,将质量浓度为167 mg/mL 和500 mg/mL 的陈皮样品液上柱,吸附过夜后,先用2 BV 水和3 BV 30%乙醇分别洗脱除去杂质,再用6 BV 80%乙醇洗脱,流速1.5 mL/min。依次吸取上样液、流出液和洗脱液测定并计算川陈皮素和橘皮素的吸附量及洗脱率。
1.8 工艺重复性考察
按确定好的吸附、洗脱条件,重复实验三次,依次吸取流出液和洗脱液测定,计算川陈皮素和橘皮素的吸附量、洗脱量及洗脱率。另取陈皮样品液和三次80%乙醇洗脱液倒入已恒重好的蒸发皿中在70 ℃水浴锅上蒸干,再放入105 ℃烘箱中烘4 h,再取出,放到干燥器中干燥1 h,称重,计算浸膏得率(浸膏得率=浸膏量/样品液中所含药材的量×100%),并测定浸膏中川陈皮素和橘皮素的含量。
1.9 树脂重复使用次数的考察
取陈皮样品液,按前述条件进行试验,在同一根柱上重复操作4 次,分别测定、计算出川陈皮素和橘皮素的吸附量、洗脱量及洗脱率。
2 结果与讨论
2.1 HPLC 含量测定方法学考察结果
川陈皮素和橘皮素对照品及样品的色谱图见图1,从图中可以看出,各组分分离度良好。以峰面积为纵坐标,浓度为横坐标绘制标准曲线,求得川陈皮素和橘皮素线性方程分别为Y=17721X+15.763,R2=0.9999;Y=23898X-14.467,R2=0.9997。表明各化合物在相应范围内线性关系良好。精密度试验中川陈皮素和橘皮素峰面积RSD 分别为1.2%和1.1%,表明仪器精密度良好。稳定性试验中,川陈皮素和橘皮素峰面积RSD 分别为1.5%和0.9%,表明样品在24 h 内稳定。重复性试验中,川陈皮素和橘皮素峰面积RSD 分别为1.4%和1.6%,表明该方法重复性良好。
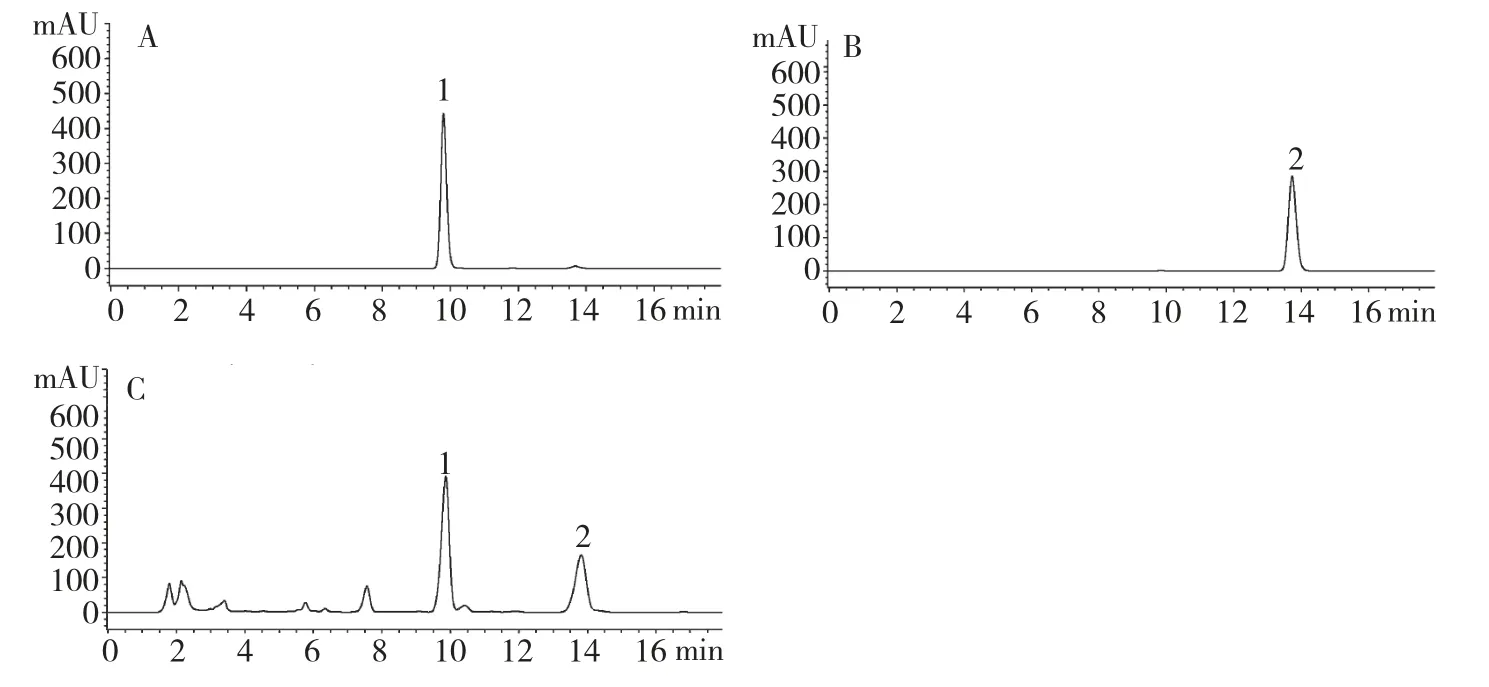
图1 川陈皮素对照品(A)、橘皮素对照品(B)及陈皮样品(C)的HPLC 色谱图Fig.1 HPLC chromatogram of nobiletin (A),tangeretin (B)and orange peel sample (C)1:川陈皮素nobiletin;2:橘皮素tangeretin
2.2 大孔树脂类型筛选结果
D101、DM130 型大孔树脂对陈皮样品液中川陈皮素和橘皮素的吸附量及解吸率见表1。3 次试验结果基本一致,2 种树脂对川陈皮素和橘皮素的吸附量以及解析率的相对标准偏差小于1.5%。D101型大孔树脂对川陈皮素和橘皮素的吸附量稍大于DM130 型树脂,解吸率也高于DM130 型树脂,因此选用D101 型大孔树脂。

表1 不同树脂对陈皮样品液中川陈皮素和橘皮素的吸附量及解吸率(n=3)Table 1 The adsorption and desorption rate of different resins for nobiletin and tangeretin (n=3)
2.3 洗脱剂乙醇浓度考察结果
不同浓度乙醇的洗脱效果见表2。从表2 可知,80%乙醇和95%乙醇的洗脱效果都比较好。对于川陈皮素,80%乙醇和95%乙醇的洗脱率接近,而对于橘皮素,80%乙醇的洗脱率则较95%乙醇的洗脱率稍低,但也能达到85.9%的洗脱率。因此,综合因素考虑选用80%乙醇。
2.4 洗脱剂用量的考察
从图2 中可以看出,第一个2 BV 80%乙醇洗脱液中,川陈皮素洗脱率达到54.14%,橘皮素的洗脱率达到20.00%,第二个2 BV 80%乙醇洗脱液中,川陈皮素洗脱率达到39.65%,橘皮素的洗脱率达到46.84%,第三个2 BV 80%乙醇洗脱液中,川陈皮素洗脱率达到5.34%,橘皮素的洗脱率达到19.06%。即6 BV 80%乙醇洗脱后,川陈皮素总的洗脱率达到96.13%,橘皮素总的洗脱率达到85.9%,表明当80%乙醇用量为6 BV 时已基本上将这两种多甲氧基黄酮洗脱完全,因此确定树脂的最佳洗脱量为6 BV。
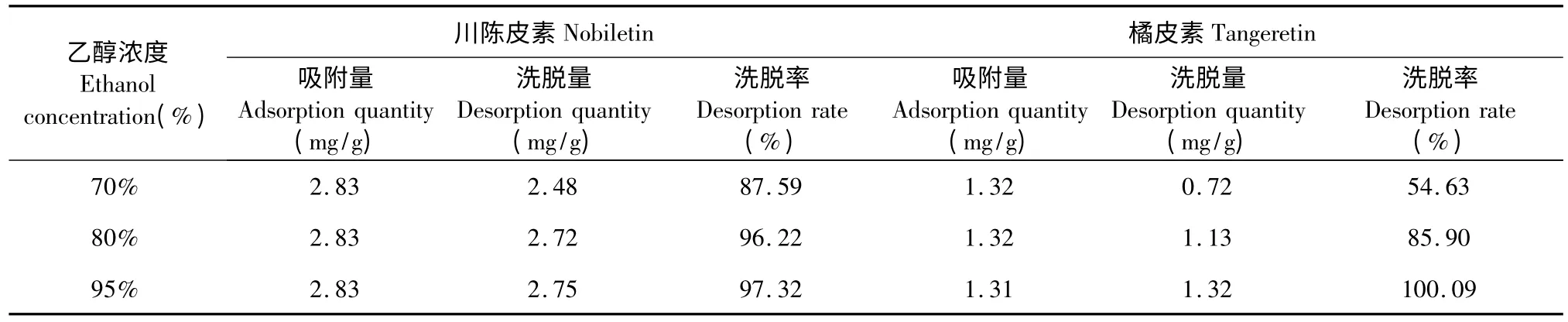
表2 洗脱剂乙醇浓度的考察结果Table 2 Effects of ethanol concentration on desorption rate of nobiletin and tangeretin
2.5 上样液浓度的考察
D101 树脂对不同浓度样品溶液中的川陈皮素和橘皮素的吸附量,解吸率见表3。从表3 可以看出,500 mg/mL(以陈皮药材计)为较佳的上样浓度。
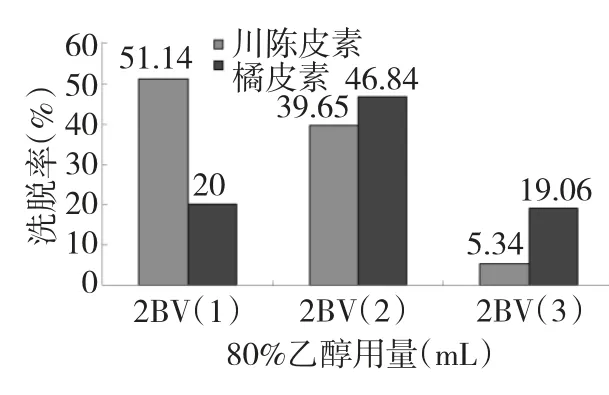
图2 洗脱剂用量的考察Fig.2 Effects of eluent dosage on desorption rate of nobiletin and tangeretin

表3 上样液浓度的考察结果Table 3 Effects of sample concentration on desorption rate of nobiletin and tangeretin
2.6 工艺重复性考察
表4 为重复实验3 次的结果。三次实验中,川陈皮素和橘皮素的吸附量、洗脱量及洗脱率都接近,说明在同等条件下实验,能达到稳定的吸附和洗脱。陈皮样品液和三次实验中80%乙醇洗脱液的浸膏得率及浸膏中川陈皮素和橘皮素的含量见表5。从表5 的结果能够看出,陈皮样品液通过D101 型大孔树脂的分离纯化后浸膏得率下降,而浸膏中川陈皮素和橘皮素的含量增加。浸膏中川陈皮素的含量由纯化前2.54%到纯化后变为11.96%,提高了3.7倍;浸膏中橘皮素的含量由纯化前1.22%到纯化后变为5.11%,提高了3.2 倍。

表4 工艺重复性考察的结果Table 4 The results of process repeatability
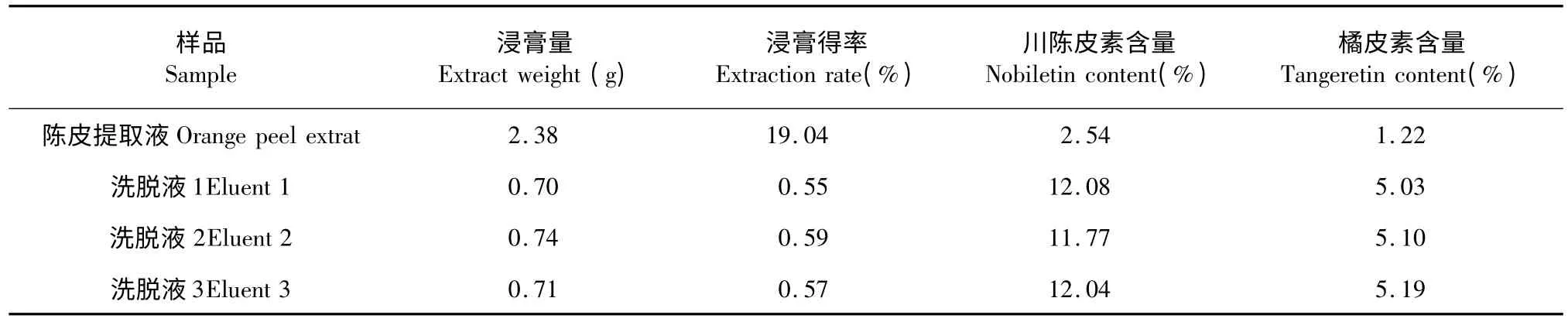
表5 纯化效果考察结果Table 5 The results of purification effect
2.7 树脂重复使用次数的考察
树脂重复使用次数越多,其洗脱量会下降,洗脱率也会降低。本实验结果(表6)表明:重复使用3次,川陈皮素和橘皮素的吸附量、洗脱量及洗脱率都变化不大。使用第4 次后,川陈皮素和橘皮素的吸附量、洗脱量及洗脱率都有所下降。因此,树脂重复使用3 次后,要进行活化处理。
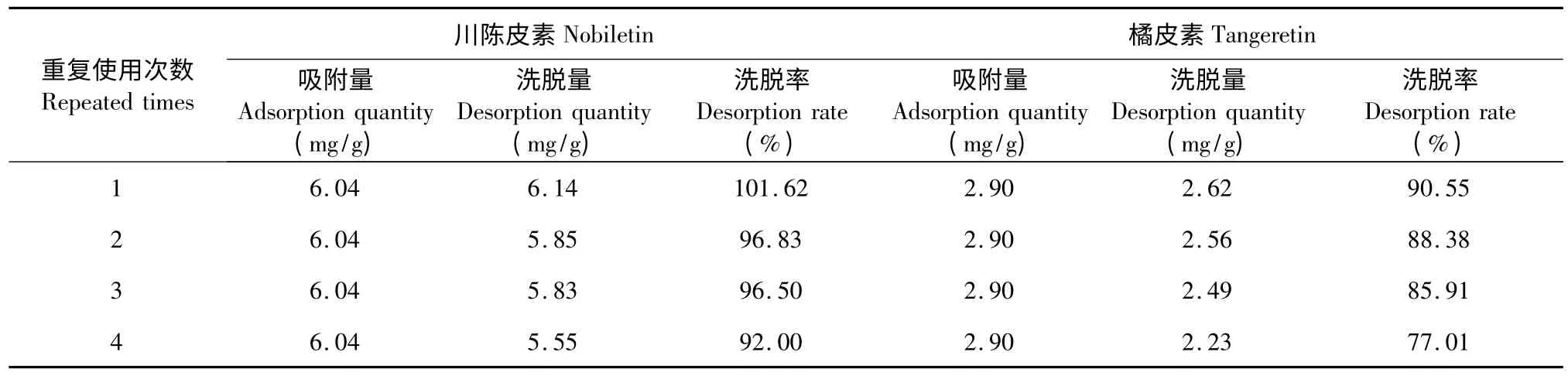
表6 树脂重复使用次数考察结果Table 6 The repeated using times of resin
3 结论
本实验的纯化目标成分是川陈皮素和橘皮素等多甲氧基黄酮类成分,紫外光分光光度法、HPLC 法均可以用来测定其含量。本实验采用HPLC 法测定样品中的川陈皮素和橘皮素,并以它们为评价指标,筛选大孔树脂分离纯化工艺,可信度更高、更能反映纯化工艺的情况。
树脂的类型,洗脱的浓度,洗脱剂的用量,上样液的浓度等对川陈皮素和橘皮素等多甲氧基黄酮类成分的纯化工艺影响较大。本实验首先通过参考文献和预实验,并根据川陈皮素和橘皮素的结构特征和树脂性质,排除了多种树脂,只选用D101 型和DM130 型大孔树脂来进行静态吸附、解吸实验。根据影响树脂纯化的因素,本论文还对洗脱的浓度,洗脱剂的用量,上样液的浓度等进行了考察,确定D101 型大孔树脂为较佳的吸附树脂,最佳工艺条件为:洗脱剂为80%乙醇,洗脱剂用量为6 BV,最佳上样液浓度为500 mg/mL。经过处理后川陈皮素和橘皮素的纯度分别提高了3.7 倍和3.2 倍。
本实验操作简单,实验成本较低,经济环保且能达到较好的分离纯化效果,能用于陈皮中多甲氧基黄酮类化合物的分离纯化。
1 Zheng GD(郑国栋),Jiang L (蒋林),Yang X (杨雪),et al.Study on the contents of flavonoids inCitrus reticulata‘Chachi’storaged in different years.Chin Tradit Patent Med(中成药),2010,32:977-980.
2 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,57.
3 Song JL(宋家玲),Yang YJ(杨永建),Li Q(李强),et al.Advances on research of polymethoxylated flavones.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2012,18:308-313.
4 Wang L(王磊),Su XS (苏学素),Fu CM(付陈梅),et al.Research progress on biological activities and applications of polymethoxy flavonoids fromCitrus.Food Sci(食品科学),2009,30:285-290.
5 Li SM,Pan MH,Lo CY,et al.Chemistry and health effects of polymethoxyfiavones and hydrxylated polymethoxyflavones.J Functional Foods,2009,1:2-12.
6 Liu BF(刘邦夫),Wang HX(王辉宪),Cao YB(曹永兵),et al.Study on separation and purification of flavonoids fromcitrus.Che Res App(化学研究与应用),2008,20:485-489.
7 Chen FS(陈复生),Zuo JJ(左锦静),YaoYZ(姚永志).Study on the performance of absorption and separation of macroporous res ins for the flavonoids fromcitrus.Food Sci Tech(食品科技),2006,7:121-124.
8 Zheng GD(郑国栋),Jiang L(蒋林),Yang DB(杨得坡),et al.HPLC simultaneous determination of contents of five flavonoids inCitrus reticulata‘Chachi’from various habitats.Chin Tradit Herb Drugs(中草药),2010,41:652-655.
9 Li LW(林乐维),Jiang L(蒋林),Zheng GD(郑国栋).Study on the contents of flavonoids inCitrus reticulata‘Chachi’from various habitats and different collecting periods.J Chin Med Mater(中药材),2010,33:173-176.
10 Wu ZC (吴志成),Liu SZ(刘淑芝),Li ML(李曼玲),et al.Study on refine techincs of fufang jingzhigguanxin with macroporous resin.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(8):11-14.
