大围山微型鸡POU1F1基因编码区的克隆及序列分析
2014-01-07富国文王绍卿滕晓红荣华贾俊静樊月圆
富国文,王绍卿,滕晓红,荣华,贾俊静,樊月圆
(云南农业大学 动物科学技术学院,云南 昆明,650201)
垂体特异转录因子(pituitary specific transcription 1,POU1F1)是动物垂体前叶特异表达的一种具有重要功能的转录因子,该转录因子表达的产物通过与垂体中PRL基因、GH基因、TSH基因以及POU 1F1自身的调控元件结合,调控这些基因的转录,从而对动物的生长发育等起着重要的调控作用[1-2]。POU1F1由POU1F1基因编码,是POU结构域因子家族的一员。POU家族中成员大多具有一个POU特异区(POU-HD)和一个POU同源区(POU-SD)的DNA结合域,该结构域能识别特异的基因序列并与之结合。从而引起细胞内基因转录,促进垂体前叶促生长素细胞、催乳细胞和促甲状腺素细胞基因的转录等生物学活性[3]。在人上,POU1F1基因位点的突变可导致人类的生长发育异常,包括生长缓慢及矮小等症状。同时GH、PRL和TSH-β缺乏的程度依赖于POU1F1基因的突变类型;在鼠上,已研究证实该基因与矮小性状基因座存在紧密连锁关系[4-7]。在家禽上,POU1F1基因位点的突变与其生长性能相关性也被做了大量的研究[8-10]。
大围山微型鸡是云南省的优良地方品种,主要分布在云南省红河州屏边苗族自治县境内大围山自然保护区。该鸡种具有较高的屠宰率和全净膛率,产蛋率高,耗料少,饲料报酬率高等优点。但是它个体小,成为其在生产上的致命缺点。如果能从分子水平上找出该品种体型较小的成因,无疑对改变其生长状况具有重要实际意义。
1 材料与方法
1.1 材 料
来自云南武定县的武定鸡和大围山的微型鸡各5只。从翅下采血5 m L,于-80℃保存。
1.2 基因组DNA制备
血样基因组DNA的提取用常规的酚-氯仿抽提法,提取后的DNA用TE缓冲液溶解后,经0.5%琼脂糖凝胶电泳检测和紫外分光光度计测定浓度后,-20℃ 保存备用。
1.3 PCR扩增
引物设计:参照GeneBank中提供的鸡POU1F1基因的序列(登录号:NC_006088),利用Primer 5.0软件设计引物。引物共6对,包括6个完整的外显子区域,引物的合成及测序工作由华大基因技术有限公司完成。引物信息如下(表1)。

表1 引物序列、产物大小、位置以及Tm值Table 1 The sequences of primers,length,location and Tm of each PCR product
15μL PCR反应体系:10×Buffer(含15 m M Mg2+)1.5μL,2 m M d NTPs 1.5μL,2 U/μL Taq DNA聚合酶0.25μL,5 M混合引物(上游引物和下游引物各为10 pmol/μL)0.6μL,模板DNA (50 ng/μL)1.0μL,dd H2O 10.15μL。
PCR扩增程序:94℃预变性4min;35个循环(94℃30s,Tm 30 s,72℃30 s);72℃延伸10min,4℃保存。
1.4 POU1F1基因PCR产物的回收与测序
PCR产物用1.5%的琼脂糖凝胶电泳检测其扩增结果,并送北京六合华大基因科技股份有限公司测序,使用软件剪切拼接后获得编码区序列。
1.5 POU1F1基因编码区序列的生物信息学分析

图1 POU1F1基因P1~P6引物的扩增结果Fig.1 PCR amplification of P1~P6 primers for POU1F1 geneM.DNA标准 DL2000;1,2.P1引物的扩增产物;3,4.P2引物的扩增产物;5,6.P3引物的扩增产物;7,8.P4引物的扩增产物;9,10.P5引物的扩增产物;11,12.P6引物的扩增产物M.DNA Marker DL2000;1,2.Product of P1;3,4.Product of P2;5,6.Product of P3;7,8.Product of P4;9,10.Product of P5;11,12.Product of P6
利用DNAstar软件包中的EditSeq、GeneQuest和Meg Align对PUO1F1基因序列、ORF进行分析;利用Protean软件对POU1F1基因编码产物的氨基酸组成、蛋白质结构及其理化性质进行分析预测;从NCBI下载不同物种的POU1F1基因序列,利用DNAman和DNAstar软件进行系统发育树及遗传距离研究。
2 结果与分析
2.1 POU1F1基因的PCR扩增结果
POU1F1基因各引物均得到特异性扩增,如图1所示。其中P1引物的扩增产物为1和2号样品,扩增片段大小为245 bp;P2引物的扩增产物为3和4号样品,扩增片段大小为286 bp;P3引物的扩增产物为5和6号样品,扩增片段大小为318 bp;P4引物的扩增产物为7和8号样品,扩增片段大小为269 bp;P5引物的扩增产物为9和10号样品,扩增片段大小为208 bp;P6引物的扩增产物为11和12号样品,扩增片段大小为245 bp。
2.2 大围山微型鸡编码区的序列分析
利用DNAstar软件对6对引物的测序结果与Gallus gallus(NM_204319)进行了比对,手工剪接后得到了全长编码区序列,大围山微型鸡POU1F1基因编码区序列全长为984 bp,武定鸡POU1F1基因编码区序列全长也为984 bp。与Gallus gallus(NM_204319)进行了比较,在检测的个体中,大围山微型鸡在编码区的836 bp处发生了一个C/T的单碱基突变,该突变未引起279位Ile变异。利用EditSeq和GeneQuest软件,对大围山微型鸡POU1F1基因的编码区的核苷酸组成进行分析,其中核苷酸A、C、G和T分别为287、238、229和230个。
2.3 POU1F1基因的开放阅读框分析
本研究将大围山微型鸡编码区序列通过Edit-Seq软件进行分析,获得了一条长456 bp的ORF(图2),该ORF起始密码子位于±1,终止密码子位于±984,推测大围山微型鸡POU1F1基因可编码1个由327个氨基酸残基组成的蛋白质。

图2 大围山微型鸡POU1F1基因ORF序列及其编码氨基酸序列Fig.2 The ORF sequence and encoded amino acid sequence of POU1F1 gene of Daweishan mini chickens
2.4 POU1F1基因编码产物的理化性质分析
用Bioedit及Protean软件对POU1F1基因编码产物的理化性质进行预测,结果显示,POU1F1基因编码327个氨基酸,其中丝氨酸(Ser)和亮氨酸(Leu)所占比例最高,分别达到了12.23%和9.17%(图3);推测该编码产物在p H 7.0环境下的电荷量为9.81,理论等电点为 8.67,理论分子质量为38801.19 Da.
根据Protean结果,POU1F1基因的编码产物的疏水性在多肽链第12位缬氨酸具有最低的分值(-2.14),在第250位的精氨酸具有最高的分值(3.72),且推断整条多肽链氨基酸序列表现为亲水性而没有明显的疏水性区域。
2.5 大围山微型鸡与其他物种POU1F1基因核苷酸序列同源性分析
将NCBI上不同物种的POU1F1基因核苷酸序列(牛:NM_174579,家犬:XM_005638736,山羊:NM_001285673,野鸽:XM_005511429,原鸡:NM_204319,人:NM_001122757,猕猴:NM_001042860,家鼠:NM_008849,绵羊:NM_001009350,褐家鼠:NM_013008,野猪:NM_214163)与本研究所获取的大围山微型鸡以及武定鸡的POU1F1基因的核苷酸序列进行对比,利用Meg Align软件分析了这13条核苷酸序列的同源性(表2)并构建系统发育树(图4)。结果表明,原鸡、武定鸡以及大围山微型鸡与其它10个物种POU1F1基因的核苷酸相似性从23.6~26.9,亲缘关系较远。
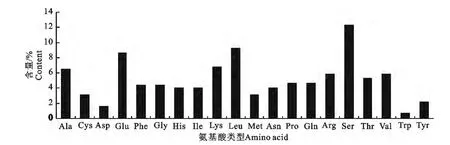
图3 大围山微型鸡POU1F1基因编码区序列的氨基酸组成Fig.3 Amino acid composition of coding DNA sequences of POU1F1 gene of Daweishan mini chickens

表2 不同物种POU1F1基因的遗传距离Table 2 The sequence distance base on the POU1F1 gene of different species
3 讨 论
1992年,在家禽中,火鸡的POU1F1基因首先被Wong等所克隆。克隆结果发现,火鸡的POU1F1基因与哺乳动物类似,存在三种POU1F1m RNA,分别为t POU1F1*,t POU1F1β* 和t POU1F1w*[11];Kurima等[12]1998 年 研 究发现,三种POU1F1 m RNA中t POU1F1*表达量最高,t POU1F1β*表达量最低。Tanaka等[13]1999年从鸡的垂体中克隆了编码325和327氨基酸的两种POU1F1m RNA,分别为c POU1F1α和c POU1F1γ。研究表明,POU1F1基因的正常表达是垂体前叶正常发育及激素正常分泌的必要条件。POU1F1基因突变可能造成人和鼠复合性垂体激素缺乏症。姜润泽[14]研究表明,POU 1 F 1基因第六外显子处(299Asn→Ile)的突变与鸡(尤其是公鸡)早期生长速度显著相关(P<0.05);邱峰芳等[15]研究表明,POU1F1基因与鸡的1~7周龄体重极显著相关(P<0.01),与8周龄体重显著相关(P<0.05);陶勇等[16]在POU1F1基因型检测到一个 A→T突变,杂合型个体体重显著高于纯合型个体。
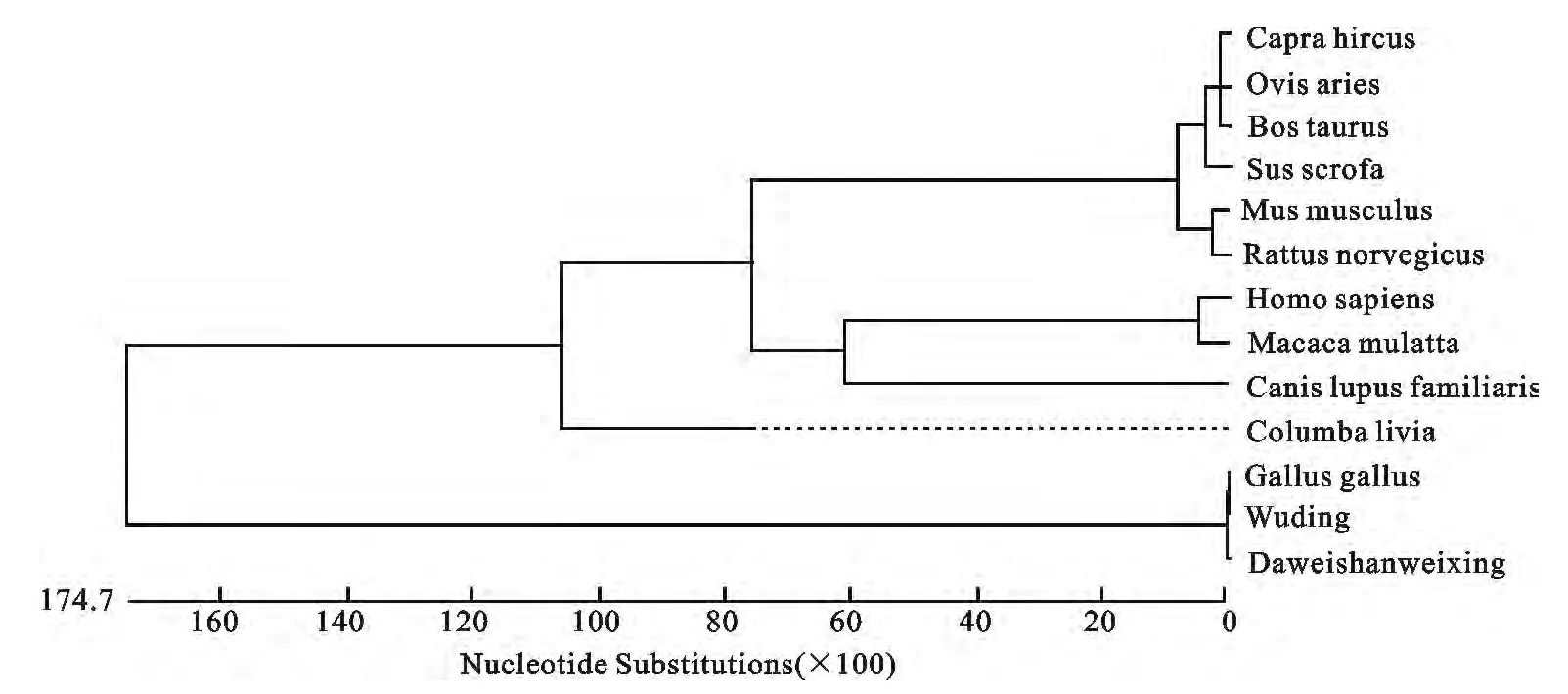
图4 不同物种POU1F1基因系统进化树Fig.4 The phylogentic tree base on the POU1F1 gene of different species
本研究通过对云南地方品种-大围山微型鸡的POU1F1基因6个克隆片段进行拼接后得到了大围山微型鸡POU1F1基因编码区序列,该序列为包括终止密码子在内的完整的编码区序列,序列长度为984 bp,编码有327个氨基酸残基。朱志明等[17]对半番鸭的POU1F1基因进行克隆,获得了完整的cDNA序列,全长为2 209 bp,与鸡的氨基酸序列同源性达到了96.3%。本研究对牛、家犬、山羊、野鸽、原鸡、人、猕猴、家鼠、绵羊、褐家鼠、野猪、大围山微型鸡和武定鸡的核苷酸序列比对发现,家禽与哺乳动物有较远的亲缘关系,核苷酸相似性从23.6~26.9,这与家禽POU1F1序列的特殊性有关。对于家禽而言,禽类POU1F1存在一个由38个氨基酸组成的肽段,该肽段是禽类所特有的,位于相当于哺乳动物外显子2、3之间,将其命名为外显子2a。从遗传距离分析及基因系统进化树,我们也发现,亲缘关系较近先聚在一起,如:牛、山羊及绵羊最先聚在一起,核苷酸相似性达到97.6%以上,聚类结果与传统分类学基本相符。同时在原鸡、武定鸡以及大围山微型鸡的POU1F1基因编码区序列比对中,在大围山微型鸡的836bp处发生了一个C/T的单碱基突变,虽然在核苷酸水平上有一些差异,但属于同义突变,并不影响编码蛋白的结构组成。
本研究所获得的大围山微型鸡的完整的POU1F1编码区序列,为以后研究POU1F1基因与大围山微型鸡经济性状的关联分析提供了基础,也为研究大围山微型鸡体型矮小的分子机理奠定了基础,下一步研究将在增大样本量后,从多个角度全面地揭示其遗传特性。
[1] 姜润深,杨 宁.垂体特异性转录因子POU1F1研究进展[J].遗传,2004,26(6):957-961.
[2] Steinfelder H L,Radovick S.Hormonal regulation of the thyrotropin subunit gene by phosphorylation of the pituitary specific transcription factor(PIT-Ⅰ)[J].Proc Nat Acad Sci USA,1992,89:5 942-5 945.
[3] Ll S,Crenshaw EB,Rawsen E J,el a1.Dwarf locus mutants lacking three pituitary cell types result from mutations in the POU-domain gene Pit-1[J].Nature,1990,347:528-533.
[4] Frisch H,Kim C,Hausler G,et a1.Combined Pituitary hormone deficiency and Pituitary hypoplasia due to a mutation of the POUIFl gene[J].Clin Endocfinol(Oxf),2000,52:661-665.
[5] Steinfelder H J,Radovick S,Wondisford F E.Hormonal regulation of the thyrotrophicβ-subunit gene by phosphorylation of the pituitary specific transcription factor Pit-1[J].Proceedings of the National Academy of Science,1992,89:5 942-5 945.
[6] Li S,Crenshaw E B,Rawson E J,et al.Dwarf locus mutants lacking three pituitary cell types result from mutations in the POU-domain gene Pit-1[J].Nature,1990,347(6293):528-533.
[7] Pellegrini-Bouiller I,Belicar P,Barlier A,et al.A new mutation of the gene encoding the transcription factor Pit-1 is responsible for combined pituitary hormone deficiency [J].J Clin Endocrinol Metab,1996,81(8):2 790-2 796.
[8] 李国辉,张学余,苏一军,等.3个基因SNPs及基因聚合对白耳鸡产蛋数的遗传效应[J].江西农业大学学报,2010,32(4):661-667.
[9] 李国辉,魏 岳,张学余,等.鸡GH和POU1F1基因多态性及基因聚合对产蛋数的影响[J].湖南农业大学学报:自然科学版,2010,36(4):445-448.
[10] 杨 孔,杨艾琳,吴梦玲.藏鸡FSH、POU1F1和FSHR的基因多态性及其与产蛋性能的关系[J].西南民族大学学报:自然科学版,2014,40(1):1-10.
[11] Wong E,Silsby L,Halawani M E.Complementary DNA cloning and expression of Pit-I/GHF-l from the domestic turkey[J].DNA Cell Bio1,1992,11:65l-660.
[12] Kurima K,Weatherly K L,Sharova L,et al.Synthesis of turkey POUIFl mRNA variants by alternative splicing and transcription initiation[J].DNA Cell Bio1,1998,17:93-103.
[13] Tanaka M,Yammnoto l,Ohkubo T,et a1.cDNA cloning and developmental alterations in gene expression of the two POUIFI/GHF-l transcription factors in the chicken pituitary[J].Gen Comp Endocrinol,1999,114:441-448.
[14] 姜润深.鸡PRL、PRLR和POU1F1基因变异对繁殖及POU1F1对生长性状的遗传效应[D].北京:中国农业大学,2005.
[15] 邱峰芳,聂庆华,金卫根,等.鸡PIT-Ⅰ基因57 bp插入/缺失多态与生长和屠体性状的相关研究[J].江西农业大学学报,2006,28(2):284-288.
[16] 陶 勇,李国辉,胡玉萍,等.MC4R、POU1F1基因对京海黄鸡生长性能的遗传效应[J].遗传,2008,7,30(7):900-906.
[17] 朱志明,陈 晖,李盛霖,等.半番鸭POU1F1基因序列的克隆与生物信息学分析[J].福建畜牧兽医,2010,32(1):1-4.
