基质细胞衍化因子-1α对大鼠骨髓间充质干细胞分化的诱导
2014-01-01李元,刘南,罗宏,张磊,熊俊△
李 元, 刘 南, 罗 宏, 张 磊, 熊 俊△
1重庆市肿瘤研究所泌尿外科,重庆 400030
2华中科技大学同济医学院附属协和医院肝胆外科,武汉 430022
移植器官动脉硬化是慢性排斥反应的主要病理特点[1],也是心脏、肝脏、肾脏等器官移植后造成移植器官功能丧失而导致移植失败的主要原因[2]。移植器官动脉硬化的基本组织病理特征是移植动脉内膜进行性增厚,其中新生内膜平滑肌细胞增殖、积聚是硬化动脉内膜增生的主要细胞学基础[3]。然而目前增生内膜平滑肌细胞的来源尚不明确,我们前期研究发现在大鼠主动脉同种异体移植后,血清基质细胞衍化因子(SDF)-1α水平明显升高,同时诱导骨髓间充质干细胞向移植动脉内膜迁移、增殖,参与新生内膜形成[4],而SDF-1α是否直接诱导骨髓间充质干细胞向平滑肌细胞分化尚缺乏充分研究。本实验我们应用SDF-1α孵育大鼠骨髓间充质干细胞,检测其平滑肌细胞标志的表达及迁移能力的变化,同时采用SDF-1α中和抗体证实该变化,以探讨SDF-1α诱导骨髓间充质干细胞定向分化的作用。
1 材料与方法
1.1 材料
重组SDF-1α(10ng/mL)购自美国Cell Signaling Technology公司。人 SDF-1α中和抗体(100 ng/mL)和α-SMA、SM-22α及 Calponin一抗购自美国 Abcam 公司。FITC标记CD90、CD105及CD45荧光一抗购自美国BD Bioscience公司。βactin一抗及二抗和SABC免疫组化试剂盒、DAB显色试剂盒均购自武汉博士德生物技术有限公司。ECL发光试剂盒购自碧云天生物科技有限公司。
1.2 原代大鼠骨髓间充质干细胞的分离培养
根据Xu等[5]报道的密度梯度离心法分离、培养原代细胞。普通级SD大鼠购自华中科技大学同济医学院实验动物学部,共10只。大鼠麻醉后,取其股骨,减去股骨两骺端,以含20%胎牛血清的DMEM培养液从股骨一端冲洗出骨髓,1 000r/min离心3min后去除沉淀,取上清,然后使用Ficoll密度梯度离心,2 500g×30min,收集上层单个核细胞,再重悬、接种于含20%胎牛血清的DMEM培养液中。24h后去除未贴壁细胞,贴壁细胞于37℃、含5%CO2的培养箱中继续传代培养,第3至6代细胞用于实验。
1.3 流式细胞术鉴定及细胞分组
将上述贴壁细胞以0.25%胰酶消化,然后细胞悬液经PBS洗涤,分别以FITC荧光标记CD90一抗(1×106/μL)、CD105一抗(1×106/μL)及 CD45(1×106/μL)一抗,4℃孵育标记30min,再以PBS洗涤后经流式细胞仪(BD FACSCALIBUR,BD Bioscience,USA)检测鉴定。细胞实验随机分为对照组、SDF-1α组和SDF-1α+中和抗体组3组。对照组以无血清培养液处理。每组独立重复实验6次。
1.4 免疫细胞化学染色观察
将原代培养的骨髓间充质干细胞接种于盖玻片上,按上述分组经孵育48h后,以SABC法染色和DAB显色。4%多聚甲醛固定后,以0.3%Triton-X-100对细胞膜打孔15min,30%双氧水与甲醇混合浸泡60min以灭活内源性过氧化物酶,洗涤后以5%牛血清白蛋白封闭60min,分别加入α-SMA一抗(1:500)、SM-22α一抗(1:200)及 Calponin一抗(1:200),以IgG作为对照,4℃湿盒内孵育过夜。滴加生物素化二抗室温孵育20min,加入SABC反应液室温孵育20min,洗涤后加入DAB显色及苏木精复染,脱水,透明,封片。
1.5 Western blot检测
细胞按上述分组经孵育48h后,洗涤加入蛋白裂解液提取总蛋白。煮沸变性后按30μg/孔上样,经10%SDS-PAGE凝胶电泳后转移至PVDF膜,以5%脱脂奶粉封闭60min,分别加入α-SMA一抗(1:1 000)、SM-22α一抗(1:500)及 Calponin一抗(1:500)和β-actin一抗(1:1 000),4℃孵育过夜,二抗室温孵育1h后,ECL发光,曝光显影。
1.6 细胞迁移分析
采用Transwell小室法,按上述分组上室内分别接种5×104个细胞,下室分别加入600μL无血清培养液、重组SDF-1α(10ng/mL)以及添加SDF-1α中和抗体(100ng/mL)的重组 SDF-1α(10ng/mL),于5%CO2培养箱内37℃孵育48h后,苏木精复染下室内细胞,显微镜下计数穿膜细胞。每组独立重复实验6次。
1.7 统计学方法
2 结果
2.1 大鼠骨髓间充质干细胞原代培养及鉴定
采用密度梯度离心法成功分离原代培养大鼠骨髓间充质干细胞,原代培养14d后,大鼠骨髓间充质干细胞呈现典型的梭形形态,以FITC荧光标记骨髓间充质干细胞抗体,经流式细胞仪检测鉴定显示CD45-,CD90+和CD105+,证实为骨髓间充质干细胞(图1)。

图1 大鼠骨髓间充质干细胞鉴定Fig.1 Identification of rat bone marrow stem cells
2.2 SDF-1α对大鼠骨髓间充质干细胞分化的影响
Western blot和免疫细胞化学检测显示大鼠骨髓间充质干细胞经重组SDF-1α孵育后明显表达平滑肌细胞标志α-SMA、SM-22α和 Calponin。另一方面,在重组SDF-1α孵育同时加入SDF-1α中和抗体同时孵育48h后,大鼠骨髓间充质干细胞表达平滑肌细胞标志 α-SMA、SM-22α和 Calponin不明显,较对照组未见明显变化(图2、图3)。
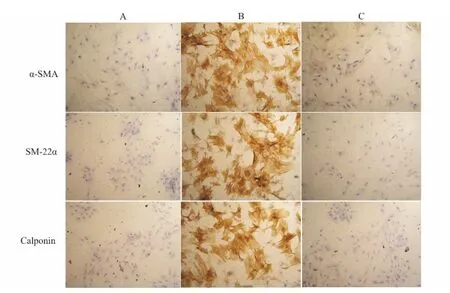
图2 免疫细胞化学检测SDF-1α对大鼠骨髓间充质干细胞分化的影响(×100)Fig.2 Effect of SDF-1αon rat bone marrow stem cells differentiation shown by immunocytochemistry(×100)

图3 Western blot检测SDF-1α对大鼠骨髓间充质干细胞分化的影响Fig.3 Effect of SDF-1αon rat bone marrow stem cells differentiation detected by Western blot
2.3 SDF-1α对大鼠骨髓间充质干细胞迁移能力的影响
采用Transwell法检测SDF-1α刺激48h后大鼠骨髓间充质干细胞的迁移能力,结果显示迁移细胞数为(8 375±1 776)个,迁移能力较对照组明显提高(P<0.05),而加入SDF-1α中和抗体同时刺激的骨髓间充质干细胞迁移数(4 250±1 816)与对照组(3 950±875)相比差异无统计学意义(P>0.05)。见图4。

图4 SDF-1α对大鼠骨髓间充质干细胞迁移能力的影响Fig.4 Effect of SDF-1αon rat bone marrow stem cells migration
3 讨论
器官移植是治疗心脏、肝脏和肾脏等重要脏器终末期疾病的重要治疗方法[6]。随着治疗手段及药物开发的进步,目前超急性与急性器官排斥反应已得到有效控制,但移植后器官慢性排斥反应仍是造成移植器官失活进而导致移植失败的主要原因[2,7]。慢性排斥反应的共同病理特征是移植器官动脉硬化即动脉内膜进行性增厚,最后导致管腔闭塞、器官血供缺失而失活[3]。然而目前移植后动脉硬化的确切机制尚不明确。
研究表明,移植动脉硬化的增生内膜主要是由增殖积聚的平滑肌细胞、细胞外基质及浸润的少量炎性细胞组成[8]。有研究认为增生内膜增殖积聚的平滑肌细胞来源于移植供体动脉的中膜平滑肌细胞[9-10],而我们前期研究发现移植动脉增生内膜细胞主要来源于移植受体,主要是移植受体骨髓间充质干细胞向移植动脉迁移和增殖积聚而来[4]。但对于骨髓间充质干细胞向移植动脉部位迁移、增殖后是否向平滑肌细胞分化尚缺乏进一步研究。
既往研究发现,移植后,受体移植动脉明显表达趋化因子SDF-1α,血SDF-1α水平也明显增加,体外实验发现SDF-1α是趋化骨髓间充质干细胞迁移和增殖的主要细胞因子。SDF-1α通过活化骨髓间充质干细胞PI3K/Akt/mTOR、MAPK/ERK 信号通路诱导其迁移能力和增殖能力增强,进而促进移植动脉内膜增生[4]。骨髓间充质干细胞存在于骨髓中,具有多向分化潜能,在趋化因子诱导下可从骨髓动员,并分化成多种细胞参与组织损伤修复等[11-12]。本研究显示在外源性SDF-1α刺激下,骨髓间充质干细胞明显表达平滑肌细胞标志α-SMA、SM-22α和Calponin。与此同时作为间质细胞特征之一的迁移能力也明显提高,表明骨髓间充质干细胞在SDF-1α刺激下向平滑肌细胞发生定向分化,进一步提示骨髓间充质干细胞在经趋化因子,如SDF-1α诱导后,可成为平滑肌细胞的重要来源之一。
我们的研究提示,在移植后,移植受体通过产生趋化细胞因子,如SDF-1α等,诱导移植受体细胞,如骨髓间充质干细胞,向移植动脉内膜迁移并增殖和向平滑肌细胞分化,进而积聚逐渐形成新生内膜,造成移植动脉硬化。本研究也进一步证实骨髓间充质干细胞可能是移植动脉增生内膜平滑肌细胞的主要来源之一。因此,我们的研究可能为移植后慢性排斥反应的发生提供新的病理学发病机制。通过抑制移植后受体骨髓间充质干细胞的动员及迁移、分化,减轻移植器官动脉硬化,从而开辟新的抗慢性排斥反应治疗方法,为提高移植器官存活率,改善患者预后提供新的突破口。
[1] Libby P,Pober J S.Chronic rejection[J].Immunity,2001,14(4):387-397.
[2] Sayegh M H,Carpenter C B.Transplantation 50years laterprogress,challenges,and promises[J].N Engl J Med,2004,351(26):2761-2766.
[3] Hillebrands J L,Rozing J.Chronic transplant dysfunction and transplant arteriosclerosis:new insights into underlying mechanisms[J].Expert Rev Mol Med,2003,5(2):1-23.
[4] Li J,Liu S,Li W,et al.Vascular smooth muscle cell apoptosis promotes transplant arteriosclerosis through inducing the production of SDF-1alpha[J].Am J Transplant,2012,12(8):2029-2043.
[5] Xu M,Wani M,Dai Y S,et al.Differentiation of bone marrow stromal cells into the cardiac phenotype requires intercellular communication with myocytes[J].Circulation,2004,110(17):2658-2665.
[6] Lechler R I,Sykes M,Thomson A W,et al.Organ transplantation—how much of the promise has been realized?[J].Nat Med,2005,11(6):605-613.
[7] Tantravahi J,Womer K L,Kaplan B.Why hasn’t eliminating acute rejection improved graft survival?[J].Annu Rev Med,2007,58(5):369-385.
[8] Rahmani M,Cruz R P,Granville D J,et al.Allograft vasculopathy versus atherosclerosis[J].Circ Res,2006,99(8):801-815.
[9] Hillebrands J L,Klatter F A,van den Hurk B M,et al.Origin of neointimal endotheliumand alpha-actin positive smooth muscle cells in transplant arteriosclerosis[J].J Clin Invest,2001,107(11):1411-1422.
[10] Religa P,Bojakowski K,Maksymowicz M,et al.Smooth-muscle progenitor cells of bone marrow origin contribute to the development of neointimal thickenings in rat aortic allografts and injure rat carotid arteries[J].Transplantation,2002,74(9):1310-1315.
[11] Wang C H,Cherng W J,Yang N I,et al.Late-outgrowth endothelial cells attenuate intimal hyperplasia contributed by mesenchymal stem cells after vascular injury[J].Arterioscler Thromb Vasc Biol,2008,28(1):54-60.
[12] 张利铭,李秋柏,李新建,等.不同代次骨髓间充质干细胞成骨分化潜能的体外研究[J].华中科技大学学报:医学版,2012,41(2):132-136.
