乙醛脱氢酶1在胃癌组织中的表达及与幽门螺杆菌L型感染的关系*
2014-01-01于东红
赵 艳, 金 鑫, 于东红, 钱 军△
1蚌埠医学院第一附属医院临床病理科,蚌埠医学院病理学教研室,安徽省感染与免疫重点实验室,蚌埠 233004
2蚌埠医学院第一附属医院肿瘤外三科,蚌埠 233004
胃癌作为最常见的消化道恶性肿瘤,其死亡率在我国高居各种恶性肿瘤之首,主要原因是肿瘤的复发、转移问题尚未解决。肿瘤干细胞(cancer stem cells,CSC)的研究作为近年来肿瘤研究领域的热点,为肿瘤发病机制的阐明及靶向治疗提供了有益借鉴。乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)作为新近发现的一个肿瘤干细胞标志物,已被证实为头颈部鳞癌、肺癌、乳腺癌等[1-3]多种肿瘤的干细胞标志物,并且与肿瘤的预后密切相关,但在胃癌中的研究尚未见报道。
在对肿瘤干细胞研究的同时,干细胞生存的微环境即干细胞niche的存在也逐渐引起人们的重视。微环境不仅包括了肿瘤细胞本身,还有其周围的成纤维细胞、免疫和炎性细胞及附近区域内的细胞间质、微血管以及浸润在其中的生物因子。研究表明异常的干细胞niche是导致干细胞发生突变形成肿瘤干细胞的重要原因[4]。幽门螺杆菌(Helicobacter pylori,Hp)感染作为一种特殊的微生物参与了微环境的构成,它在胃癌发生中的作用已得到公认,Hp在不利于生长的环境下尤其是肿瘤组织内易转变为L型。Hp-L型与肿瘤干细胞的关系及其作为微环境构成部分对肿瘤干细胞的影响值得探索。本文通过免疫组化及原位杂交法检测我院胃癌患者肿瘤及正常组织中ALDH1的表达,分析其与胃癌临床病理特征及预后关系,进行ALDH1表达与Hp-L型感染的相关性研究。
1 资料与方法
1.1 标本收集
收集我院临床病理科2007年1月至2008年6月间存档的石蜡包埋胃癌组织126例和切缘组织30例(对照组)。所有患者术前未行放、化疗。蜡块重新切片后由2位病理医师独立复查确诊为胃癌。其中男性92例,女性34例。年龄36~83岁,中位年龄58岁。根据P-TNM分期(国际UICC1997分期标准):Ⅰ期18例,Ⅱ期21例,Ⅲ期47例,Ⅳ期40例。高分化癌13例,中分化癌69例,低分化癌44例。术后随访自入院确诊日期开始至2013年6月,随访形式为门诊复查及电话随访相结合,死亡为随访终点,随访截至2013年6月,随访率81.7%,随访时间2~78个月,中位随访期52个月。
1.2 抗体与试剂
兔抗人ALDH1多克隆抗体购自Abcame公司,ALDH1原位杂交试剂盒购自武汉博士德生物技术有限公司,Hp-L型抗体、二抗及DAB显色剂购自北京中杉金桥生物技术有限公司。
1.3 ALDH1蛋白表达的检测
所有标本均经4%多聚甲醛固定,常规石蜡包埋,4μm切片后进行免疫组化Elivision法染色。经微波抗原修复后按试剂盒说明书操作。ALDH1多克隆抗体浓度为1∶100。以已知阳性切片为阳性对照,以PBS代替一抗为阴性对照。ALDH1蛋白位于细胞质,以癌细胞胞质出现淡黄色至棕褐色颗粒为阳性表达。高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个),按阳性细胞所占百分比及着色深浅进行结果判定。着色深浅等级为:0=无着色(不表达),1=淡黄色(弱表达),2=棕黄色(中等表达),3=棕褐色(强表达)。将阳性细胞所占百分比分为:0%,~10%,~25%,~50%,~75%,>75%。≤10%的细胞ALDH1弱表达视为阴性,>10%的细胞ALDH1弱或更强表达视为阳性[2]。
1.4 ALDH1mRNA的检测
标本经4%多聚甲醛固定,常规石蜡包埋,4μm切片后进行原位杂交检测。原位杂交探针为地高辛标记的ALDH1寡核苷酸,杂交信号检测由DAB显色,具体操作步骤按试剂盒说明书进行。以细胞质出现淡黄色至棕褐色颗粒为阳性表达。染色强度判断标准参照免疫组化判定标准。
1.5 Hp-L 型感染的检测
标本经4%甲醛固定,常规石蜡包埋,4μm切片后进行革兰染色及免疫组化Elivision法染色,按常规操作步骤进行,Hp-L型抗体工作浓度为1∶90。革兰染色结果判定:组织切片经革兰染色后于油镜(10×100)下观察并计数,每例随机观察10~15个视野,取平均数,Hp-L型平均数≥20为阳性,<20或未查见Hp-L型为阴性。免疫组化检测结果判定:胃癌细胞、正常胃黏膜上皮细胞及间质巨噬细胞的胞质或胞膜着棕黄色细颗粒为Hp-L型阳性。革兰染色Hp-L型检出和免疫组化Hp-L型抗原表达同时阳性者定为Hp-L型感染阳性。
1.6 统计学方法
采用SPSS 13.0软件进行统计处理,组间比较采用χ2检验或Fisher精确检验,生存分析采用Kaplan-Meier法,以Log-rank检验比较生存差异,以P<0.05为差异有统计学意义。
2 结果
2.1 ALDH1蛋白和mRNA的表达
免疫组化Elivision法染色显示,ALDH1位于细胞质中,呈棕黄色颗粒(图1)。胃癌组中ALDH1蛋白表达阳性率高于对照组,组间差异具有统计学意义(P<0.01)。原位杂交检测ALDH1mRNA在胃癌组织内的表达见图2。胃癌组中ALDH1mRNA水平与蛋白的表达水平基本一致(表1),随着胃癌细胞胞质内ALDH1mRNA转录水平的增高,胃癌组织中ALDH1蛋白表达水平也增加。ALDH1的表达与临床分期及有无淋巴结转移相关(表2),与患者性别、年龄、肿瘤直径、分化程度、浸润范围无明显相关性(P>0.05)。
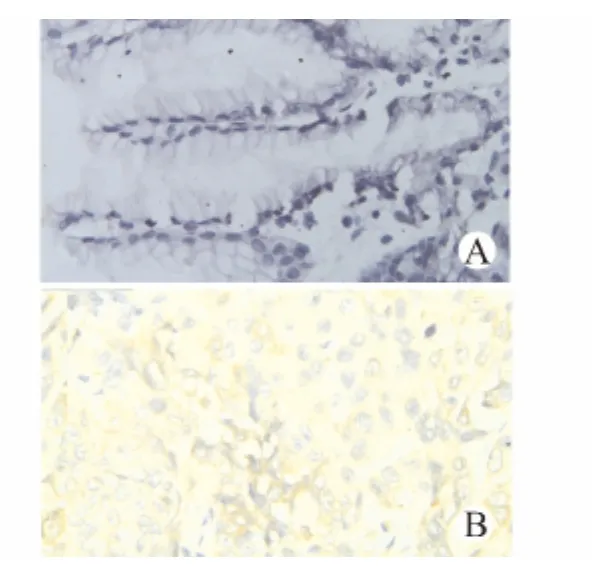
图1 ALDH1在正常组织(A)及胃癌组织(B)内的表达(Elivision法,×400)Fig.1 Expression of ALDH1in normal and gastric cancer tissues(Elivision,×400)

图2 原位杂交检测ALDH1mRNA在胃癌组织内的阳性表达(DAB显色,×100)Fig.2 ALDH1mRNA positive expression in gastric cancer tissues(DAB,×100)
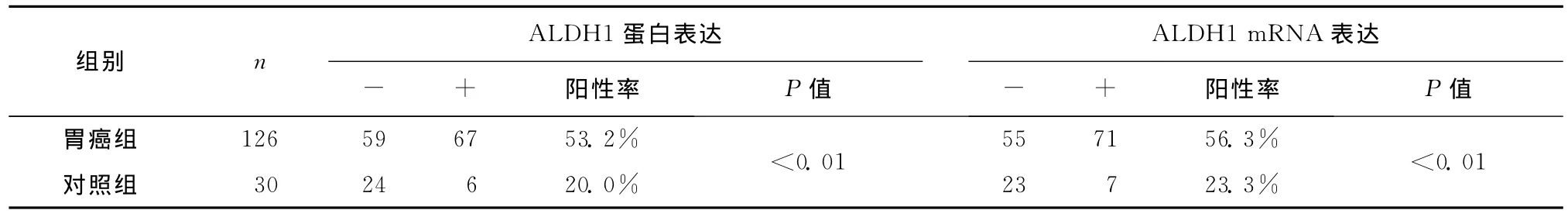
表1 不同胃组织中ALDH1蛋白及mRNA的表达Table 1 ALDH1protein and mRNA expression in different gastric tissues

表2 胃癌组织中Hp-L型感染和ALDH1蛋白表达与临床病理特征的关系Table 2 Correlation of Hp-Linfection and ALDH1protein expression with clinicopathological characteristics of gastric carcinoma
2.2 Hp-L 型的检测结果
革兰染色检测胃癌组中Hp-L 型阳性率为69.0%(87/126),Hp-L 型主要分布于胃癌癌巢和癌旁,粘附于癌细胞及胃黏膜上皮细胞表面。大小不等,形态多样,有巨形体、圆球体、短杆状等,但多数为圆球体(图3)。对照组的Hp-L 型检出率为26.7%(8/30)。免疫组化检测显示 Hp-L 型阳性定位于胞质或胞膜,呈棕黄色颗粒(图4),胃癌组中Hp-L 型抗原表达阳性率为72.2%(91/126),对照组为33.3%(10/30)。Hp-L 型感染与胃癌浸润深度及淋巴结转移相关,而与其它临床指标无相关性(表2)。革兰染色和免疫组化检测同时阳性的病例在胃癌组中有85例(67.5%),对照组有7例(23.3%),胃癌组与对照组相比差异具有统计学意义(P<0.01)。
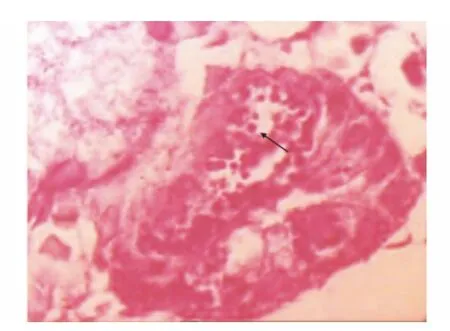
图3 胃癌细胞胞质内的Hp-L型圆球体(箭头)(革兰染色,×1 000)Fig.3 Hp-L in gastric cancer cells (indicated by the arrow)(Gram stain,×1 000)

图4 Hp-L型在胃癌组织内的表达(Elivision法,×100)Fig.4 Hp-Lexpression in gastric cancer(Elivision,×100)
2.3 ALDH1蛋白表达与Hp-L型感染的关系
胃癌组Hp-L型感染阳性者的ALDH1蛋白表达阳性率为60.0%,高于 Hp-L 型感染阴性组(39.0%),两者差异有统计学意义 (P<0.05)。Spearman等级相关分析表明,胃癌组ALDH1蛋白表达与 Hp-L 型感染呈正相关 (rs=0.220,P=0.013,表3)。

表3 胃癌组织中ALDH1蛋白表达与Hp-L型感染的关系Table 3 The relationship between ALDH1protein expression and Hp-Linfection in gastric cancer
2.4 ALDH1表达与预后关系
103例患者接受了随访。ALDH1蛋白阳性患者的平均无病生存期为(39.02±4.37)个月,5年总生存率为33.3%,ALDH1蛋白阴性患者的平均无病生存期为(56.78±4.13)个月,5年总生存率为55.3%,ALDH1蛋白阳性患者的生存率明显低于阴性患者,差异有统计学意义(P<0.05)(图5)。

图5 ALDH1蛋白表达阳性/阴性患者术后生存曲线Fig.5 Survival curves of patients with positive and negative ALDH1expression
3 讨论
胃癌是我国最常见的消化道恶性肿瘤,尽管目前临床上采取了包括手术切除、化学治疗、放射治疗、基因治疗在内的综合治疗策略,但胃癌患者的总体生存率不超过40%。死亡率高的主要原因是治疗抵抗、局部复发和远处转移。肿瘤干细胞(cancer stem cells,CSC)是一类具有无限增生潜能,在肿瘤的发生、发展中起决定性作用并与肿瘤的转移和复发密切相关的细胞。传统治疗方法杀灭肿瘤细胞时却很少杀灭肿瘤干细胞,其经过增殖分化又会形成新的肿瘤,从而导致肿瘤复发。目前人们已经在急性髓细胞白血病、脑肿瘤、乳腺癌、胰腺癌等[5-6]多种恶性肿瘤中发现肿瘤干细胞。在胃癌的研究中Takaishi[7]、Haraguchi等[8]也都用实验验证了胃癌肿瘤干细胞的客观存在。
对于肿瘤干细胞的研究目前多集中在特异性标志物的筛选和鉴定上。研究较多的干细胞表面标记物包括 CD44、Musashi-1、ABCG2、CD133等,但各种标记物的特异度、敏感度如何,目前仍未有统一的观点。乙醛脱氢酶1(aldehyde dehydrog enase 1,ALDH1)是新近发现的一种肿瘤干细胞标志物,它是乙醛脱氢酶家族中的一员,存在于细胞质中,其基因克隆和定位在9q21染色体,由53×103个碱基对构成,包含13个外显子,共编码501个氨基酸序列,是组织中正常干细胞与肿瘤干细胞生长、分化的必需物质,在多种组织(特别是肿瘤组织)中起重要作用。研究表明造血系统、神经系统的干、祖细胞中ALDH1含量很高[9],可以作为正常干细胞与肿瘤干细胞的标记物之一。因此在肿瘤组织中利用ALDH1的表达来分选肿瘤干细胞的方法正逐渐被人们采用,其在多种肿瘤中的研究已有报道。
本研究主要验证ALDH1在胃癌组织中作为干细胞标志物的价值,研究发现ALDH1在胃癌组织中有不同程度的表达,阳性率与对照组差异有统计学意义,ALDH1的表达与临床分期及有无淋巴结转移相关。说明临床分期越晚以及淋巴结发生转移的患者,ALDH1越倾向高表达。同时ALDH1表达越高的患者,其预后越差,5年生存率ALDH1阳性表达组明显低于阴性表达组。
干细胞的微环境理论提示:干细胞niche为干细胞的生存提供了一个庇护所,使其免受分化、凋亡及其他刺激的影响。微环境的改变能够诱导一系列细胞学、生理学及分子生物学的变化,进而改变细胞的正常增殖、凋亡及损伤修复进程。Li等[10]认为,干细胞微环境的反常调控导致了干细胞增殖失控,进而导致肿瘤的发生,就像打开了“潘多拉盒子”一样。胃癌作为炎症促进癌变的典型模型,胃炎-胃溃疡-胃癌的模式已被公认。胃内的菌群结构,尤其是Hp感染自然是胃癌肿瘤干细胞微环境的重要构成部分。Hp与上皮的相互作用可导致天然免疫反应(树突细胞、巨噬细胞、单核细胞)的激活,包括多种趋化因子和细胞因子的释放,可对上皮细胞和微环境产生直接影响。这些免疫抑制因子的释放导致免疫监视功能丧失,利于肿瘤生长,侵袭及转移,加速肿瘤演进和免疫逃逸过程[11]。Hp在不利于其生长的条件下会转变为L型,由于Hp-L型的细胞壁缺陷、表面电荷改变、抗原性降低等因素,其与宿主细胞的粘附性增强,从而具有逃避机体防御清除和药物攻击的能力。因此,Hp-L型比Hp具有更强的潜伏性和难清除性。本实验我们发现:胃癌组Hp-L型感染阳性者的ALDH1蛋白表达阳性率高于Hp-L型感染阴性组,胃癌组ALDH1蛋白表达与Hp-L型感染呈正相关。说明Hp-L型感染有可能影响到肿瘤微环境,从而对胃正常干细胞的分化发展构成影响。
本实验中ALDH1蛋白及mRNA的表达率相对较高,可能跟抗体自身的敏感性及与我们参考国外文献制定的阳性率判定标准有关。但由此可以看出,在蛋白水平上通过标志物检测肿瘤干细胞,其数量要比实际干细胞群体大。要深入研究肿瘤干细胞,除了干细胞标志物的筛选外,还有许多问题有待进一步研究。
[1] Chen Y C,Chen Y W,Hsu H S,et al.Aldehyde dehydrogenase 1is a putative marker for cancer stem cells in head and neck squamous cancer[J].Biochem Biophys Res Commun,2009,385(3):307-313.
[2] Jiang F,Qiu Q,Khanna A,et al.Aldehyde dehydrogenase 1is a tumor stem cell-associated marker in lung cancer[J].Mol Cancer Res,2009,7(3):330-338.
[3] Ginestier C,Hur M H,Charafe-Jauffret E,et al.ALDH1is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J].Cell Stem Cell,2007,1(5):555-567.
[4] Dong L M,Potter J D,White E,et al.Genetic susceptibility to cancer:the role of polymorphisms in candidate genes[J].JAMA,2008,299(20):2423-2436.
[5] Lapidot T,Sirard C,Vormoor J,et al.A cell initiating human acute myeloid leukaemia after transplantation into SCID mice[J].Nature,1994,367(6464):645-648.
[6] Ignatova T N,Kukekov V G,Laywell E D,et al.Human corticalglialtumors contain neural stem like cells express in gastroglial and neuronal markers in vitro[J].Glia,2002,39(3):193-206.
[7] Takaishi S,Okumura T,Tu S,et al.Identification of gastric cancer stem cells using the cell surf ace marker CD44[J].Stem Cells,2009,27(5):1006-1020.
[8] Haraguchi N,Utsunomiya T,Inoue H,et a1.Characterization of a side population of cancer cells from human gastrointestina1system[J].Stem Cells,2006,24(3):506-513.
[9] Levi B P,Yilmaz O H,Duester G,et al.Aldehyde dehydrogenase 1a1is dispensable for stem cell function in the mouse hematopoietic and nervous systems[J].Blood,2009,113(8):1670-1680.
[10] Li L,Neaves W B.Normal stem cells and cancer stem cells:the niche matters[J].Cancer Res,2006,66(12):4553-4557.
[11] Allavena P,Sica A,Solinas G,et a1.The inflammatory microenvironment in tumor progression:The role of tumor-associated macrophages[J].Crit Rev Oncol Hematol,2008,66(1):1-9.
