鹌鹑PGCs的传代培养及鉴定
2013-12-24李玉芳洪志勇李明张兴峰林秀娇李鸿翔庄益芬张文昌
李玉芳洪志勇李 明张兴峰林秀娇李鸿翔庄益芬张文昌*
(1.福建农林大学动物科学学院 福州 350002;2.黄淮学院 河南驻马店 463000)
原始生殖细胞(PGCs)是具有高度未分化的发育全能性细胞。自Waldeyer(1870)首先在鸡胚的生殖腺中发现PGCs以来,人们对鸡PGCs的体外培养和扩增进行了大量的研究。Chang等(1995)[1]将从2日龄鸡胚血液中分离出的PGCs放在从5日龄鸡胚中获取的生殖原基细胞上培养5 d,发现PGCs增殖了近5倍,后来成功得到了嵌合体鸡。Park[2]从5.5 d的鸡胚生殖腺中分离PGCs并将其在体外培养4个月,然后分别用传至3代和4代的PGCs制作嵌合体鸡获得了成功。Han等[3]将分离到的28期鸡胚胎生殖腺的PGCs在不传代的情况下离体培养了2个月。Petitte等[4]将不同类型的饲养层和培养液对鸡胚胎干细胞的培养效果进行了比较。在国内,李碧春、安静、谢蓓、秦洁等[5-8]分别成功对X期胚盘细胞及PGCs细胞进行离体培养与传代。本试验采用孵化6 d的鸡胚胎制作成纤维细胞饲养层培养鹌鹑原始生殖细胞,并比较添加生长因子与不添加生长因子的效果,以及PGCs在培养过程中的生长情况。
1 材料与方法
1.1 试验器材 CO2培养箱(日本三洋)、超净工作台(苏州净化集团制造)、孵化箱(北京海江孵化设备制造有限公司)、体视显微镜(Nikon SMZ-10)、玻璃毛细管、拉针仪、血细胞计数板、0.22 um微孔滤膜,六孔培养板、小牛血清(FBS)(Gibico)、BCIP/NBT 染色试剂盒(Amresco)、细胞计数分析仪(EG)。
1.2 试验试剂 0.25%胰蛋白酶(Gibio)溶液、EDTA溶液、0.25%胰蛋白酶-EDTA;无 Ca2+、Mg2+的 PBS 溶液;Hank’s液、DMEM-F12 培养基(清大有为)、ES 细胞基础培养液、0.1%明胶、丝裂霉素-C、bFGF、SCF、mLIF、福尔马林-乙醇定影液。
1.3 鹌鹑PGCs的培养 (1)挑选生长良好的细胞,置于无饲养层、无LIF生长因子的培养液中培养,观察细胞培养结果;(2)挑选生长良好的细胞,在有鸡成纤维饲养层的情况下观察细胞生长结果;(3)挑选生长良好的细胞,在添加LIF、SCF、bFGF(每孔分别添加10 uL配好的LIF、SCF、bFGF溶液)的鸡成纤维饲养层上观察培养情况。
1.4 鹌鹑PGCs的传代 (1)观察鹌鹑原始生殖细胞的生长情况,选择细胞克隆生长良好,隆起明显,形态未表现分化或刚刚表现分化迹象的细胞克隆进行初次传代;(2)用口吸管和钨丝针把选择好的克隆挑出,剥离周围的饲养层细胞,置于PBS中洗1次;(3)移入0.25%胰蛋白酶-0.02%EDTA液中,37℃消化2~3 min;(4)用口吸管将细胞克隆从消化液中吸出,置于DMEM中洗2次;(5)移入细胞培养液中,用口吸管轻轻吹打并借助钨丝针的作用将细胞团分散为细胞悬液,置于新制备的饲养层中培养。
1.5 鹌鹑PGCs的鉴定
1.5.1 形态学鉴定 借助倒置显微镜及解剖显微镜,观察细胞集落的生长情况、外部特征。
1.5.2 碱性磷酸酶(AKP)染色反应 (1)取无菌盖玻片放置在无菌培养皿中,加入0.1%明胶2 mL,使盖玻片表面也均匀地涂有明胶;(2)取生长情况良好的原始生殖细胞克隆放在包被有明胶的盖玻片上,置于 37 ℃、5%CO2、饱和湿度培养箱中培养 24 h;(3)取已有原始生殖细胞的盖玻片用福尔马林-乙醇定影液固定15 min;(4)去掉固定液,用蒸馏水冲洗2次,加入 BCIP/NBT 染色液,37 ℃下染色 1.5~2 h;(5)用蒸馏水轻轻冲洗掉染色液,晾干后在倒置显微镜下观察。
2 结果与分析
从表1可看出,在添加生长因子的鸡成纤维细胞饲养层上培养原始生殖细胞,存活率明显比其他2种高;在鸡成纤维细胞饲养层上培养的鹌鹑PGCs存活率比在基础培养液中的存活率高。
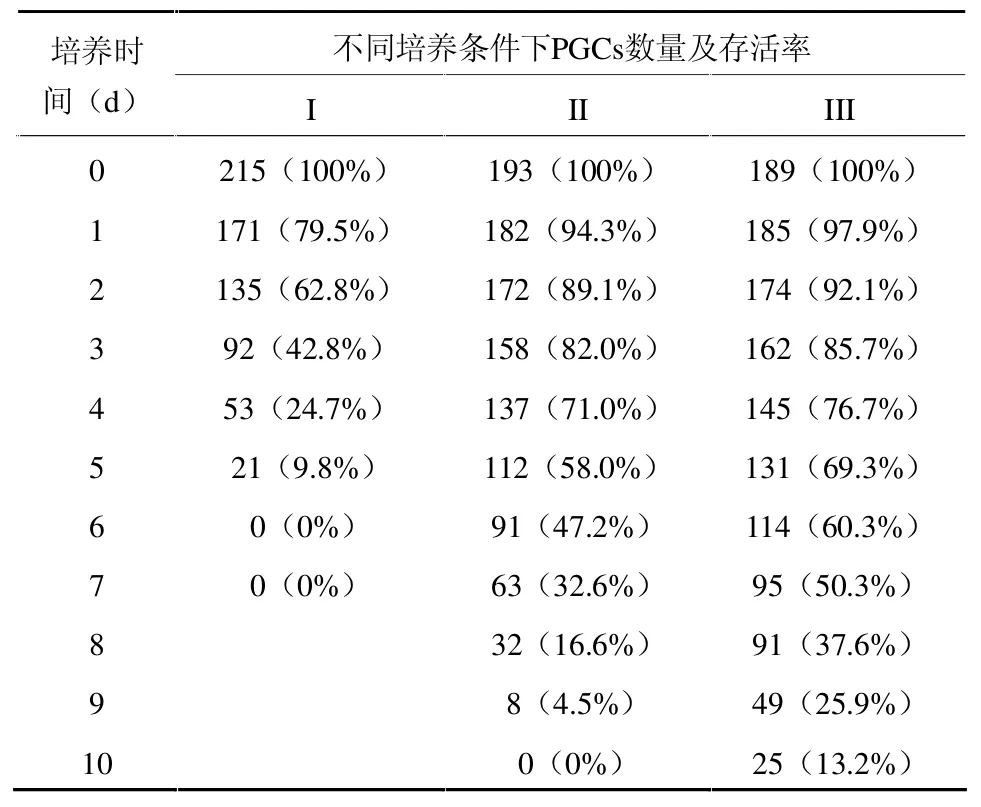
表1 鹌鹑PGCs在不同培养条件下数量及存活率变化情况
在不含饲养层和生长因子条件下培养,基质细胞成纤维状贴壁生长,原始生殖细胞的培养存活时间很短。培养2 d后以2~3个细胞的形式松散地聚在一起,并且很快出现分裂,形成的细胞团与周围存在明显界限,细胞彼此界限不清,细胞表面有折光较强的脂状小滴(见图1)。第3 d其成活率为42.8%,培养4~5 d细胞大部分形成细胞团(见图2),培养5~6 d,基质细胞开始脱落死亡,原始生殖细胞也大部分死亡(见图3)。

图1 培养2 d分化中的鹌鹑PGCs(AKP染色)
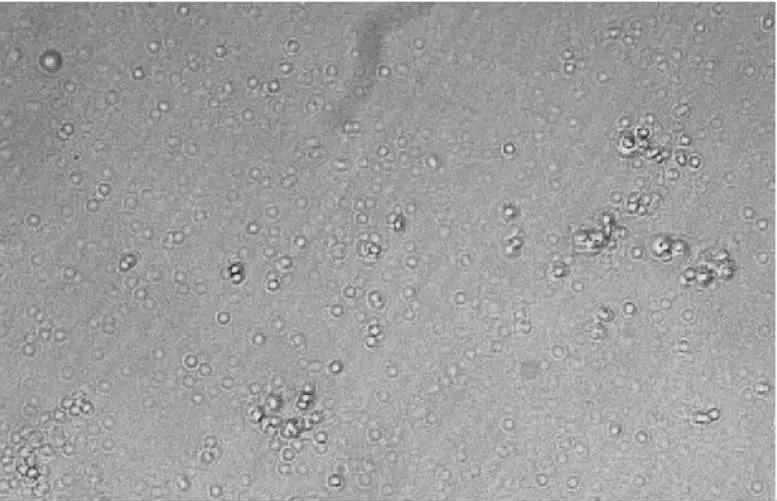
图2 形成4~5个细胞克隆的鹌鹑PGCs
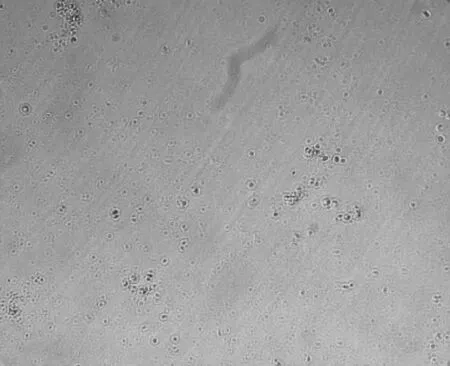
图3 原始生殖细胞在无饲养层及生长因子培养液中培养4~5 d
而当原始生殖细胞置放在鸡胚成纤维细胞饲养层上时,细胞的分化得到了有效抑制,第2 d原始生殖细胞仍保持单个的未分化状态(见图4),此时部分培养的原始生殖细胞体积变大,细胞内出现空泡(见图5)。培养4~5 d后分化的程度比无饲养层的PGCs情况好,PGCs存活率为50%左右(见图6)。

图4 PGCs在鸡成纤维细胞饲养层上的培养(2 d)
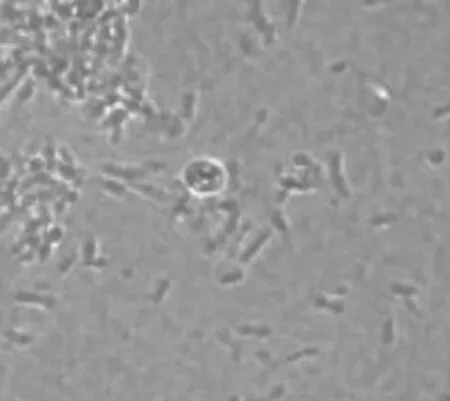
图5 出现空泡的鹌鹑PGCs
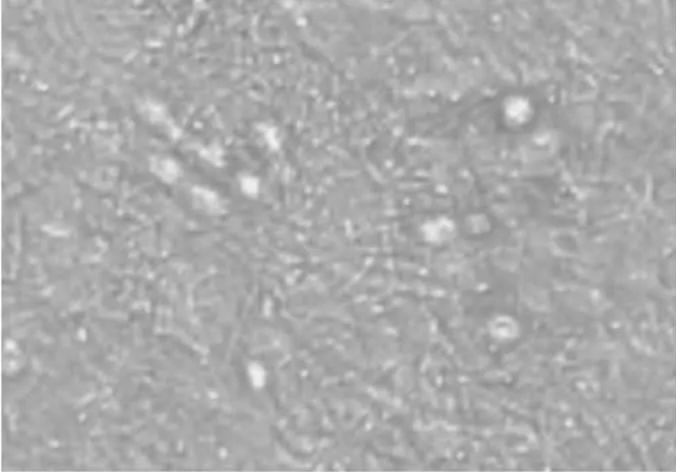
图6 在鸡成纤维细胞饲养层上培养4~5 d的鹌鹑PGCs
在添加生长因子的成纤维细胞饲养层中培养,前3 d细胞基本不出现分化,保持单个的未分化状态(见图7),第4~5 d部分细胞开始出现分裂(见图8)细胞存活 76%左右;培养至第 6~7 d,出现 7~8 个细胞的细胞克隆;培养至第10 d时,细胞克隆为13~15个细胞左右,可见多个细胞的聚集,形态多样,但多数呈岛状或巢状(见图9)。此时细胞形态不明显,细胞间的接合不紧密,成纤维细胞大量死亡。换液传代后鹌鹑PGCs仍然具有分裂增殖的能力(见图10),经AKP染色后,仍着色较深,与刚分离的PGCs形态相似。试验中PGCs传代5次,细胞仍具有原始生殖细胞的形态,并保持其未分化状态。
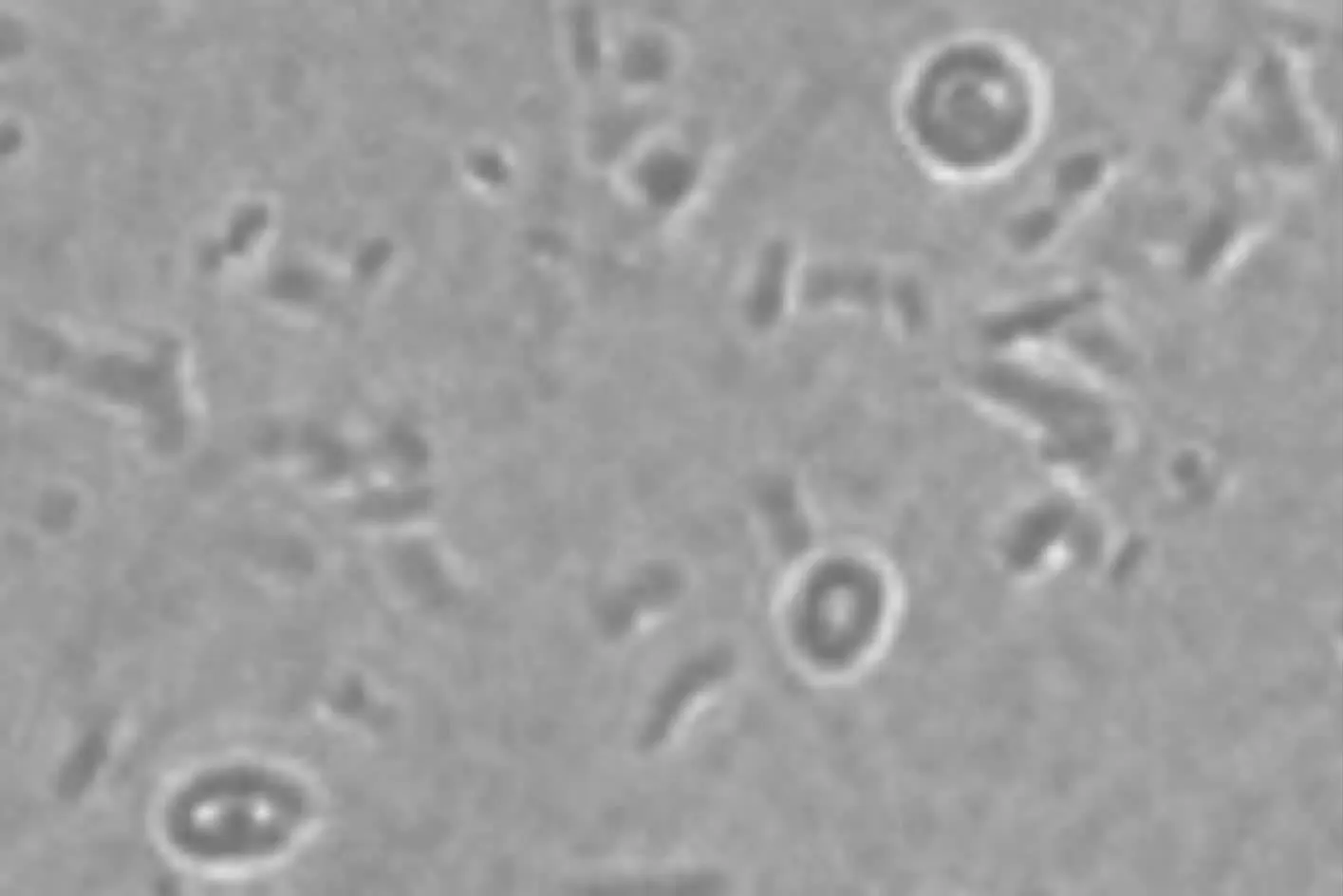
图7 保持未分化状态的鹌鹑PGCs

图8 在含有生长因子的鸡成纤维细胞饲养层上培养4~5 d的鹌鹑PGCs
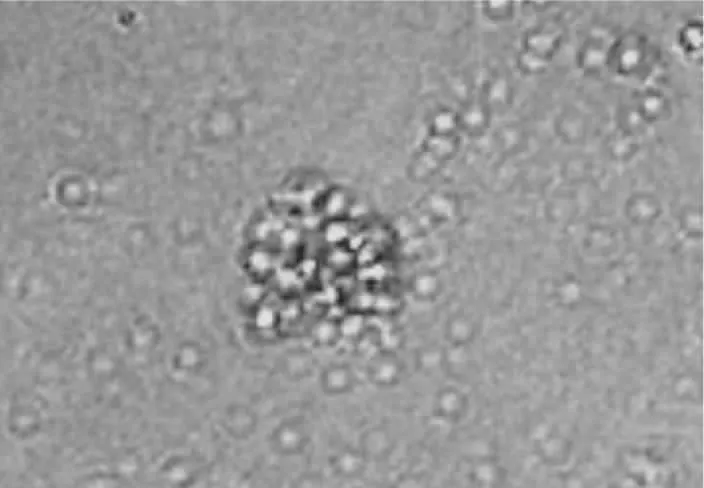
图9 鹌鹑PGCs培养10 d出现的细胞克隆(AKP染色)

图10 换液后正在分裂的PGCs(AKP染色)
3 讨论
Swartz(1982)[9]发现在胚胎发育的 13~29 期,鸡PGCs呈现碱性磷酸酶活性,里面含有大量的脂滴和糖原,在AKP反应中呈阳性,经AKP染色后呈紫红色。本试验在细胞的分离阶段及培养阶段对所获得的细胞通过形态学及AKP染色进行鉴定,这些细胞与鸡PGCs碱性磷酸酶染色形态相似,证明形态学及AKP染色法在鹌鹑PGCs的鉴定中一样有效。
原始生殖细胞分离后,以游离的方式存在于培养液中,如果有其他基质细胞,则依附于其他细胞而暂时固定下来,但很容易分离。本试验原始生殖细胞传代过程即是利用了原始生殖细胞的游离性而分离的。
PGCs培养过程中的关键技术是维持PGCs的未分化状态。胚胎及机体发育过程中分化和分裂增殖一般同时进行,而PGCs的建系要求PGCs既能快速无限增殖又能呈未分化状态,因而抑制分化和扩增是一对矛盾。禽类PGCs常用鸡胚成纤维细胞制作饲养层。鸡胚成纤维细胞(CEF)能分泌LIF样物质,用于制作培养基。邹清雁等[10]用鸡成纤维细胞饲养层分离培养鸡的X期培盘细胞获得了成功,并将类ES细胞传至9代,AKP染色为阳性。安静等(2003)[6]对鸡的X期胚盘细胞在鸡成纤维细胞饲养层上成功传代,并对传至4代的细胞克隆经形态学、AKP染色等方法检测后表明其具有ES细胞的诸多特性。本试验采用3种不同方法,在相同培养时期(4~5 d)对鹌鹑PGCs的细胞形态进行比较;同时对鹌鹑PGCs培养及传代过程中的存活率、分裂、细胞分化方面进行了比较,发现鸡胚成纤维细胞可在3种生长因子的作用下对胚胎干细胞提供营养支持8~9 d,论证了生长因子 LIF、bFGF、SCF 对 PGCs的抑制分化和促进分裂增殖的作用,与前人的试验结果相似。本试验尝试在第7 d对鹌鹑PGCs传代,传至5代,AKP染色后发现仍有PGCs存活,部分细胞具有分裂增殖的能力。鹌鹑PGCs的成功传代对于转基因动物的制作及濒危鸟类的物种保护具有重要的意义。
[1] Chang I,Jeong D K,Hong Y H,et a1.Production of germline chimeric chicken by transfer of cultured chick primordial germ cells[J].Cel Biol Int,1997,21:495-499.
[2] Park T S,Han J Y.Derivation and characterization of pluripotent embryonic germ cells in chicken[J].Mol Reprod and Deve,2000,56:475-482.
[3] Han J Y,Park T S,Hong Y H,et a1.Production of germline chimeras by transfer of chicken gonadal primordial germ cells maintained in vitro foran extended period[J].Theriogenology,2002,58:1521-1530.
[4] Petitte J N,Liu G,Yang Z.Avian pluripotent stem cells[J].Mech Dev,2004,121:1159-1168.
[5] 李碧春,秦洁.鸡胚不同发育时期原始生殖细胞的分离方法[J].动物学报,2003,49(6):835-842.
[6] 安静,杜立新.鸡胚胎干细胞的分离、培养与鉴定[J].动物学报,2003,49(5):698-703.
[7] 谢蓓,黄海,胡小芬,等.鸡胚胎原始生殖细胞体外培养[J].细胞生物学杂志,2005,27:225-229.
[8] 秦洁,李碧春,陈国宏,等.鸡胚胎原始生殖细胞的培养和传代[J].动物学报,2005,51(4):723-731.
[9] Swartz W J.Acid and alkaline phosphatase activity in migrating primordial germ cells from the early embryo[J].Anat Rec,1982,202:375-385.
[10] 邹清雁,张淑莲,郑曲波,等.鸡胚胎干细胞饲养层培养体系的建立[J].上海实验动物科学,2000,20:206-209.
