尼索地平醇质体的制备及体外经皮渗透研究
2013-12-23聂阳何盛江陈伶俐吴泽鹏谢黛汪小根广东食品药品职业学院广东广州5050广东省中药研究所广东广州5050
聂阳,何盛江,陈伶俐,吴泽鹏,谢黛,汪小根 (.广东食品药品职业学院,广东 广州5050;.广东省中药研究所,广东 广州5050)
尼索地平(nisoldipine)为二氢吡啶类钙离子拮抗剂,可选择性地作用于血管平滑肌,显著提高冠脉血流量和供氧,具有抗绞痛、抗心肌缺血和降血压等作用[1-2]。目前,国内已有尼索地平普通片、胶囊、软胶囊、缓释片和缓释胶囊等剂型应用于临床,2008年美国FDA 批准了尼索地平控释片上市,均为口服消化道给药剂型。但尼索地平口服给药,肝首过效应明显,生物利用度低(≤5%),且有口腔溃疡、腹泻、胃肠道出血等消化道不良反应,严重影响了其临床应用和药效发挥[3-4]。
醇质体(ethosomes)是一种可促进药物透过皮肤屏障渗入组织深部的高含醇脂质体,在促进药物经皮渗透方面优于传统脂质体,已成为经皮给药研究的热点[5-6]。如果将尼索地平制备成醇质体,可以提高药物经皮渗透速率和经皮渗透量,维持较高的血药浓度,以期提高其生物利用度,并减少不良反应。本实验采用正交试验优化尼索地平醇质体的处方工艺,通过体外经皮渗透实验,与其混悬液、醇溶液、脂质体对照研究其渗透特性,为透皮制剂的研制提供依据。
1 材料和仪器
1.1 仪器 RYJ-6A 透皮扩散试验仪(上海黄海药检仪器厂,有效扩散面积(S)2.8 cm2,接受池体积(V)6.5 mL);BP-211D 型电子天平(德国赛多利斯公司);Agilent 1100 HPLC(美 国 安 捷 伦 公 司);JEM-1010 透射电子显微镜(日本电子光学公司);Nano-ZS90激光散射粒度仪(英国马尔文公司);FA25均质机(德国弗鲁克公司);SB-100YTD 超声波清洗机(宁波新芝生物科技有限公司);SH23-2恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司)。
1.2 试剂 尼索地平(山东铂源药业有限公司,批号20120612,含量>99.1%);注射级大豆卵磷脂(上海太伟药业有限公司,批号20120201,PC≥92.6%);胆固醇(国药集团化学试剂有限公司,批号20111006);其他试剂均为分析纯。
1.3 实验动物 昆明种小鼠,♂,体质量(20±2)g,南方医科大学实验动物中心,许可证号:SCXK(粤)2011-0015。
2 方法
2.1 制备方法
2.1.1 醇质体 采用乙醇注入匀质法制备。按100 mL醇质体液处方量,精密称取尼索地平、大豆卵磷脂、胆固醇溶于无水乙醇,置磁力搅拌器搅拌至溶解完全,并转移至注射器针筒中。另取处方量蒸馏水于锥形瓶,水浴30℃,磁力搅拌900 r·min-1,在密封条件下,将针筒中的液体缓慢滴加到锥形瓶中,待滴加完后继续搅拌10 min,冷却至室温,匀质(10 000 r·min-1)5 min,用0.22μm 微孔滤膜滤过,于4℃密封保存。
2.1.2 脂质体 按前期优化的处方工艺,精密称取卵磷脂0.3 g、胆固醇0.1 g和尼索地平0.04 g溶于少量乙醚中,并转移至注射器针筒中,缓慢滴加到10 mL 蒸 馏 水 中,水 浴30℃,磁 力 搅 拌900 r·min-1,持续搅拌至乙醚挥尽,冷却至室温,匀质(10 000 r·min-1)5 min,用0.22μm 微孔滤膜滤过,于4℃密封保存。
2.1.3 其他样品配制 精密称取尼索地平0.4 g,溶于100 mL5%的羧甲基纤维素钠溶液中,磁力搅拌器900 r·min-1搅拌30 min,得0.4%尼索地平混悬液;精密称取尼索地平0.4 g,溶于100 mL体积分数45%的乙醇水溶液,磁力搅拌器900 r·min-1搅拌30 min,得0.4%尼索地平乙醇溶液。
2.2 正交设计优化醇质体处方 参考文献并经预试验,确定影响尼索地平醇质体包封率的4大因素:磷脂含量(A)、药物与磷脂质量比(即药脂比,B)、胆固醇与磷脂质量比(C)和无水乙醇含量(D)。各因素选3个水平,以包封率为考察指标,按正交设计表L9(34)进行试验,因素水平见表1。
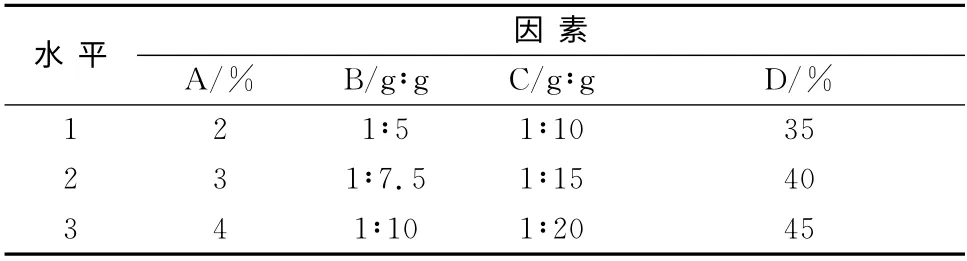
表1 尼索地平醇质体处方正交试验因素水平Tab 1 Factors and levers of orthogonal test of nisoldipine ethosomes prescription
2.3 尼索地平含量测定
2.3.1 色谱条件:Eclipse XDB-C18柱(4.6 mm×250 mm,5μm);流动相:甲醇-水-三乙胺(80∶20∶0.5),以冰醋酸调至pH5.0;流速:1.0mL·min-1;柱温:40℃;检测波长:237 nm;进样量:20μL。尼索地平与其他杂质峰分离良好,磷脂等辅料均无干扰,专属性良好,方法可行,见图1。
2.3.2 标准曲线绘制 精密称取20.12 mg尼索地平置25 mL量瓶中,以甲醇溶解并定容,得储备液。精密移取储备液1 mL 置50 mL 量瓶中,以适量甲醇溶解并稀释至刻度,摇匀。分别精密吸取1,2,4,6,8,10 mL 于10 mL 量瓶中,加流动相稀释至刻度,摇匀。取上述对照品溶液20μL,注入液相色谱仪测定。以峰面积(A)为纵坐标,以药物质量浓度(C)为横坐标进行线性回归,得方程:A=1.893×105C+2.689×102,r=0.999 7,表 明 在1.61~16.10μg·mL-1范围内尼索地平质量浓度与峰面积呈良好的线性关系。
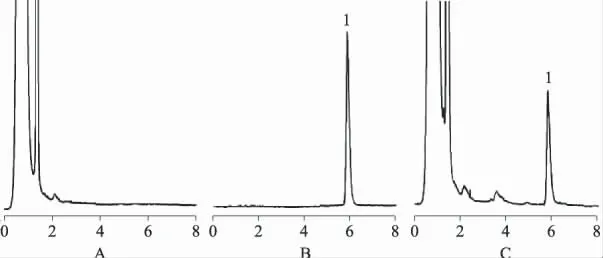
图1 尼索地平液相色谱图A.空白醇质体;B.尼索地平对照品;C.尼索地平醇质体;1.尼索地平Fig 1 HPLC chromatograms of nisoldipineA.blank ethosomes;B.nisoldipine reference substence;C.nisoldipine ethosomes;1.nisoldipine
2.3.3 精密度实验 取“2.3.2”项下同一浓度的对照品溶液,按“2.3.1”项色谱条件测定,重复进样6次,尼索地平峰面积的RSD 为1.36%,表明仪器精密度良好。
2.3.4 稳定性实验 取“2.3.2”项下同一浓度的对照品溶液分别在0,2,4,6,8,12 h进样,尼索地平峰面积的RSD 为0.58%,表明溶液在12 h 内稳定性良好。
2.3.5 回收率实验 取已知空白醇质体适量置50 mL量瓶中,分别精密加入质量浓度为80.48μg·mL-1尼索地平对照品溶液1,5,10 mL,每个质量浓度各配制3 份。按“2.3.1”项色谱条件测定,结果低、中、高质量浓度(1.61,8.05,16.10μg·mL-1)的平均回收率分别为98.05%,100.12%,100.08%;RSD 分别为0.73%,1.06%,0.99%。
2.4 醇质体包封率测定 参照文献[7-8],采用离心法测定。精密吸取5.0 mL 醇质体液置离心管中,以12 000 r·min-1离心45 min,吸取上清液加流动相稀释,经0.22μm 滤膜滤过,续滤液采用高效液相色谱法测定,计算游离药物质量(m游)。另吸取5.0 mL 醇质体液以甲醇为醇质体消解液,使变澄清,吸取上清液加流动相稀释,经0.22μm 滤膜滤过,续滤液进液相色谱仪测定,计算样品中尼索地平总质量(m总)。根据公式计算包封率:包封率%=(m总-m游)/m总×100%。
2.5 样品表观形态和粒径分布 将尼索地平醇质体液稀释适当数倍后,滴于铜网上,以1%磷钨酸负染,透射电镜观察形态并拍照;另取尼索地平醇质体液稀释后,用激光粒度仪测定粒径及分布。
2.6 体外经皮渗透试验
2.6.1 离体鼠皮的制备 小鼠脱颈处死,剃除腹毛,分离完整腹部皮肤,剔除皮下脂肪和血管,用生理盐水漂洗干净,剪成适当的大小,于生理盐水浸泡并冷藏保存备用。
2.6.2 体外透皮实验及皮内滞留量的测定 将小鼠皮肤置Franz扩散池上,接受液为6.5 mL 生理盐水,使液面与皮肤内层紧密接触,恒温水浴(32±0.5)℃,以300 r·min-1磁力搅拌。定量移取各种样品溶液0.5 mL均匀涂布于皮肤角质层上(药物含量均为2 mg),并密封。在规定时间(1,2,3,4,6,8,10,12 h)抽取接受液2 mL,并立即补充同温新鲜接受液2 mL。采用皮肤剪碎法测定皮肤中的药物滞留量[9-10],于12 h 时 取 下 鼠 皮,用 生 理 盐 水 将 皮 肤表面样品冲洗净,剪碎皮肤,用10 mL 乙醇作提取液,超声(200 W)提取30 min,室温冷却。所取的接受液、皮肤样品提取液经过滤和稀释后,经0.22μm滤膜滤过,续滤液采用高效液相色谱法测定,计算单位面积累积渗透药量Qr、稳态透皮速率Js、增渗比IER和12 h皮肤中药物滞留量Qs。
3 结果
3.1 正交试验设计及结果 据正交试验结果极差分析,可知各因素对包封率的影响主次顺序为B>A>D>C(见表2)。方差分析表明,因素A、B 具有显著性,因素C、D 无显著性影响(见表3)。综合得出最佳处方为A2B2C1D3,即100 mL尼索地平醇质体液中大豆磷脂含量3%,药脂比1∶7.5,胆固醇与磷脂质量比1∶10,无水乙醇含量45%。按优选处方连续制备3批醇质体。
3.2 醇质体的表观形态、粒径和包封率 透射电镜观察醇质体形态,可见醇质体呈圆形或类圆形的囊泡,结构完整,见图2。激光散射仪测定粒径,平均粒径为(123.7±41.5)nm,多分散度为0.196,粒径分布均匀(见图3)。4℃密封保存30 d,醇质体外观为浅黄色半透明液体,无分层、浑浊现象。3批醇质体包封率测定结果分别为(68.67±0.85)%,(66.28±1.67)%,(69.07±1.83)%(n=3),平均包封率为(68.01±1.45)%。
3.3 体外经皮渗透性 以尼索地平的混悬液、45%乙醇溶液、脂质体作为对照,研究尼索地平醇质体的经皮渗透性质,结果见图4和表4。45%乙醇与脂质体溶液均可提高药物的稳态透皮速率,且以45%乙醇溶液促渗效果略强,两者的增渗比分别为5.33和4.80。而醇质体可显著提高药物的稳态透皮速率,其增渗比为11.66,促渗效果强于脂质体和乙醇溶液,分别是45%乙醇溶液和脂质体的2.19倍和2.43倍。醇质体和45%乙醇液及脂质体的透皮速率Js和12 h累计渗透药量Qr,经t检验,P<0.05,有显著性差异。
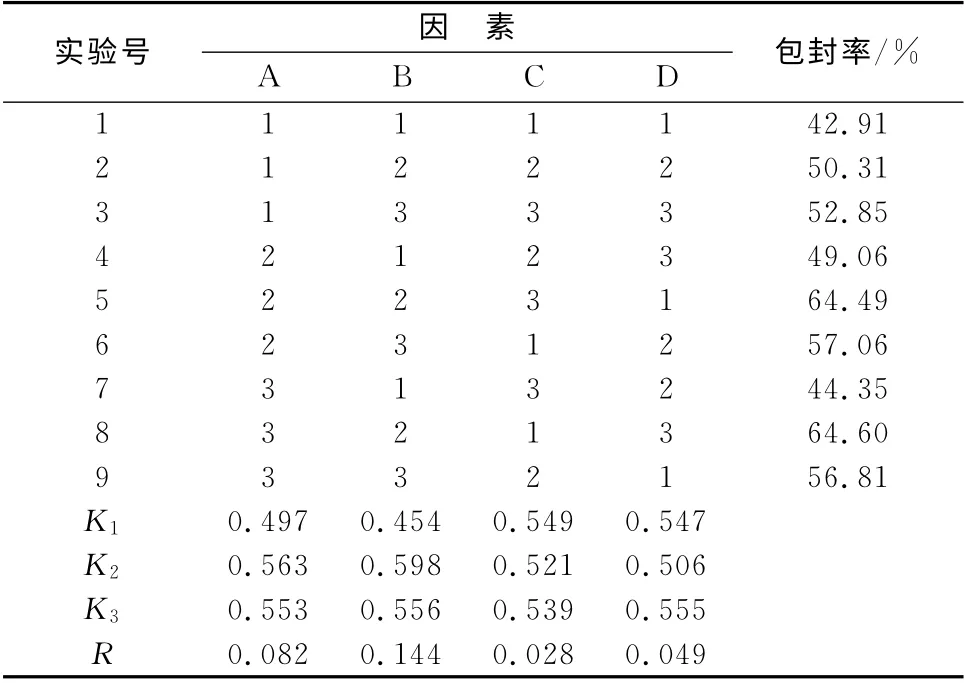
表2 尼索地平醇质体处方正交试验设计及结果Tab2 Experimental design and results of orthogonal test of nisoldipine ethosomes prescription
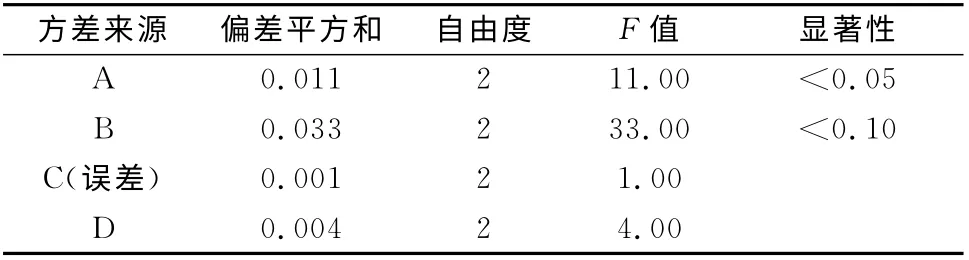
表3 正交试验的方差分析Tab 3 Analysis of variance of orthogonal test
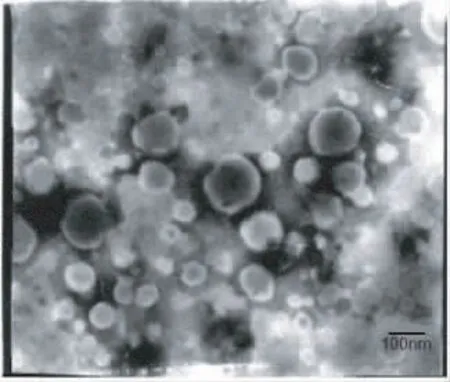
图2 尼索地平醇质体的透射电镜照片(×60 000)Fig 2 Transmission electron microphotography of nisoldipine ethosomes(×60 000)
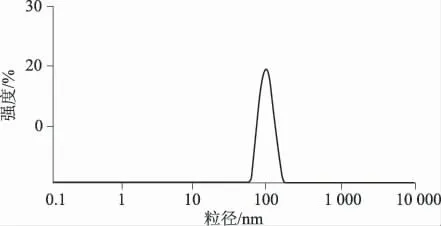
图3 尼索地平醇质体的粒径分布图Fig 3 Particle size distribution of nisoldipine ethosomes
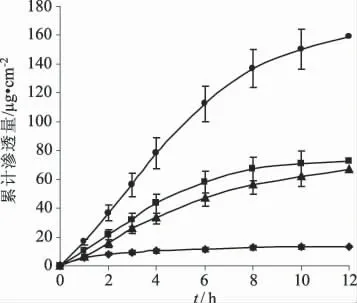
图4 醇质体和对照制剂的经皮渗透曲线.±s,n=3)—◆—混悬液;—■—45%乙醇液;—▲—脂质体;—●—醇质体Fig 4 Cumulative penetration curves of nisoldipine penetratingthrough mice skin from ethosomes and control groups.±s,n=3)—◆—suspensions;—■—45% ethanol solution;—▲—liposomes;—●—ethosomes
表4 醇质体与对照制剂的经皮渗透参数±s,n=3)Tab 4 Permeation parameters of nisoldipine from ethosomes and control groups through rat shin±s,n=3)
注:Js 为 稳 态 透 皮 速 率,IER为 各 组Js 与 混 悬 液 组Js 的 比 值,Qr 和Qs 分别为12 h时药物经皮渗透累计量和药物在皮肤中的滞留量
组别 Js/μg·(cm2·h)-1 IER Qr Qs/μg·cm-2/μg·cm-2 45 45% 乙醇液 6.13±0.68 5.33 73.56±8.16 183.99±20.11脂质体 5.52±0.49 4.80 66.24±5.88 151.68±12.39醇质体 13.41±1.12 11.66 160.92±13.44 288.51±27.混悬液 1.15±0.14 1 13.80±1.68 32.94±3.92
3.4 药物在皮肤中滞留量 由12 h皮肤中药物滞留量的结果可知,45%乙醇溶液、脂质体、醇质体均可明显提高皮肤中药物滞留量,其顺序为:醇质体>45%乙醇溶液>脂质体>混悬液(表4)。醇质体在皮肤中的滞留量均高于对照组,分别是45%乙醇溶液、脂 质 体 的1.57倍、1.90倍,经t 检 验,P <0.05,差异有显著性。
4 讨论
经皮给药是药物经过皮肤吸收的一种给药方法,具有可避免肝脏首过效应和胃肠道的不良反应,延长有效作用时间,患者可自主用药等优点。皮肤是人体的天然屏障,其表面的角质层也是透皮给药的限速屏障,虽然有大分子通过被动扩散而透过角质层的报道,但一般认为经透皮给药的理想药物:分子量<400,熔点<200℃,溶解度低;另外,一个可行的透皮给药药物的剂量应小于20 mg·d-1[11-12]。目前,美国FDA 批准上市的硝酸甘油贴片、尼古丁贴片、可乐定控释贴、睾酮凝胶剂等经皮给药制剂均符合上述条件。尼索地平分子量为388,熔点为148~152℃,在丙酮或三氯甲烷中易溶,在乙醇中略溶,在水中几乎不溶[13]。市售的尼索地平缓释片10 mg/片,每日1片。因此,尼索地平适宜开发为透皮给药制剂。
在筛选制备方法时发现,采用乙醇注入法将尼索地平和大豆卵磷脂溶于乙醇,再注入水中,可获得较高的包封率。为获得大小合适、粒度均匀的醇质体,对制得的醇质体初液尝试用探头超声、高速匀质做进一步处理,再依次挤压通过0.45μm 和0.22 μm 微孔滤膜,最后得醇质体液。结果发现,经处理后的醇质体液较醇质体初液,更易通过微孔滤膜,且醇质体粒径更小;经处理后的两种醇质体液比较,经高速匀质处理的醇质体粒径分布更均匀、制备重复性更好。因此,确定尼索地平醇质体的制备方法为乙醇注入-匀质法。
醇质体因含有高浓度的乙醇而显现出较高的流动性,易于变形穿透皮肤屏障,具有高包封率、高稳定性和优良渗透性等优点,但乙醇浓度过高反而会影响其各项性能。研究发现,随着乙醇浓度的升高,药物透皮速率呈现先增大后减小的趋势,有认为乙醇浓度66%时透皮速率达到最大值[14],也有认为乙醇浓度60%时体外经皮渗透量明显降低[10]。药物以醇质体为载体的透皮速率,不仅与醇质体中乙醇浓度有关,还与药物本身性质有关,如药物的脂溶性、分子量、pH 等理化性质。López等[15]认为醇质体中乙醇用量不能超过处方量的50%,否则乙醇将溶解处方中的磷脂,使醇脂质体囊泡膜变得易漏,反而使包封率降低。为此,在处方优化试验时,处方中加入了少量的胆固醇以增大脂质层硬度,在保持醇质体含高浓度乙醇的同时,又兼顾了醇质体的包封率和稳定性。按优化处方制备尼索地平醇质体3批,外观结构良好,粒径分布均匀,包封率较高,说明制备方法合理,工艺稳定可行。
体外透皮实验采用小鼠腹部皮肤为离体皮肤,比较尼索地平醇脂质体与其水溶液(混悬液)、同浓度乙醇液(45%乙醇溶液)、普通脂质体的经皮渗透性。实验结果可知,醇质体可明显促进药物经皮渗透,12 h稳态透皮速率和皮肤中药物滞留量均远高于对照制剂。将尼索地平包封于醇质体,能增强其经皮渗透性,有利于药物吸收进入体循环从而发挥全身治疗作用,开辟尼索地平经皮给药防治心绞痛、高血压的新思路,可开发为其非口服给药制剂。
[1] 金跃,张玉英,王英丽.尼索地平治疗变异型心绞痛的临床疗效观察[J].中国心血管杂志,2005,10(4):304-305.
[2] Mitrga KA,Varghese B,Porc M,et al.Anti-arrhythmic and hemodynamic effects of oxy nifedipine,oxy nimodipine,oxy nitrendipine and oxy nisoldipine[J].Pharmacol Res,2012,66(4):300-308.
[3] 余奇,万丽丽,高艳,等.国产尼索地平片的人体药动学及生物等效性研究[J].中国药房,2009,20(14):1071-1074.
[4] 李华凌,翟光喜,焦玉举,等.尼索地平口腔黏附片的制备及影响因素考察[J].中国新药杂志,2007,16(10):783-787.
[5] Rattanapak T,Young K,Rades T,et al.Comparative study of liposomes,transfersomes,ethosomes and cubosomes for transcutaneous immunisation:characterisation and in vitro skin penetration[J].J Pharm Pharmacol,2012,64(11):1560-1569.
[6] Celia C,Cilurzo F,Trapasso E,et al.Ethosomes and transfersomes containing linoleic acid:physicochemical and technological features of topical drug delivery carriers for the potential treatment of melasma disorders[J].Biomed Microdevices,2012,14(1):119-130.
[7] Rakesh R,Anoop KR.Formulation and optimization of nanosized ethosomes for enhanced transdermal delivery of cromolyn sodium[J].J Pharm Bioallied Sci,2012,4(4):333-340.
[8] 韩腾飞,程亮,危红华,等.盐酸青藤碱醇质体的制备及其性质考察[J].中草药,2012,43(7):1300-1305.
[9] Elsayed MM,Abdallah OY,Naggar VF,et al.Deformable liposomes and ethosomes:mechanism of enhanced skin delivery[J].Int J Pharm,2006,322(1):60-66.
[10]沈丹丹,张涛,黄华.盐酸奥昔布宁醇脂质体的制备及体外透皮吸收研究[J].中国药科大学学报,2011,42(1):48-52.
[11]陆彬.药物新剂型与新技术[M].北京:人民卫生出版社,2005:559.
[12]许景峰,赵维娟,张梅,等.31种药物的理化因素对透皮速率的影响[J].军队医药杂志,1997,7(2):40.
[13]中国药典.二部[S].2010:230.
[14]Panchagnula R,Salve PS,Thomasn S,et al.Transdermal delivery of naloxone:effect of water,propylene glycol,ethanol and their binary combinations on permeation through rat skin[J].Int J Pharm,2001,219(1-2):95-105.
[15]L pez-Pinto JM,Gonz lez-Rodr guez ML,Rabasco AM.Effect of cholesterol and ethanol on dermal delivery from DPPC liposomes[J].Int J Pharm,2005,298(1):1-12.
