液相-串联质谱法研究氧化苦参碱在食蟹猴体内的代谢
2013-12-23王素军杨本坤曾洁莫李立臧林泉谢海棠广东药学院临床药学系广东广州50006安徽省药物临床评价中心安徽芜湖400
王素军,杨本坤,曾洁,莫李立,臧林泉,谢海棠 (.广东药学院临床药学系,广东 广州50006;.安徽省药物临床评价中心,安徽 芜湖400)
氧化苦参碱(oxymatrine,OMT)和苦参碱(matrine,MT)是从豆科植物苦豆草Sophoro alopecuroides的种子苦豆子或豆科植物苦参Sophoroflavescens Ait 的根中提取的一种苦参型生物碱,二者药理作用广泛,具有抗病毒、强心、降压、抗炎、杀菌、抗肿瘤等作用,具有广阔的开发前景[1]。其中氧化苦参碱已经被开发成苦参素用于临床,对乙肝大三阳、小三阳、病毒携带、丙肝、肝硬化、肝腹水、酒精肝、脂肪肝、肝脾肿大具有独特疗效[2]。早期我们对氧化苦参碱在大鼠及犬的药动学进行了大量研究[3-8],试验均证实氧化苦参碱生物利用率低,部分代谢为苦参碱(matrine,MT),但氧化苦参碱在体内究竟有多少转化为苦参碱,至今尚未能明确。为了了解氧化苦参碱在体内转化为苦参碱的量,便于临床确定给药剂量及掌握药物发挥药效与毒性的物质基础,本实验通过液相-串联质谱(LC/MS/MS)法研究氧化苦参碱在食蟹猴体内代谢,同时对比分析母药氧化苦参碱及其代谢产物苦参碱药动学情况,阐明氧化苦参碱在食蟹猴体内的转化率及代谢特点,为药物体内代谢评估提供一种借鉴方法。
1 材料
API3000型三重四极串联质谱仪(Applied Biosystem,美国);LC-20AD 高效液相色谱仪(岛津公司,日本);SU-PER T21 高速冷冻离心机(Sorvail公司,美国);Milli-Q Gradient A10超纯水器(Millipore,美国)。
氧化苦参碱、苦参碱(纯度>98%,批号A120103,A120113)和内标槐果碱(纯度>98%,批号110719)由广州市齐云生物技术有限公司提供。水为Milli-Q 超纯水,乙腈为色谱纯,其他试剂均为市售分析纯。
食蟹猴6只,广东蓝岛生物技术有限公司产,雌雄各半,雌猴体质量为(3.0±0.5)kg、雄猴为(5.0± 1.0)kg,许 可 证 号:SCXK (粤)2004-001020066025号。实验方案经过广东药学院伦理委员会批准。
2 方法
2.1 给药方案 实验前12 h禁食不禁水,氧化苦参碱给药剂量为1 mg·kg-1(iv)和10 mg·kg-1(ig),苦参碱给药剂量为10 mg·kg-1(iv,ig),ig于给药 后0.17,0.33,0.5,0.75,1,1.5,2,4,6,8,10,12 h,iv于给药后0.17,0.33,0.5,0.75,1,1.5,2,3,4,6,9,12 h,给药部位对侧后肢静脉采血约0.25 mL,按“2.2”项下方法提取测定。
2.2 血浆样品处理 食蟹猴静脉取血约0.25 mL,5 000 r·min-1离心10 min,分离血浆,-80 ℃保存待测。精取血浆0.1 ml,精密加入2μg·ml-1槐果碱内标溶液10μL,振荡10 s,加氯仿3 ml,涡旋3 min,4 000 r·min-1离心10 min,取下层氯仿层2.5 mL于另一离心管,离心浓缩仪中吹干,残渣用0.1 ml流动相溶解,15 000 r·min-1离心10 min,取上清液进样测定。对于静脉注射给药后前3个采样点浓度较高样品用空白血浆稀释后按上述方法处理。
2.3 色 谱 条 件 色 谱 柱:Zorbax Extend-C18柱(2.1 mm×50 mm,5μm);保护柱:Zorbax Extend-C18柱(2.1 mm×12.5 mm,5μm),柱温:40℃,流动相:10 mmol·L-1醋酸铵水溶液-乙腈(85∶15),流速:0.2 mL·min-1,进样量:10μL。
2.4 质谱条件 选择性离子检测,电喷雾离子化,检测离子[M+m/z]+:氧化苦参碱检测离子对为m/z265→m/z 247.2;苦参碱检测离子对为m/z 249.2→m/z 148;内标槐果碱检测离子对为m/z 247→m/z136.2。雾化气流量(GS1):30 L·min-1;辅 助 气 流 量(GS2):50 L·min-1;气 帘 气 流 量(CUR):20 L·min-1;碰撞气流量(CAD):high;离子喷雾电压(IS):5 000V;离子源雾化温度(TEM):550 ℃;扫描时间:200 ms;去簇电压(DP):70 V;管入口电压(EP):10 V;Q2出口电压(CXP):9 V。
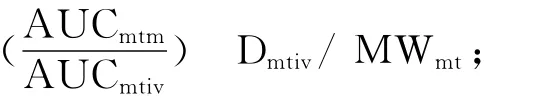
发生代谢的氧化苦参碱摩尔数 MWomt/Domtm即为氧化苦参碱转化成苦参碱的转化率(Fc)。
故氧化苦参碱转化成苦参碱的转化率(Fc)采用下式计算:

(AUCmtm:代谢物苦参碱药时曲线下面积,AUCmtiv:苦参碱单体静注给药后的药时曲线下面积,Dmtiv:苦参碱单体静注给药的剂量,Domtm:母药氧化苦参碱给药的剂量,MWmt:苦参碱的相对分子质量,MWomt:氧化苦参碱的分子量)
3 结果
3.1 色谱行为 LC/MS/MS法测定氧化苦参碱、苦参碱时,采用选择性离子检测方式,其专属性强,灵敏度高,血浆中内源性物质不干扰样品的测定。以槐果碱(SC)作为内标,结果表明,氧化苦参碱(OMT)、苦参碱(MT)和内标槐果碱(SC)的保留时间分别为1.89、2.11和2.35 min,空白血浆中内源性物质均不干扰其测定。
3.2 标准曲线的制备 取食蟹猴空白血浆0.1 mL,精密加入不同量的氧化苦参碱、苦参碱标准溶液,制成含氧化苦参碱、苦参碱分别为0.01,0.05,0.1,0.5,1.0,2.0μg·mL-1的系列浓度,按“2.2”项下方法操作,分别记录峰面积,以氧化苦参碱、苦参碱峰面积(AS)对内标槐果碱的峰面积(AIS)比值为纵坐标(f),以氧化苦参碱、苦参碱血浆浓度为横坐标(C)进行线性回归,得血浆中标准曲线方程:OMT 为f=0.004 3C+0.001 67,r=0.999 6,MT为f=0.002 78C+0.004 55,r=0.999 1。
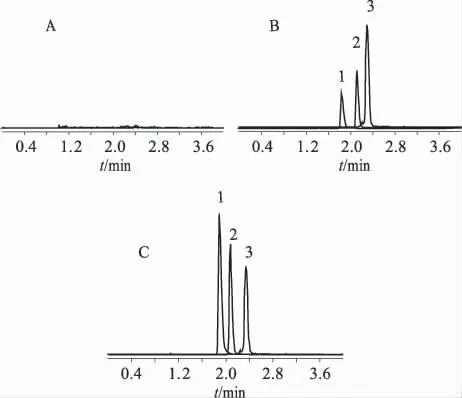
图1 氧化苦参碱和苦参碱血浆样品的LC/MS/MS图谱A.空白血浆;B.空白血浆+0.01μg·mL-1 OMT+0.01μg·mL-1 MT+内标SC;C.给药后的血浆样品;1-OMT;2-MT;3-SCFig 1 LC/MS/MS chromatograms of OMT and MT in plasmaA.blank plasma;B.blank plasma spiked with0.01μg·mL-1 OMT,MT and SC;C.the plasma after medication;1-OMT;2-MT;3-SC
3.3 提取回收率 配制含氧化苦参碱、苦参碱浓度为0.01、0.1和2.0μg·mL-1的血浆样品样品,加人内标槐果碱,按“2.2”项操作;另采用提取好的空白血浆样品配制0.01、0.1和2.0μg·mL-1浓度,加入内标槐果碱。计算绝对回收率,结果表明低、中、高3种浓度血浆样品的氧化苦参碱绝对回收率(n=5)分别为(90.1±3.2)%,(91.2±3.3)%和(93.1±3.7)%;苦参碱绝对回收率(n=5)分别为(91.0±1.3)%,(93.5±1.4)%和(92.3±1.7)%。按上述操作,0.02μg·mL-1内标槐果碱绝对回收率(n=5)为(88.7±4.1)%。
3.4 日内及日间RSD 测定 按“3.2”项下操作,配制含氧化苦参碱、苦参碱浓度为0.01、0.1和2.0μg·mL-1的标准含药血浆(每个浓度做6份样品)及一条随行标准曲线,每天做一批及一条随行标准曲线,连续做3 d,共3批,每批每个浓度做6份样品,测定日内RSD 和日间RSD,结果表明高、中、低3种浓度的日内及日间RSD 均小于15%,符合生物样品分析方法测定要求。
3.5 稳定性试验 配制含氧化苦参碱、苦参碱浓度为0.01、0.1和2.0μg·mL-1的血浆样品,分别在室温放置5、24 h;连续3 d,每天冻融一次;冰箱-80 ℃冻存90 d后按照“2.2”项方法处理后进样,与新鲜配制的样品进行比较。结果表明在短暂室温放置、冻融及-80℃冻存的条件下,氧化苦参碱与苦参碱的浓度均无明显下降,检测时浓度RSD均小于9%。
3.6 基质效应试验 用按“2.2”项下操作提取好的不 同 来 源 空 白 血 浆 样 品 配 制0.01,0.1,2.0μg·mL-1氧化苦参碱和苦参碱样品进行检测,每个浓度取6份,与直接用流动相配制相应浓度氧化苦参碱和苦参碱样品峰面积值之比计算其基质效应(%),同理计算内标槐果碱的基质效应(%),结果各样品和内标的基质效应比值均在89%~96%之间,表明空白血浆中的无机盐等杂质对氧化苦参碱、苦参碱和内标槐果碱的检测离子无明显抑制和增强作用。
3.7 血药浓度-时间数据 食蟹猴口服给药氧化苦参碱(10 mg·kg-1)及静注氧化苦参碱(1 mg·kg-1)后血药浓度-时间数据为图2;食蟹猴口服给药苦参碱(10 mg·kg-1)及静注苦参碱(10 mg·kg-1)后血药浓度-时间数据见图3。
3.8 主要的药动学参数 食蟹猴iv和ig氧化苦参碱及苦参碱后的主要药动学参数见表1。

图2 食蟹猴iv和ig氧化苦参碱后氧化苦参碱及代谢产物苦参碱的药-时曲线±s,n=6)—△—ivomt omt;—■—igomt omt;—▲—igomt mt;—◆—ivomt mt Fig 2 Plasma concentration–time curves of oxymatrine and matrine after intravenous and oral administration to cynomolgus±s,n=6)—△—ivomt omt;—■—igomt omt;—▲—igomt mt;—◆—ivomt mt

图3 食蟹猴iv和ig苦参碱后苦参碱的药-时曲线±s,n=6)—◆—iv mt mt;—■—ig mt mtFig 3 Plasma concentration–time curves of matrine after intravenous and oral administration to cynomolgus±s,n=6).—◆—iv mt mt;—■—ig mt mt注:iv mt mt代表静注苦参碱10 mg·kg-1后苦参碱的血药浓度;ig mt mt代表口服苦参碱10 mg·kg-1后苦参碱的血药浓度
表1 食蟹猴静注和口服氧化苦参碱及苦参碱后的主要药动学参数±s,n=6)Tab 1 Main pharmacokinetic parameters of OMT and MT after intravenous and oral administration to cynomolgus±s,n=6)

表1 食蟹猴静注和口服氧化苦参碱及苦参碱后的主要药动学参数±s,n=6)Tab 1 Main pharmacokinetic parameters of OMT and MT after intravenous and oral administration to cynomolgus±s,n=6)
参数 MT(iv)MT(ig)OMT(iv)OMT(ig)Metabolite-MT(OMT ig)Metabolite-MT(OMT iv)t1/2β/h 10.5±1.80 11.2±2.10 4.23±0.44 4.45±0.12 1.18±0.37 8.07±0.54 tmax/h 0.17±0.05 1.00±0.25 2.00±1.00 1.33±0.49 Cmax/μg·mL-1 1.30±0.02 0.65±0.25 0.50±0.23 0.05±0.02 MRT/h 2.45±0.66 1.99±0.45 1.42±0.47 3.01±0.19 3.58±0.38 5.32±0.85 AUC0~12/μg·mL-1·h 4.68±0.65 2.00±0.25 1.41±0.02 1.60±0.47 1.56±0.16 0.30±0.17 AUC0~∞/μg·mL-1·h 4.88±0.68 2.04±0.15 1.44±0.03 1.66±0.49 1.64±0.31 0.33±0.19 F/% 11.8±2.2 Fc/% 30.7±6.6 6.1±1.3
4 讨论
LC/MS/MS法可以同时检测食蟹猴血浆中氧化苦参碱和苦参碱,重复性好,准确性、灵敏度高,分析速度快。
氧化苦参碱与苦参碱相比,其氧化结构使分子的极性发生了改变,其极性较高,体内药动学也随之改变。氧化苦参碱进入人体后血浓度相对较高,清除快,半衰期短,见表1。静注给予食蟹猴氧化苦参碱(1 mg·kg-1)与苦参碱(10 mg·kg-1)后,二者的AUC0~∞之比约为0.3∶1,剂量归一化后二者的AUC0~∞之比约为3∶1,这表明氧化苦参碱的分布主要集中在血液,这可能是其毒性小于分布广泛的代谢产物苦参碱的原因之一。在药物吸收的过程中考察生物利用度的基础上,关注药物代谢转化率对于评估存在广泛代谢的药物发挥药效的具体物质有重要的意义,药物代谢时如果把代谢物的AUC 与母药AUC相比直接求出代谢转化率,这样就忽略了药物的体内分布状态,也把等剂量原药与代谢物的AUC等同起来。如果母药和代谢物极性差别大,往往其体内药动学也有明显区别,从本实验可看出二者相同剂量时,AUC具有较大的差别,若等同起来,将不能真正反应原药的转化量,求出的转化率也将明显减小,故提出了OMT 的代谢转化率公式(见“2.5”项数据分析),它相对来说可以更实际地反映OMT 的代谢转化量。对一些存在类似体内代谢,发挥药效不知为母药还是代谢物的药物研究提供了参考,更真实客观地反应了母药的代谢转化量,对进一步的研究量效关系有重要意义。
食蟹猴中静注氧化苦参碱后的代谢转化率仅为6.1%,明显低于灌胃后代谢转化率30.7%,可见其吸收过程存在明显代谢,该药具有较大首过效应,与谢明智等[9]报道氧化苦参碱大鼠灌胃后大量的氧化苦参碱在肠道经细菌转化为苦参碱而吸收入血基本吻合。
氧化苦参碱静注后,在10 min左右便发现苦参碱,平均浓度约8 ng·mL-1。随后苦参碱浓度开始上升,在0.75~2 h,苦参碱的平均浓度维持在50 ng·mL-1左右,浓度变化不明显,但3 h后明显下降,约为30 ng·mL-1,12 h检测到代谢物约6 ng·mL-1。氧化苦参碱口服后,在1.5 h时苦参碱达到最高浓度503 ng·mL-1,于12 h时降低至16 ng·mL-1。氧化苦参碱的绝对生物利用度为11.8%,但转化率为30.7%,可见氧化苦参碱的代谢是其生物利用度低的主要原因之一,也表明该药口服后药效及其毒性是其本身和代谢物苦参碱共同作用的结果。同时对存在广泛的体内代谢的药物,要同时考察母药及其代谢产物的药动学,兼顾生物利用度与代谢转化率的考察,从整体考察药动学,这样对于评估药物的代谢特征,为判断哪一种具体的药物发挥作用提供更为客观的参考。同时该研究也可为其他化合物体内代谢的定量评估提供一种借鉴方法。
[1] 杨钰萍,沈祥春.氧化苦参碱药理作用的研究进展[J].中国医院药学杂志,2009,29(5):405-407.
[2] 刘四海,戴华.苦参素的药理作用与临床应用[J].中药药理与临床,2007,23(5):245-247.
[3] 王素军,王广基,李晓天,等.氧化苦参碱在犬体内的药动学[J].中国医院药学杂志,2005,25(7):585-587.
[4] 王素军,王广基,李晓天等.氧化苦参碱大鼠肠道吸收机理及其吸收部位的研究[J].中国临床药理学与治疗学,2005,10(12):1326-1329.
[5] 王素军,王广基,李晓天.氧化苦参碱缓释片在犬体内的代谢及其相对生物利用度[J].中国药学杂志,2008,43(2):129-131.
[6] Wang SJ,Wang GJ,Li XT,et al.Simultaneous determination of oxymatrine and its active metabolite matrine in dog plasma by liquid chromatography-mass spectrometry and its application to pharmacokinetic studies[J].J Chromatogr B,2005,817(2):319-325.
[7] 王素军,王广基,李晓天,等.LC-MS法研究血浆中氧化苦参碱及其代谢物在犬体内的药代学[J].中国中药杂志,2005,30(2):133-136.
[8] 王素军,王广基,李晓天,等.LC-MS法测定Beagle犬血浆中苦参碱及其药代动力学[J].中国临床药理学与治疗学,2004,9(12):1361-1364.
[9] 谢明智,周文正,张瑛.氧化苦参碱的代谢[J].药学学报,1981,16(7):481-487.
