菊黄上清含片体外抗病毒及免疫作用研究
2013-12-23刘跃唐丽牟景丽陆苑王爱民郑林贵阳医学院药学院民族药与中药开发应用教育部工程研究中心贵州贵阳550004贵州省药物制剂重点实验室贵州贵阳550004
刘跃,唐丽,牟景丽,陆苑,王爱民,,郑林, (.贵阳医学院药学院,民族药与中药开发应用教育部工程研究中心,贵州 贵阳550004;.贵州省药物制剂重点实验室,贵州 贵阳550004)
菊黄上清含片处方来源于贵州黔南苗族自治州民间验方,本方以贵州民族特色草药羊耳菊为主药,辅以黄芩、甘草、冰片3味药材组成,具有疏风清热,解毒利咽之功效。课题组在民间应用基础上采用现代提取纯化及药物制剂技术将其研制成口含片,适用于治疗热毒内蕴、挟风上扰所致咽痛、咽干灼热、吞咽不利、舌边尖红等症[1]。课题组前期针对菊黄上清含片部分药效已做了报道,但未对其体外抗病毒作用及免疫作用进行了实验研究[2],为了进一步为临床应用提供实验依据,现报道如下。
1 实验材料
1.1 药物 菊黄上清含片,由贵阳医学院药物研究所提供,批号20021016,1.5 g/片,每1片含4 g生药,试验前用蒸馏水配制成所需浓度的药液。
菊黄上清含片浸膏,由贵阳医学院药物研究所提供,批号20021016-2,每1 g含12 g生药,试验前按试验要求配制成所需浓度的药液。
病毒唑(贵州光正制药有限公司,批号020705),试验前用灭菌Hanks,液按实验需要进行稀释。
1.2 试药 印度墨汁(Sigma公司生产,批号G-8307),临用时以1%明胶液稀释4倍备用。
1.3 细胞 Hep-2细胞,贵阳医学院免疫学教研室保存;Hela细胞,贵阳医学院免疫学教研室保存;MDCK 细胞,购自贵州省防疫站。
1.4 细胞培养液 RPMI-1640培养液,含10%小牛血清、1%青霉素、链霉素混匀,用4.4% 碳酸氢钠调至pH7.2~7.4;维持液,RPMI-1640培养液,加入2%小牛血清、1%青霉素、链霉素混匀,用4.4%碳酸氢钠调至pH7.2~7.4。
1.5 病毒毒株
1.5.1 标准株 流感病毒甲型京科86-1,本实验室保存毒株;呼吸道合胞病毒(Long株),由武汉大学医学院病毒研究所提供;副流感病毒Ⅰ型:由武汉大学医学院病毒研究所提供;腺病毒-7,购自北京儿童医院,贵阳医学院免疫学教研室保存。
1.5.2 临床株 流感病毒B/黔防/252/2001,由贵州省防疫站提供。
1.6 鸡胚 10日龄鸡胚,受精卵购自贵州大学农学院种鸡场。
1.7 动物 昆明种小鼠,符合国家一级实验动物标准,体质量:14~18 g,雌雄兼用,合格证号:SCXK(黔)2002-0001,由贵阳医学院实验动物中心提供。
2 方法及结果
2.1 体外抗病毒试验
2.1.1 对病毒细胞病变的抑制作用
(1)病毒滴度及药液对细胞的最大无毒浓度测定 取菊黄上清浸膏加水适量,微热溶解,用4%氢氧化钠调至pH6~6.5,用1.2μm 滤膜滤过,滤液再用适量Hanks,液稀释,振摇混合,配制成澄清液体,每1 mL含生药0.1 g,试验前用0.22μm 滤膜滤过,-80℃冻存,小管分装。
将药液稀释成20,10,5,2.5,1.25,0.625 mg·mL-1质量浓度,按文献方法[3]测定药液对细胞的最大无毒浓度并和各病毒滴度TCID50。
结果表明药液对Hep-2、Hela和MDCK 细胞的最大无毒质量浓度均为2.5 mg生药·mL-1。测得呼吸道合胞病毒、副流感病毒对Hep-2的TCID50分别为10-5.48,10-5.67;腺病毒对Hela的TCID50分别为10-5.21;流行性感冒病毒标准株和临床株对MDCK 的TCID50分别为10-6.71和10-5.76。
(2)对病毒细胞病变作用的影响 将Hep-2、Hela和MDCK 细胞分别接种在96 孔微量培养板上,置37℃,5%CO2培养箱中,长成单层细胞后,然后每孔加入用维持液配制的100 TCID50的各种病毒0.1 mL,Hep-2 接种呼吸道合胞病毒、副流感病毒,Hela 接种腺病毒,MDCK 接种流行性感冒病毒,吸附2 h后,倾去病毒液,用Hanks,液洗3次,然后分别加入不同浓度的药液,每种浓度的药液接种4孔。同时设病毒对照、细胞对照、药物对照和病毒唑对照。置5%CO2培养箱中37℃孵育,每天在倒置显微镜下观察细胞病变,并记录各孔病变情况。以病毒对照孔细胞出现明显病变,细胞对照孔细胞无明显退变时,判断结果。结果见表1。

表1 对病毒致细胞病变的抑制作用Tab 1 The inhibitory effects on cytopathic changes
结果表明在感染100 TCID50病毒的情况下,对各种病毒致细胞病变均有不同的抑制作用,对呼吸道合胞病毒抑制质量浓度为1.25 mg·mL-1,对副流感病毒Ⅰ型抑制质量浓度为2.5 mg·mL-1,对腺病毒7型抑制质量浓度为1.25 mg·mL-1,对流感病毒B/黔 防/252/2001 抑 制 质 量 浓 度 为1.25 mg·mL-1,流感病毒甲型京科86-1 抑制质量浓度为0.625 mg·mL-1。
2.1.2 鸡胚培养法
(1)病毒毒力测定 将甲型流感病毒京科86-1和流感病毒B/黔防/252/2001分别接种于10日龄鸡胚尿囊腔,3日后收获尿囊液,按文献方法测定其血凝效价(Hu)[4]。结果测得甲型流感病毒京科86-1和流感病毒B/黔防/252/2001的Hu分别为1∶1 280和1∶640,小管分装,-80℃保存备用。
药物对鸡胚的毒性测定:将受试药物用无菌Hanks液稀释成50,25,12.5,6.25,3.13 mg·mL-1的药液。取10日龄鸡胚25个,随机分成5组,按尿囊腔接种法分别注入不同浓度的受试药物各0.2 mL。同法设生理盐水对照组。石蜡封孔,移入37℃恒温箱中培养,每日在检卵灯下鸡胚存活情况,连续观察72 h。以72 h鸡胚全部存活作为该药物对鸡胚最大无急性毒性剂量。测得药物对鸡胚的最小无毒剂量大于50 mg·mL-1。
(2)药物对病毒的直接作用 以最大无毒浓度为上限,将药物稀释成100,50,25 mg·mL-13个质量浓度,取等量药物与200 Hu不同毒株病毒混合,37℃水浴作用2 h。
取10日龄鸡胚60个,随机分成15组,每组4个;每组鸡胚经尿囊腔接种经处理的上述各组混合液0.2 mL,石蜡封孔。置37℃恒温箱培养,每日在检卵灯下观察2次,连续观察48 h,将鸡胚移至4℃冰箱中过夜,次日分别收取每胚尿囊液,测定其血凝效价;并设生理盐水对照组(病毒对照组),结果见表2、表3。

表2 对流感病毒京科86-1毒株直接作用的影响Tab 2 Direct effect on influenza virus
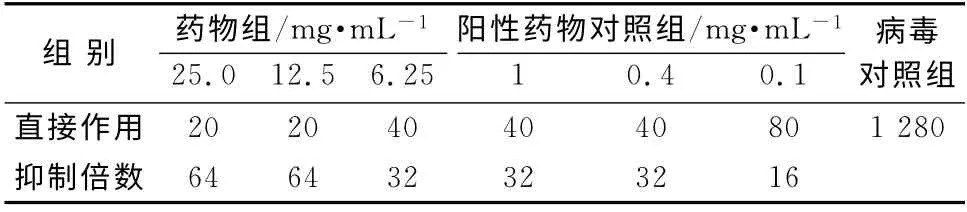
表3 对流感病毒京科86-1毒株预防作用的影响Tab 3 Preventive effect on influenza virus
(3)药物对病毒感染的预防作用 同上分组及稀释药物,并接种鸡胚,每胚0.2 mL,石蜡封孔。置37℃恒温箱2 h,取出,再接种不同毒株流感病毒0.2 mL(100Hu),石蜡封孔,置37℃恒温箱培养。每日在检卵灯下观察2次,连续观察48 h,将鸡胚移至4℃冰箱中过夜,次日分别收取每胚尿囊液,测定其血凝效价;结果见表4、表5。
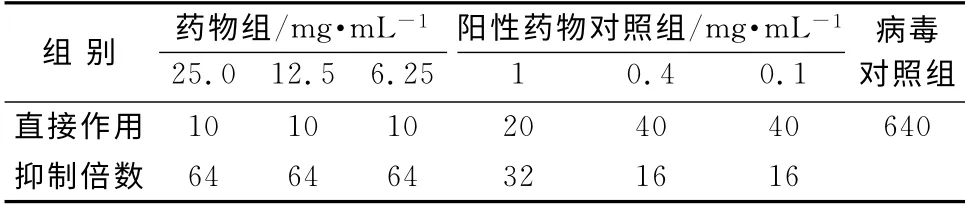
表4 对流感病毒京科86-1毒株治疗作用的影响Tab 4 Therapeutic effect on influenza virus
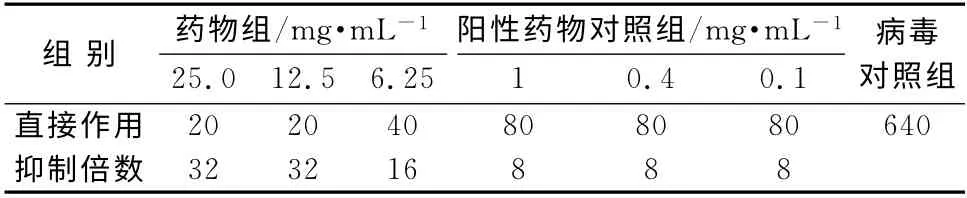
表5 对临床分离流感病毒B/黔防/252/2001 毒株直接作用的影响Tab 5 Direct effect on influenza virus FM 1 or B-QF-252-200
(4)药物对病毒感染的治疗作用 同上分组,分别接种不同毒株流感病毒0.2 mL(100 Hu),石蜡封孔,置37℃恒温箱2 h,取出,每胚注入不同稀释度药液0.2 mL,石蜡封孔,置37℃恒温箱培养。每日在检卵灯下观察2次,观察48 h,将鸡胚移至4℃冰箱中过夜,次日分别收取每胚尿囊液,测定其血凝效价;结果见表6、表7。

表6 对临床分离流感病毒B/黔防/252/2001 毒株预防作用的影响Tab 6 Preventive effect on influenza virus FM 1 or B-QF-252-2001
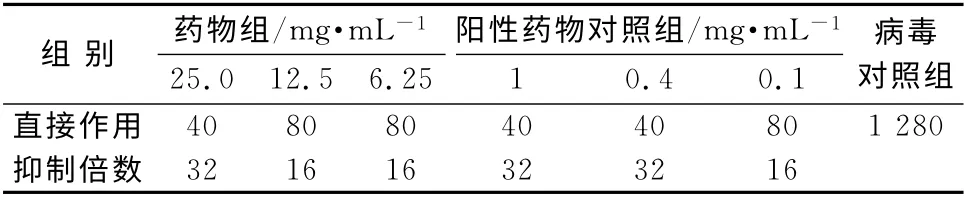
表7 对临床分离流感病毒B/黔防/252/2001 毒株治疗作用的影响Tab 7 Therapeutic effect on influenza virus FM1 or B-QF-252-2001
在鸡胚培养条件下,菊黄上清含片均无直接杀灭病毒的作用,但可抑制流感病毒甲型京科86-1和流感病毒B/黔防/252/2001毒株在鸡胚内的增殖,呈现明显的剂量相关性,最高可达64倍。实验用各剂量药物均有较明显的预防和治疗流感病毒感染作用。
2.2 对免疫功能的影响
2.2.1 对小鼠免疫器官重量的影响[5-6]取体质量14~18 g昆明种小鼠50只,雌雄兼有,随机分为5组,每组10只。按表8 分组灌胃给予菊黄上清含片。每日给药1次,连续7 d;末次给药后1 h,处死动物,取胸腺和脾脏称重,并计算脏器指数[7],结果见表8。
表8 对免疫器官重量的影响±s)Tab 8 Effect of Juhuangshangqing buccal lozenge on body weight±s)

表8 对免疫器官重量的影响±s)Tab 8 Effect of Juhuangshangqing buccal lozenge on body weight±s)
注:与对照组比较,aP<0.05,b P<0.01
组别 剂量/g·kg-1胸腺指数 脾脏指数对照组 ― 3.70±0.19 5.32±0.36低剂量 1.8 3.83±0.24 5.35±0.44中剂量 3.6 4.03±0.34a 5.77±0.57高剂量 7.2 3.99±0.38a 5.67±0.38a左旋咪唑 0.1 4.11±0.30b 5.72±0.44 a
试验结果表明,菊黄上清含片中、高剂量组小鼠脾脏指数和高剂量组胸腺指数均明显高于对照组,与对照组比较有显著性差异(P<0.05)。
2.2.2 对小鼠网状内皮系统的影响[8]取体质量18~22 g昆明种雄性小鼠50只,分组同上。按表9分组灌胃给药。每日给药1次,连续5 d;末次给药后1 h,于尾静脉注射稀释印度墨汁0.1 mL·10 g-1体质量,注射后30 s和6 min分别从小鼠眼眶后静脉丛取血25μL于0.1% 碳酸纳2 mL中,比色并计算吞噬指数k和吞噬系数a,结果见表9。
表9 对网状内皮系统的影响±s)Tab 9 Effect of Juhuangshangqing buccal lozenge on reticuloendothelial system function±s)
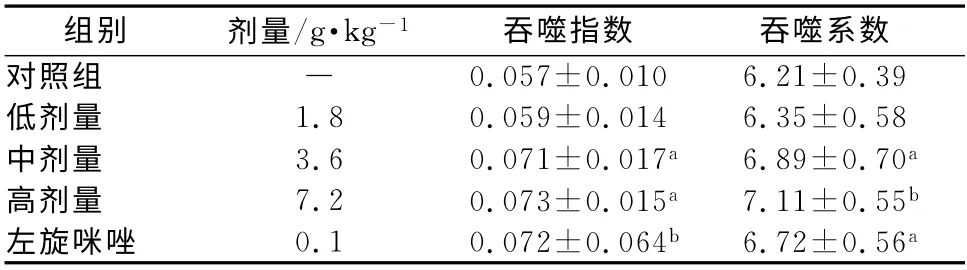
表9 对网状内皮系统的影响±s)Tab 9 Effect of Juhuangshangqing buccal lozenge on reticuloendothelial system function±s)
注:与对照组比较,aP<0.05,b P<0.01
组别 剂量/g·kg-1吞噬指数 吞噬系数对照组 ― 0.057±0.010 6.21±0.39低剂量 1.8 0.059±0.014 6.35±0.58中剂量 3.6 0.071±0.017a 6.89±0.70a高剂量 7.2 0.073±0.015a 7.11±0.55b左旋咪唑 0.1 0.072±0.064b 6.72±0.56 a
试验结果表明,菊黄上清含片中、高剂量组的吞噬指数k和吞噬系数a明显高于对照组,与对照组比较有显著性差异(P<0.05、P<0.01)。
2.2.3 对小鼠体液免疫功能的影响[7]取体质量18~22 g昆明种小鼠50 只,雌雄兼有,分组同上。给药组按表10剂量灌胃给药。每日给药1次,连续8 d。给药2 d后,腹腔注射绵羊红细胞0.2 mL/只免疫,于免疫后6 d,眼眶取血测定半数溶血素值(HC50),结果见表10。
表10 对体液免疫免疫功能的影响±s)Tab 10 Effect of Juhuangshangqing buccal lozenge on humoral immune function±s)

表10 对体液免疫免疫功能的影响±s)Tab 10 Effect of Juhuangshangqing buccal lozenge on humoral immune function±s)
注:与对照组比较,aP<0.05,b P<0.01
组别 剂量/g·kg-1 HC 50对照组 ― 114.55±48.91低剂量 1.8 118.94±54.19中剂量 3.6 140.15±52.72高剂量 7.2 171.21±58.14a左旋咪唑 0.1 160.15±33.59 a
试验结果表明,菊黄上清含片高剂量组小鼠HC50明显高于对照组,与对照组比较有显著性差异(P<0.05)。
3 讨论
菊黄上清含片由羊耳菊、黄芩、甘草、冰片组成,主药羊耳菊为贵州民族药,收载于贵州省中药材、民族药材质量标准(2003年版),主要用于治疗痢疾、泄泻、肝炎等,且有文献报道其根、茎、叶水提物具有良好的抗微生物作用[9]。另外甘草药材中的甘草酸类化合物通过对多种病毒颗粒的直接作用和诱生干扰素作用,增强天然杀伤细胞和巨噬细胞的活性等活化宿主免疫功能,发挥广谱抗病毒作用[10]。
体外抗病毒试验表明菊黄上清含片对呼吸道合胞病毒、副流感病毒Ⅰ型、腺病毒-7 所致细胞病变均有不同的抑制作用;在鸡胚培养条件下,对流感病毒甲型京科86-1 和临床分离流感病毒B/黔防/252/2001感染有较明显的预防和治疗作用。呼吸道合胞病毒(respiratory syncyntial wirus,RSV)、流感病毒和副流感病毒是导致呼吸道系统感染的常见主要病原体,菊黄上清含片的抑制作用说明其抗病毒作用可能是菊黄上清含片治疗呼吸系统感染的作用机制之一,该研究为菊黄上清含片发挥药效的作用机制提供了一定的理论依据。
菊黄上清含片中、高剂量组小鼠脾脏指数、胸腺指数、吞噬指数k和吞噬系数a均明显高于对照组,高剂量组小鼠HC50明显高于对照组,与对照组比较差异有显著性(P<0.05),提示菊黄上清含片能增加小鼠网状内皮细胞的吞噬,具有提高机体免疫功能的作用。
[1] 李翠兵,李永军,兰燕宇,等.菊黄上清含片的抗炎解热镇痛作用[J].中国医院药学杂志,2010,30(13):1091-1094.
[2] 李翠兵,李勇军,郑林,等.菊黄上清含片的抗菌实验研究[J].贵阳医学院学报,2010,35(1):8-12.
[3] 刘小玲,梁彬,张勇,等.广枣总黄酮体外抗CVB_3病毒活性[J].中国医院药学杂志,2007,27(12):1637-1641.
[4] 何晓静,张岩,肇丽梅.清热合剂体外抗流感病毒的作用评价[J].中国医院药学杂志,2007,27(8):1042-1044.
[5] 潘志强.酶降解的枸杞多糖免疫增强作用实验研究[J].中国药业,2010,19(24):13-14.
[6] 陶来宝,马成禹.参杞合剂对小鼠某些免疫指标的调节作用[J].中国免疫学杂志,1996,126(6):377.
[7] 李仪奎.中国药理实验方法学[M].上海:上海科学技术出版社,1991:155-167.
[8] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1994:50.
[9] 刘胜贵,李军,陈富成,等.羊耳菊水提取物体外抑菌活性研究[J].时珍国医国药,2009,20(12):3072-3074.
[10]骆勇,李翠兵,兰燕宇,等.菊黄上清含片抗流感病毒的研究[J].贵阳医学院学报,2009,34(6):649-654.
