液质联用快速检测血浆中紫杉醇含量
2013-12-23彭丽孔艺刘思佳李国锋南方医科大学南方医院药学部广东广州510515
彭丽,孔艺,刘思佳,李国锋 (南方医科大学南方医院药学部,广东 广州510515)
紫杉醇(paclitaxel,商品名Taxol)是从红豆杉科红豆属(Taxus)植物的树皮中提取出来的,一种二萜类细胞毒性抗肿瘤药[1]。紫杉醇具有广谱抗肿瘤活性,通过与微管蛋白非共价结合,促进和稳定微管,干扰微管的功能,抑制细胞生长,阻碍了细胞周期G2期细胞的复制[2-3],但不会影响肿瘤细胞中遗传物质的生成。紫杉醇这一独特的抗肿瘤机制,使它成为国内外研究的热点抗肿瘤新药。目前临床应用的主要是紫杉醇的注射剂,而市售的紫杉醇注射液中因使用了较大量的增溶剂聚氧乙烯蓖麻油(Cremophor EL),从而导致急性过敏反应,给医护人员及患者带来极大的不便。因此,相比注射制剂更为安全方便的紫杉醇口服制剂近年来已成为相关研究的热点。由于紫杉醇的溶解性差和P-gp对它的外排作用[4],生物利用度不高,血药浓度非常低,而传统检测方法灵敏度和专属性有限。LC-MS/MS方法与传统的HPLC-UV、荧光或电化学检测方法比,专属性更高,更省时,操作简单,所需样本量较少,检测灵敏度更高[4-5],非常适合定性定量检测紫杉醇这种血药浓度低的药物。因此我们尝试了LC-MS/MS检测血浆内紫杉醇的含量,拟为紫杉醇的体内检测建立一种简单快捷的方法。
1 材料和方法
1.1 仪器 Agilent1260液相色谱-G6460三重四级杆质谱联用仪,(包括G1312B 型四元输液泵,G1367E 型自动进样器,G1316A 型柱温箱,G1322A 型 脱 气 机)色 谱 工 作 站:B.04.01 SP2。P13110S电子天平,德国Sartorins生产;HC-2518高速离心机,安徽中科中佳科学仪器有限公司;MG-2200氮气挥干仪,托普仪器有限公司。
1.2 试剂 紫杉醇对照品(中国食品药品检定研究院,100382-200301);多 烯 紫 杉 醇 对 照 品(Sigma-Aldrich,1425738V);甲醇,甲酸均为色谱纯,其他化学试剂均为化学纯。
1.3 色 谱 条 件 色 谱 柱 为Agilent SB-C18(3.5 μm,2.1 mm×150 mm);流动相为甲醇-0.1%甲酸水(95∶5,v∶v);流速为0.3 mL·min-1;柱温为30℃。1.4 质谱条件 离子源为电喷雾离子源(ESI源);Vcap毛细管电压4 000 V;干燥气温度350℃;雾化气压力30 psi;干燥气流速10 L·min-1。紫杉醇和多烯紫杉醇的碰撞能量都为22 eV;裂解电压分别为250 eV 和210 eV。
2 方法与结果
2.1 制备标准品及质控(QC)样品 精密称取紫杉醇并溶解于甲醇中,制成质量浓度为550μg·mL-1的储备液。将储备液用甲醇连续稀释制成工作液浓度:0.55,1.1,27.5,110,275,550 ng·mL-1。QC用储备液以同样的方法单独稀释成质量浓度为1.1,110,550 ng·mL-1。内标用甲醇配成质量浓度为1 mg·mL-1的储备液,并稀释成100 ng·mL-1。所有溶液均保存于4℃环境中,使用前在室温放置常温。2.2 血浆样品的处理 将100μL 内标(100 ng·mL-1)蒸干后加入0.2 mL血浆样品,混匀,再加4 mL乙酸乙酯-二氯甲烷-乙腈(4∶1∶1)混合溶剂,斡旋混合1 min,5 000 rpm 离心20 min。上清液转移至干净的玻璃试管中,用氮气挥干仪挥干。残渣用200μL流动相复溶,取2μL用于LC-MS/MS分析。
2.3 质谱分析 紫杉醇在Q1全扫描模式下,母离子876.29(M+Na)具有很高的液质响应值,并且没有观察到其他离子的出现。子离子扫描时,当裂解电压(Fragmenter)为250 eV,碰撞能量(CE)为22 eV 时,紫杉醇的最大离子碎片为m/z=308.1。多烯紫杉醇(内标)在Q1全扫描模式下,母离子(M+Na)为m/z=830.34。多离子反应监测下,子离子碎片为m/z=549.3,CE值为22 eV,Fragmenter为210 eV 时是最稳定且响应值最高的,紫杉醇和多烯紫杉醇的质谱图见图1,图2。
试验中对流动相的pH、缓冲液、组分对保留时间及分离度的影响进行考察,结果发现不同的流动相对紫杉醇的响应值有很大影响。随后我们对条件进行优化后,选择甲醇和0.1%的甲酸(95∶5)作为流动相,0.3 mL·min-1为流速,结果发现保留时间最短,峰形最好,且响应值最高。紫杉醇的保留时间为1.243,多烯紫杉醇(内标)的保留时间为1.248 min。LC-MS法具有色谱分离与质谱分离的能力,在MRM模式下,通过各自独特的分子结构所产生的母离子和碎片离子,根据质谱的强分辨能力,同时检测不同的物质,最终形成图谱,通过色谱工作站(B.04.01 SP2软件)将紫杉醇和多烯紫杉醇的色谱图提取出来,紫杉醇和多烯紫杉醇互不干扰,见图3。
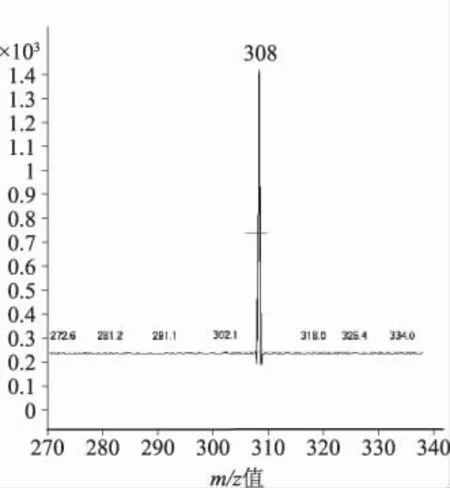
图1 紫杉醇子离子扫描质谱图Fig 1 Product ion mass spectra of paclitaxel
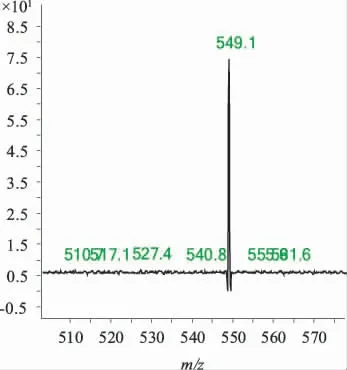
图2 多烯紫杉醇子离子扫描质谱图Fig 2 Product ion mass spectra of docetaxel

图3 紫杉醇和多烯紫杉醇多离子监测图Fig 3 Multiple reactions monitoring of docetaxel and paclitaxel
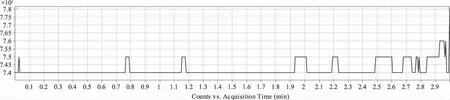
图4 空白血浆多离子反应监测图Fig 4 Multiple reactions monitoring of plasma
本实验中对样品提取纯化方法进行优化。最初,我们用乙腈,甲醇,乙酸乙酯、二氯甲烷、叔丁基甲醚(单独以及联合用)进行血浆提取的回收率均不理想(小于50%)。当选择乙酸乙酯-二氯甲烷-乙腈(4∶1∶1)作为提取溶剂时,提取率明显提高,与其他提取剂相比,提取效率最高,并且没有发现杂峰。所以,我们最终选取乙酸乙酯-二氯甲烷-乙腈作为提取试剂。
2.4 方法的专属性 分别取6只大鼠的空白血浆,除不加内标外,按“血浆样品处理”项下操作,进行LC-MS检测,获得空白血浆样品的色谱图,见图4。将一定浓度的标准溶液和内标溶液加入空白血浆中,依同法操作。取给药后的血浆样品,依同法操作。与空白血浆样品色谱图比较,以上结果表明,空白血浆中内源性物质不干扰待测物紫杉醇和多烯紫杉醇的测定。我们比较了6种来源的样品,发现内源性物质不会干扰样品的色谱峰。
2.5 标准曲线和线性范围 将100μL 内标(100 ng·mL-1)蒸干后加入空白血浆200μL,混匀,加紫杉醇标准系列溶液,配制成血浆浓度为550,275,110,27.5,1.1,0.55 ng·mL-1的样品,按“血浆样品处理”依法操作,每一浓度进行双样本分析,以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,求得紫杉醇的直线回归方程为Y =0.588 436 X-0.018 120,r2=0.997(n=6),根据标准曲线,方法线性范围在0.55~550 ng·mL-1。此方法的最低定量限为0.55 ng·mL-1(S/N>5)。
2.6 提取回收率 取空白血浆200μL,按“标准曲线的制备”项下的方法制备低、中、高3个浓度的紫杉醇QC 样品,血浆浓度分别为1.1,110,550 ng·mL-1。
紫杉醇在3个质控浓度检测下的提取回收率为79.32%,77.54%及78.64%。而内标的回收率为70.19%。上述结果表明,紫杉醇及内标的回收率前后一致性良好并且没有浓度依赖性。
2.7 精密度和准确度 将紫杉醇QC 样本配成3个浓度,并且每个浓度设置15个复孔,验证此方法学的批内及批间的精密度及准确度。精密度的结果用RSD 表示并用one-way ANOVA 进行统计分析。表1中总结了所有的相关值,日内精密度分别为2.68%,3.05%,2.13%,日 间 精 密 度 分 别 为:6.54%,4.72%,3.15,RSD<15%。准确度范围为2.13%到6.54%。从这些数据可知,此方法学达到了准确度及精密度的标准。
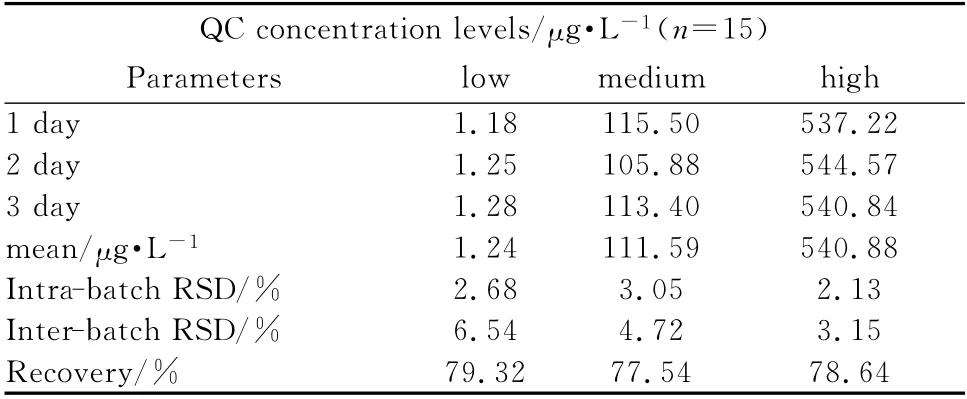
表1 三个QC浓度的日内及日间精密度Tab 1 The intra-day and inter-day precision of three QC concentration levels
2.8 稳定性 试验中考察了含有紫杉醇血液样本的室温稳定性,样本的处理液稳定性,以及反复冻融稳定性。取空白大鼠血浆,按“标准曲线的配制”项下的方法配制低、中、高3个浓度样品各3份(1.1,110,550 ng·mL-1),室温条件下放置1 h 和24 h后,处理样本,与新鲜配制的储备液比较;样本处理后,1 h和24 h后进样分析,与新鲜配制的储备液比较;分别于-20℃放置7 d、-20 ℃反复冻融3次和样品预处理后室温放置24 h,考察样品的稳定性。结果显示在上述考察条件下,3个浓度无显著变化,RSD<10%,符合稳定性要求。
2.9 介质效应考察 根据文献报道[6]的方法,进行介质效应考察。由于试验中相关介质物质被洗脱出,可能造成介质效应或者潜在的离子效应抑制或者增强。将空白血浆样品按“标准曲线的配制”项下的方法提取后,分别加入低、中、高3种浓度,测得的峰面积与QC 样品的峰面积相比,3 个浓度的介质效应分别为101.13%,98.79%,98.27%。内标的介质效应按相同方法在100 ng·mL-1浓度时进行考察,为98.56%。
3 讨论
紫杉醇是近年来引进的最重要和最有前景的抗癌药物之一。近年来,国内外文献报道了许多测定生物样品中紫杉醇的方法,其中最常用的是HPLC。相较于传统的HPLC-UV 方法检测紫杉醇,LC-MS方法专属性更高,更省时,操作简单,检测灵敏度更高,非常适合定性定量检测紫杉醇这种血药浓度低的药物,同时为紫杉醇新剂型的药代动力学研究提供检测方法。
此检测方法,紫杉醇和多烯紫杉醇的保留时间分别为1.243,1.249 min,如果用传统的HPLC 检测方法,色谱峰无法分离,但LC-MS法同时具有色谱与质谱分离的能力,可以通过MRM 检测模式,根据各自独特的分子结构所产生的母离子和碎片离子,以质谱的高分辨能力,同时检测不同的物质,最终形成图谱,通过色谱工作站(B.04.01 SP2软件)将紫杉醇和多烯紫杉醇各自的色谱图提取出来,如图3所示,所以紫杉醇和多烯紫杉醇的含量测定互不干扰,抗干扰能力强。
在本实验中尝试用不同的流动相检测紫杉醇,发现甲醇∶0.1%甲酸(v∶v,95∶5)时的响应值最高,乙腈的流动相体系中响应值较低,在甲醇的流动相体系中,定量下限可以达到0.55 ng。因此,我们最终选择甲醇和0.1%的甲酸作为流动相。
Basileo等[7]报道,采用叔丁基甲醚提取紫杉醇,本文考察了不同提取溶剂对紫杉醇提取率的影响,发现不同的提取溶剂对紫杉醇的提取率影响较大,叔丁基甲醚、乙腈等有机溶剂提取回收率均低于本文使用的混合溶剂,而且混合溶剂作为提取溶剂提取率比较稳定,峰形较好,内标的提取回收率也提高了,所以本试验最后确定用混合溶剂直接提取血浆样品,此混合提取溶剂首次应用于本实验中。由于采取了液-液萃取的提取方法,有效地避免了基质效应。并且,本实验中紫杉醇的绝对提取回收率>70%以上,符合一定方法学考察的要求,同时考虑到本实验中LC-MS/MS 方法所能达到的检测线较低,能适用于紫杉醇的体内药动学的研究。
实验采用了加钠模式,以及对提取溶剂的改进,当然由于各个实验室的条件操作以及仪器的不同等可能会有差异。我们比较了文献所报告的加氢模式以及各种提取溶剂,并同本实验条件进行了比较,认为加钠模式的响应值比加氢模式强,本实验所用提取溶剂是比较好的一种混合溶剂,对于相关的紫杉醇血药浓度的测定,必定具有一定的借鉴作用。
[1] 何蕾,王桂玲,张强.紫杉醇纳米乳剂的体内外考察[J].药学学报,2003,38(3).
[2] Kumar N.Taxol-induced polymerization of purified tubulin.Mechanism of action[J].J Biolog Chem,1981,256:10435-10441.
[3] Manfedi JJ,Horwitz SB.An antimitotic agent with a new mechanism of action[J].Pharmacol &Therap,1984,25:83-125.
[4] Zhang W,Dutschman G,Li X,et al.Quantitation of paclitaxel and its two major metabolites using a liquid chromatography electrospray ionization tandem mass spectrometry[J].J Chromatog B Analyt Technol Biomed Life Sci,2011,879:2018-2022.
[5] Wang L,Goh B,Grigg M,et al.A rapid and sensitive liquid chromatography/tandem mass spectrometry method for determination of docetaxel in human plasma[J].Rapid Commun.Mass Spectrom.2003;17:1548-1552.
[6] Matuszewski BK,Constanzer ML,Chavez-Eng CM.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Analyt Chem,2003,75(13):3019-3930.
[7] Basileo G,Breda M,Fonte G,et al.Quantitative determination of paclitaxel in human plasma using semi-automated liquid/liquid extraction in conjunction with liquid chromatography/tandem mass spectrometry[J].J Pharmaceut Biomed Analy,2003,32:591-600.
