噬菌体展示系统表达玉米赤霉烯酮模拟表位肽
2013-12-23徐富勇徐玲刘仁荣裘雪梅朱立鑫
徐富勇 徐玲 刘仁荣 裘雪梅 朱立鑫
(1.南昌大学生命科学与食品工程学院,南昌 330029; 2.江西科技师范大学生命科学学院,南昌 330013)
霉菌毒素是由真菌产生的次生代谢产物,污染的食物种类繁多,对动物和人体都有较强的毒副作用。玉米赤霉烯酮(Zearalenone,ZEN)是非类固醇雌激素霉菌毒素,主要源于镰刀菌[1]。ZEN的产生是一个长期阴冷潮湿与多因素相互作用的结果,如谷物的水分含量,感染情况,温度和微生物作用等,以及其他未知因素[2]。在玉米、高粱、小麦、大麦燕麦,以及由此为原料制作的食品中都能找到ZEN的踪迹[3,4]。在摩洛哥,ZEN已经在玉米中被发现,平均含量为14 ng/g[5],在保加利亚的小麦中,ZEN是主要的霉菌毒素,占69%,平均含量为17 ng/g[6]。由于这种霉菌毒素的诱变、遗传毒性和致癌作用尚不清楚,国际癌症研究中心(IARC)将其归为3 类致癌物质[7]。但是有人提出ZEN和人类的子宫颈癌和子宫内膜增生之间可能存在联系[8],另有学者[9,10]在中国发现,ZEN和食道癌可能有关系。虽然玉米赤霉烯酮及其衍生物和人类的潜在致癌性之间的联系仍然存在争议,但在实验室动物试验中,已取得其具有致癌性的有力证据[11]。
目前常用检测ZEN的方法有荧光光度计法[12]、气相色谱法[13]、高效液相色谱法[14]及液相色谱-串联质谱法[15]等,但这些技术都存在操作要求和成本偏高等问题。ELISA具有检测速度快,灵敏度高,可定量,操作简便,成本低等特点,已经被广泛应用于各种真菌毒素的快速检测。但ELISA方法中需要使用ZEN标准品合成人工抗原,由于ZEN对人体有危害性,而且其标准品价格昂贵,获取困难,所以开发出一种能模拟ZEN反应原性,能代替ZEN进行试验的无毒物质显得很有必要。本试验在何庆华等[16]研究的基础上,查询到ZEN模拟表位肽为DAVILLM,多肽对应碱基序列:GATGCTGTCATCCTGTTGATG。pC89是带有来源于f1噬菌体的gpⅧ、f1噬菌体的复制起点,以及在pMBI质粒基础上新添加两个酶切位点BamHⅠ和EcoRⅠ而的到的噬菌粒。gpⅧ较小,适合融合模拟表位这类较小的肽段,而且gpⅧ拷贝数极多,可达2 700个,在高密度表达方面具有明显的优势。pC89S4是改进的pC89,它在BamHⅠ与EcoRⅠ酶切位点之间引入XbaⅠ酶切位点,在酶切验证时更直观准确。通过构建pC89-CZEN表达载体,将含有玉米赤霉烯酮抗原表位基因的重组质粒转化大肠杆菌XL1-Blue感受态细胞,用KM13超感染后,纯化得到玉米赤霉烯酮抗原表位的噬菌体颗粒,结合ELISA测定方法,验证表达的模拟多肽的反应原性的同时检测其表达效果,以期开发出来可以代替ZEN标准品的无毒检测ZEN毒素的ELISA试验方法。
1 材料与方法
1.1 材料
大肠杆菌TG1、XL1-Blue(江西科技师范学院生命科学学院保存); pC89S4噬菌粒(第三军医大学免疫研究所万瑛教授惠赠);辅助噬菌体KM13(江西科技师范学院生命科学学院保存);限制性内切酶 EcoR I、BamH I、Xba I、T4 DNA 连接酶及PCR扩增套装(宝生物工程(大连)有限公司);质粒提取试剂盒、PCR纯化试剂盒(深圳Fermentas公司);DNA Marker(杭州爱思进生物公司);人工抗原BSA-GMBS-ZEN(本实验室合成);寡聚核苷酸单链T1、T2由上海Sangon合成并测序;辣根过氧化物酶标记羊抗鼠IgG(Sigma公司);ZEN抗体(南昌博恒生物工程公司);洗板机(Thermo公司);酶标仪(Thermo公司)。
1.2 方法
1.2.1 ZEN-PⅧ噬菌体展示载体的构建 ZEN模拟表位肽为DAVILLM,对应碱基序列:GATGCTGTCATCCTGTTGATG,考虑到原模拟表位是表达在pⅢ蛋白的N-末端[16],而PⅧ噬菌体展示载体表达的多肽在其N-末端会有部分前导肽表达。因此,在模拟表位前设计一肠激酶酶切位点(DDDDK),在表达后应用肠激酶酶切,可使模拟表位表达在pⅧ蛋白的N-末端。其对应碱基序列为:GACGACGACGACAAG,加上EcoR I和BamH I酶切位点接头,因此设计:
T1:5'- AATTCGACGACGACGACAAGGATGCT GTCATCCTGTTGATG-3',
T2:5'- GATCCATCAACAGGATGACAGCATCCT TGTCGTCGTCGTCG-3'。
将T1和T2加ddH2O分别配成20 nmol/mL 的寡聚核苷酸单链溶液,各取10 μL,混匀后置于PCR仪,99℃保温5 min后缓慢降至室温,-20℃保存。pC89S4噬菌粒5 μL,加入ddH2O 11 μL,酶切缓冲液2 μL,EcoR I和BamH I各1 μL,混匀后37℃双酶切2 h,按照PCR纯化试剂盒所述步骤纯化酶切产物。退火寡聚核苷酸链与质粒双酶切产物在T4DNA 连接酶作用下16℃连接8 h,乙醇沉淀法纯化。连接液全量电转化入大肠杆菌XL1-Blue感受态细胞,加入SOC培养基,37℃振荡培养1.5 h后涂布含50 μg/mL 氨苄青霉素的LB平板,37℃过夜培养。挑取单菌落用于扩增细胞,质粒提取试剂盒提取质粒。提取的质粒依次用Xba I、EcoR I和BamH I进行单酶切,时间2 h,之后用1.0%琼脂糖凝胶电泳观察。酶切验证为阳性的质粒采用M13-40引物测序。
1.2.2 敏感宿主菌的制备及辅助噬菌体的扩增
(1)将TG1接种至2 mL LB培养基中,37℃,220 r/min培养活化2次。活化后的菌液接种至加富M9培养基平板,37℃培养过夜。第2天于加富M9平板上挑取10个单菌落分别接种至2 mL LB(含40 μg/mL 四环素)中,培养至对数期。经过适度稀释的KM13噬菌体原液与对数期的TG1菌液混合,37℃静置水浴20 min后与顶层琼脂混匀,将顶层琼脂倾倒于LB平板,37℃培养过夜,观察噬菌斑,鉴定细菌对KM13噬菌体的敏感性。
(2)选择对KM13噬菌体敏感的细菌制备铺平板细菌。将敏感菌划线接种加富M9平板,37℃培养过夜。第2天挑取单菌落接种2 mL LB(含有终浓度40 μg/mL 四环素),37℃,220 r/min培养至对数早期。准备KM13噬菌体10-1至10-12稀释度的LB悬液,取10-8至10-12稀释度各10 μL与铺平板细菌混合均匀,37℃静置水浴20 min后与45℃温育的顶层琼脂快速混合倒于LB平板,37℃培养过夜。
(3)挑取一个完整噬菌斑接种至对数期的2 mL TG1菌液中,37℃,220 r/min培养1 h后将菌液转入20 mL LB(含40 μg/mL 四环素,40 μg/mL卡那霉素),37℃,220 r/min培养过夜。
1.2.3 辅助噬菌体提取纯化及滴度测定 过夜培养的菌液转移至50 mL离心管中,4℃,5 000 r/min,20 min离心去除细菌,上清加入总体积1/6的20% PEG8000,2.5 mol/L NaCl溶液,冰浴1 h。再4℃,10 000 r/min,20 min弃上清,沉淀用2 mL 50 mmol/L TBS(pH7.5)溶解后加入总体积1/6的20% PEG80-00,2.5 mol/L NaCl溶液,冰浴1 h。4℃,10 000 r/min,20 min弃上清,沉淀用2 mL 50 mmol/L TBS(pH7.5)溶解后4℃,10 000 r/min,5 min,收集上清液。
用LB培养基将收集到的上清液按梯度稀释为10-1-10-11,每个稀释度做3个重复。按照1.2.2的方法进行噬菌斑的计数,计算公式:
PFU(mL)=(噬菌斑数/接种噬菌体积) ×(1/噬菌体稀释度)
1.2.4 辅助噬菌体超感染及噬菌体展示模拟表位的提取纯化 将经测序鉴定成功的工程菌pC89-ekzen划线于LB平板(含50 μg/mL 氨苄青霉素,40 μg/mL 四环素),37℃培养过夜。第2天挑取取单菌落接种至20 mL LB培养基中培养至对数早期。通常OD600=2.0时,细菌密度约为1.6×109细胞/mL[17]。取1 mL菌液,按照感染复数为40加入已测定滴度的噬菌体后混匀[18],37℃静置20 min超感染;超感染后的菌液转入至60 mL LB液体培养基中,37℃,220 r/min培养至对数期;再加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG)继续24℃,220 r/min诱导表达[19]。
1.2.5 噬菌体展示模拟表位高效表达的ELISA检测 将提取纯化的表位噬菌体用50 mmol/L TBS(pH7.5)稀释至A280=0.3,稀释后的噬菌体每100 μL加入1 μL肠激酶,22℃,酶切16 h。酶切后的噬菌体用0.01 mol/L的PBS进行适当稀释,连接有BSA的5 μg/mL人工抗原ZEN-BSA作为阳性对照,0.01 mol/L的PBS作为阴性对照,每孔包被100 μL,37℃孵育2 h;以PBS-T20为清洗液,洗板机洗板3次,5%脱脂乳37℃下封闭1 h;PBS-T20洗板4次,每孔加入1:10 000的ZEN抗体100 μL,37℃孵育45 min;然后PBS-T20洗板4次,加入1∶3 000的辣根过氧化物酶标记的二抗100 μL,37℃孵育45 min;接着用PBS-T20洗板5次,TMB显色液显色10 min后加入50 μL 2 mol/L H2SO4终止反应,酶标仪测定450 nm处吸光值。
1.2.6 噬菌体展示模拟表位的表达优化
1.2.6.1超感染时菌体浓度OD600的优化 待菌体OD600分别达到0.2、0.4、0.6、0.8后加入感染复数为40的辅助噬菌体超感染,超感染后的菌液转入至60 mL LB液体培养基中,37℃,220 r/min培养至OD600为0.6,再加入IPTG至终浓度为1.0 mmol/L,24℃进行诱导表达8 h,提取纯化的表位噬菌体进行ELISA检测 。
1.2.6.2 加入IPTG诱导时菌体浓度OD600的优化 菌体OD600为0.4时加入感染复数为40的KM13超感染,超感染后的菌体加入至60 mL培养基,待菌体OD600分别达到0.2、0.4、0.6、0.8时,再加入IPTG至终浓度为1.0 mmol/L ,24℃进行诱导表达8 h,提取纯化的表位噬菌体进行ELISA检测。
1.2.6.3 IPTG终浓度的优化 菌体OD600为0.4时加入感染复数为40的KM13超感染,超感染后的菌体加入至60 mL培养基,37℃,220 r/min培养至OD600为0.6,再加入IPTG至终浓度为0.1、0.5、1.0、1.5 mmol/L,24℃进行诱导表达8 h,提取纯化的表位噬菌体进行ELISA检测。
1.2.6.4 表达温度的优化 菌体OD600为0.4时加入感染复数为40的KM13超感染,超感染后的菌体加入至60 mL培养基,37℃,220 r/min培养至OD600为0.6,再加入IPTG至终浓度为1.0 mmol/L,分别于24℃和37℃进行诱导表达8 h,提取纯化的表位噬菌体进行ELISA检测。
1.2.6.5 诱导表达时间的优化 菌体OD600为0.4时加入感染复数为40的KM13超感染,超感染后的菌体加入至60 mL培养基,37℃,220 r/min培养至OD600为0.6,再加入IPTG至终浓度为1.0 mmol/L,于24℃进行诱导表达4、6、8、10 h,提取纯化的表位噬菌体进行ELISA检测。
2 结果
2.1 ZEN-PⅧ噬菌体展示载体的构建
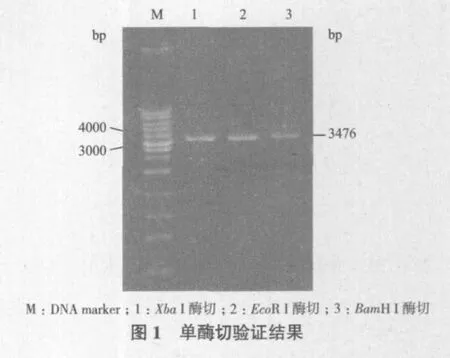
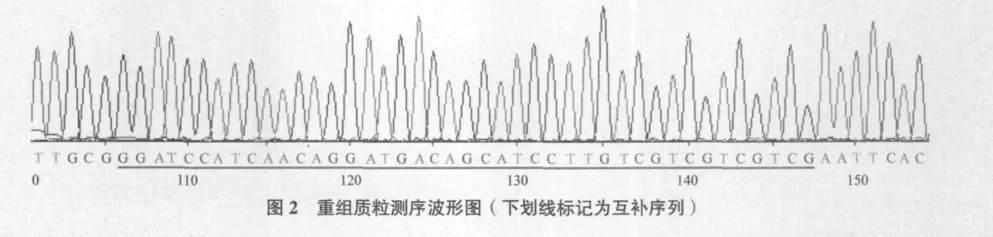
退火寡聚核苷酸链与质粒双酶切产物连接纯化后,电转化入大肠杆菌XL1-Blue感受态细胞。从单菌落扩增出来的细胞中提取重组质粒后,用Xba I、EcoR I和BamH I进行单酶切。pC89S4具有两个Xba I酶切位点,相距147 bp,经Xba I酶切后能产生两段大小不同的片段。但重组质粒中插入的目的片段取代了一个Xba I酶切位点,因此3种酶都只有一个酶切位点。由图1可知,重组质粒经过Xba I、EcoR I和BamH I酶切之后都能得到同等大小的单一条带,说明质粒可能是重组质粒。重组质粒经过测序,结果显示其序列与预期一致,证明表达载体pC89-CZEN构建成功,如图2。
2.2 辅助噬菌体滴度测定
经平板计数,稀释度为10-8时噬菌斑平均大于300个,10-9时平均为67个,10-10时平均为8个,因此选取稀释度为10-9进行计算:
KM13滴度= (噬菌斑数/接种噬菌体体积)× (1/噬 菌 体 稀 释 度) = (67/0.01) × (1/10-9) =6.7×1012/mL
2.3 噬菌体展示模拟表位的表达优化
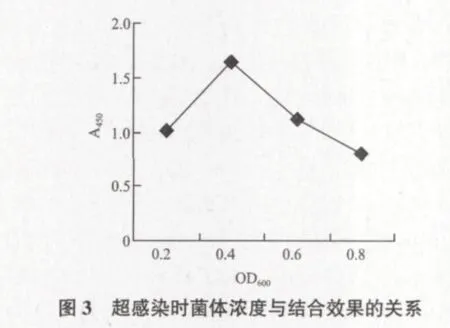
2.3.1 超感染时菌体浓度OD600的优化 由图3可知,当菌体浓度OD600为0.4时进行超感染,提取的ZEN模拟表位肽与抗体结合后的A450值最高。
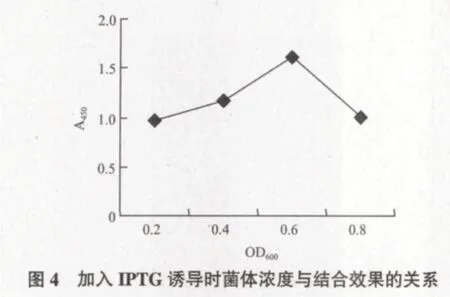
2.3.2 加入IPTG诱导时菌体浓度OD600的优化 由图4可知,加入IPTG诱导表达的效果随菌体浓度的上升有所增加,但不是很明显,至OD600为0.6时最高,随后降低。
2.3.3 IPTG终浓度的优化 由图5可知,随着IPTG终浓度的提高,A450也随之提高,但不是很明显。当终浓度为1.5 mmol/L时,A450下降较快,是由于IPTG 对细胞存在毒性,浓度过高时会抑制细菌的生长。
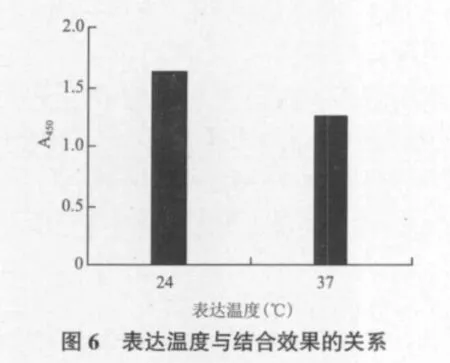
2.3.4 表达温度的优化 由图6可知,虽然37℃为大肠杆菌的最适生长温度,但在此温度下表达的模拟表位与抗体的结合效果却不如24℃,说明在24℃时更利于模拟表位的表达。

2.3.5 诱导表达时间的优化 由图7可知,随着诱导表达时间的延长,结合效率不断提高,到8 h后基本不变,出于节约时间成本的目的,选择诱导为8 h。

2.4 肠激酶酶切对抗体结合效果的影响
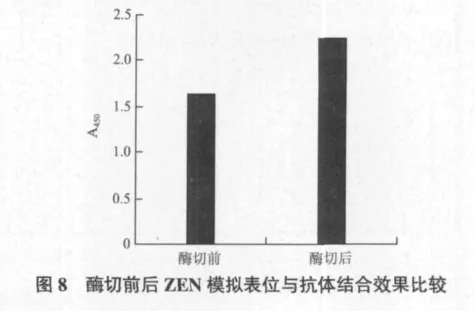
纯化后的噬菌体展示模拟表位经酶切后与未酶切的同样进行ELISA测定。经酶切与未酶切的噬菌体展示模拟表位与抗体的结合结果比较如图8。从图8可以看出,酶切后的结合效果明显高于酶切前。
3 讨论
本试验采用的是丝状噬菌体展示系统,在丝状噬菌体展示系统中,主要的展示蛋白是pⅧ和pⅢ蛋白。用于丝状噬菌体展示的载体主要有噬菌体载体和噬菌粒载体。噬菌粒是带有丝状噬菌体复制起点的质粒。pC89S4就是在具有ColE1复制起点及氨苄青霉素抗性选择标记的质粒上再加上单拷贝的丝状噬菌体主要基因间隔区。克隆于pC89S4内的T1T2片段,可以像质粒一样用常规方法进行增殖。而当带有重组质粒的XL1-Blue被KM13辅助噬菌体超感染后,在病毒的基因Ⅱ蛋白影响下,质粒的复制方式发生改变。基因Ⅱ产物与质粒所携带的基因间隔区相互作用,启动滚换复制,以产生质粒DNA一条链的拷贝。这些质粒DNA的单链拷贝经切割产生切口,然后环化,最后被包装进子代噬菌体颗粒中,进而将目的多肽展示在噬菌体表面。
本研究在成功构建pC89-CZEN噬菌粒载体的基础上,对3个表达条件进行了优化。发现菌体处于对数前期时,更利于辅助噬菌体的吸附侵染。IPTG是一种十分有效的乳糖操纵子的诱导剂,可与阻遏蛋白结合成复合物,而使阻遏蛋白构象发生改变,阻遏蛋白就不能结合到大肠杆菌中的Lac 启动子上,从而使乳糖操纵子能够被转录,诱导蛋白的表达。IPTG诱导的效果与菌体的状体和自身的浓度有很大关系。在对数期时,生长代谢旺盛,对一切诱导药物和环境因素的作用最为敏感,若加入时间过早,可能会抑制宿主菌的生长,加入太迟,菌体已成熟,菌体内各种酶的合成能力降低,表达量也减少[20]。IPTG的使用量也有要求,IPTG 具有细胞毒性,浓度过高时会抑制细菌的生长,进而降低蛋白的表达。在进行低温24℃表达时,更有利于融合蛋白的可溶性蛋白表达及向胞外分泌,37℃时更多地以包涵体的方式表达。诱导表达8 h后,噬菌体量达最大,对应的模拟表位肽的量也达到最大,时间再延长基本不变。
pC89S4所表达的外源片段其N-末端残留有5肽。本实验室在研究中发现ZEN模拟表位N-末端的5肽影响了ZEN抗体与模拟表位的结合。为解决这一问题,在ZEN模拟表位5'端引入了肠激酶酶切位点,构建出噬菌粒pC89-CZEN。肠激酶可沿序列的羧基端切下。成熟的ZEN模拟表位-pⅧ融合蛋白经肠激酶酶切后,ZEN模拟表位暴露出来,提高了与抗体的结合几率,为后续建立无毒ELISA方法检测真菌毒素打下了基础。
4 结论
本试验成功构建了噬菌粒pC89-CZEN,利用此载体实现了ZEN模拟表位在噬菌体表面的成功展示。展示有ZEN模拟表的噬菌体纯化方法简单。ELISA检测证实ZEN模拟表位-pⅧ融合蛋白具有良好的反应原性。
[1] Gaumy JL, Bailly JD, Burgat V, Guerre P. Zearalenone:Proprietes et toxicite experimentale[J]. Revue Medecine Veterinaire, 2001, 152(3):219-234.
[2] Moss MO. The environmental factors controlling mycotoxin formation[J]. International Journal of Food Microbiology, 2005, 98(3):223-231.
[3] Bennet GA, Shotwel OL. Zearalenone in cereal grains[J]. Journal of American Oil Chemists Society, 1979, 56(24):812-819.
[4] Caldwell RW, Tuite J, Stob M, Baldwin R. Zearalenone production by Fusarium species[J]. Applied Microbiology, 1970, 20:31-34.
[5] Zinedine A, Brera CB, Elakhdari S, et al. Natural occurrence of mycotoxins in cereals and spices commercialized in Morocco[J]. Food Control, 2006, 17:868-874.
[6] Verbcheva T, Gebler R, Ulesber E, Erwin M. First survey on the natural occurrence of Fusarium mycotoxins in Bulgarian wheat[J]. Mycopathologia, 1996, 136(279):47-52.
[7] International Agency for Research on Cancer(IARC).Overall evaluations of carcinogenicity to humans. Monographs on the evaluation of carcinogenic risk to humans, IARC monographs[J]. Lyon:IARC, 1999, 1:1-36.
[8] Tomaszewski J, Mitursky R, Semczuk A, et al. Tissue zearalenone concentration in normal, hyperplastic, and neoplastic human endometrium[J]. Ginekologia Polska, 1998, 69:363-366.
[9] Gao HP, Yoshizawa T. Further study on Fusarium mycotoxins in corn and wheat from a high-risk area for human esophageal cancer in China[J]. Mycotoxins, 1997, 45:51-55.
[10] Luo Y, Yoshizawa T, Katayama T. Comparative study on the natural occurrence of Fusarium micotoxins( trichothecenes and zearalenone )in corn and wheat from high-and low-risk areas for human esophageal cancer in China[J]. Applied and Environmental Microbiology, 1990, 56:3723-3726.
[11] Battershill JM, Fielder RJ. Mouse-specific carcinogens:an assessment of hazard and signification for validation of short-termcarcinogenicity bioassays in transgenic mice[J]. Human and Experimental Toxicolology, 1998, 17:193-205.
[12] Navarro-Villoslada F, Urraca JL, Moreno-Bondi MC. Zearalenone sensing with molecularly imprinted polymers and tailored fluorescent probes[J]. Sensors and Actuators B: Chemical, 2007, 121(1):67-73.
[13] Toshitsugu T, Atsushi Y, et al. Simultaneous determination of trichothecene mycotoxins and zearalenone in cereals by gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2000, 882(1):23-28.
[14] De Saeger S, Sibanda L, Van Peteghem C. Analysis of zearalenone and α-zearalenol in animal feed using high-performance liquid chromatography[J]. Analytica Chimica Acta, 2003, 487(2):137-143.
[15] Berthiller F, Schuhmacher R, Buttinger G, Krska R, Rapid simultaneous determination of major type A- and B-trichothe-cenes as well as zearalenone in maize by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2005, 1062(2):209-216.
[16] 何庆华, 刘仁荣, 许杨.利用噬菌体肽库淘选玉米赤霉烯酮的模拟表位[J].食品科学, 2007(8):241-243.
[17] Sambrook J, Fritsch EF, Maniatis T .Molecular cloning a Laboratory Manual[M]. 2nd ed. New York:Cold Spring Harbor Laboratory Press, 1989:127.
[18] Kang AS, Barbas CF, Janda JD, et al. Linkage of recognition and replication functions by assembling combinatorial antibody Fab libraries along phage surfaces[J]. PNAS, 1991, 88(10):4363-4366.
[19] Wan Y , Wu YZ, Bian J, et al. Induction of hepatitis B virusspecific cytotoxic T lymphocytes response in vivo by filamentous phage display vaccine[J]. Vaccine , 2001, 19(20):2918-2923.
[20] 陈卫, 葛佳佳, 张灏, 丁霄霖.半乳糖苷酶基因在大肠杆菌中过量表达及IPTG诱导条件[J].无锡轻工大学学报, 2002(5):492-495.
