应用基因芯片分析植物内生菌醇提取物处理条件下水稻的基因表达图谱
2013-12-23肖军杨涛杨镇王红王丽萍陈珣肇莹王娜龚娜
肖军 杨涛 杨镇 王红 王丽萍 陈珣 肇莹 王娜 龚娜
(辽宁省农业科学院微生物工程中心,沈阳 110161)
内生菌醇提取物RD为辽宁省农科院微生物工程中心经过多年潜心研究开发出来的新一代植物生长调节剂,来源于人参和越橘内生菌的醇提取物。施用微量即可有效促进水稻的营养生长,提高水稻对氮肥的利用效率[1],增强水稻的抗病性。内生菌醇提取物RD对水稻的作用机制复杂,机理仍不明确,已成为制约其应用的障碍。为了全面认清内生菌醇提取物RD对水稻的作用机制,仅仅对单个基因的功能进行研究显然是不够的,还需要从整个基因组水平上了解水稻的基因表达在内生菌醇提取物RD处理后是如何变化的,哪些基因在此过程中真正起作用。要从整个基因组水平上研究内生菌醇提取物RD的作用机制,成为当前破解内生菌醇提取物RD促进水稻生长、增强抗病性机理的关键。
基因芯片技术是近年来发展起来的基因组整体研究技术,它是功能基因组学研究的重要技术之一[2,3],被广泛应用于分析特定生物过程中基因表达的全面信息[4-6]。该技术可以同时分析成千上万个基因,所得的数据可直接用于基因功能的研究。这样就可在转录水平上灵敏、完整地给出细胞或组织样本的一系列生理状态的分析结果,寻找和鉴定特异性相关基因,是从分子水平上揭示植物生理机制的一项基础性研究。
本研究旨在利用基因芯片手段,检测内生菌醇提取物RD处理水稻根部后基因差异表达,探讨内生菌醇提取物RD能够促进水稻生长、增强水稻抗病性的作用机制,为这种纯天然、绿色的植物生长调节剂广泛应用于水稻提供理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 水稻品种辽星一号,由辽宁省农业科学院稻作所提供。
1.1.2 内生菌醇提取物 内生菌醇提取物RD由辽宁省农业科学院微生物工程中心提供。
1.2 方法
1.2.1 材料处理 水稻辽星一号种子用0.1% HgCl消毒10 min,无菌水冲洗3遍,25℃浸种至水稻露白,沙培培养7 d。将培养7 d的水稻根部浸于浓度为50 ng/mL RD水溶液中,24 h后取出,以无菌水处理为对照,水中再培养24 h。取水稻幼嫩的根部立即投入液氮速冻,然后置-70℃超低温冰箱保存。
1.2.2 总RNA提取 根据Trizol(宝生物公司)说明书分别提取内生菌醇提取物RD处理和对照的水稻根系总RNA,用0.8%甲醛变性琼脂糖凝胶进行电泳,检测总RNA中28S rRNA和18S rRNA比例,以检测RNA样品的质量。用紫外分光光度计检测RNA的含量和浓度。
1.2.3 对样品RNA进行荧光标记 采用博奥公司晶芯cDNA扩增标记试剂盒,对样品RNA进行荧光标记。本研究使用Cy3、Cy5 进行双色荧光标记,其激发波长和发射波长分别为550 nm/570 nm和649 nm/670 nm。通过探针样本与芯片上饱和cDNA之间的竞争性杂交,将样本之间的杂交信号对比,即基因间的差异表达用数值表示出来。芯片由北京博奥生物芯片公司制备。对提取的总RNA,采用RNeasy MinElute Cleanup Kit(Qiagen公司)纯化总RNA,利用One-cycle cDNA Synthesis Kit(Affymetrix公司)合成dscDNA,并用GeneChip Sample Cleanup Module(Affymetrix公司)纯化该cDNA。按照GeneChip IVT Labeling Kit说明书制备生物素标记的cRNA,于94℃保温35 min后进行片段化处理,并作为杂交探针用于基因芯片分析。
1.2.4 基因芯片杂交 用于杂交的基因芯片为Affymetrix公司的Rice Genome Array,产品编号:AFF-900599,芯片覆盖约51 279个转录本,代表两种水稻品系,大约48 564个Japonica品系转录本和1 260个Indica品系转录本。序列信息来源于GenBank mRNAs,TIGR基因预测和国际水稻基因组序列计划。NCBI UniGene Build #52(May 7,2004),GenBank预测基因,TIGR Os1 v2 data set.(ftp.tigr.org FASTA,89.3 MB)。
内生菌醇提取物RD处理和对照的水稻根部总RNA与芯片杂交,取适量cRNA与试验芯片(experimentalchip)在45℃的Affymetrix杂交箱640中,60 r/min旋转杂交16 h。在Affymetrix公司Genechip fluidics station洗涤工作站450中进行洗脱和染色。用Affymetrix公司GeneChip Scanner3000高分辨率扫描仪对染色后的芯片进行扫描,利用Affymetrix GeneChip Operating Software Version1.4软件对芯片扫描所得数据进行计算和处理。
1.2.5 基因芯片的数据处理 采用Robust Multichip Analysis(RMA)归一化方法,检测水稻样品中每个基因(probe set)的信号值;用P、A、M表示Probe Set的检测状态:P(Present)存在、A(Absent)不存在、M(Marginal)临界值。并删除了荧光信号弱的基因以及芯片上的阴性对照、内标、外标等冗余数据。在比较分析两组杂交结果时,取内生菌醇提取物RD处理水稻样本和对照样本同一个基因转录产物的表达水平(信号值)进行比值计算,以上调或下调2倍标准筛选差异表达基因,即Ratio≥2.0和≤0.5。再用晶芯生物分子功能注释系统(Capital-Bio Molecule Annotation System,MAS)对筛选的差异表达基因进行分析,并注释差异表达显著的基因功能。
2 结果
2.1 水稻总RNA质量检测
在基因芯片杂交中,RNA的质量直接影响标记效率和试验的成功率。本研究选取水稻培养7 d的幼嫩根尖,用Trizol法提取其总RNA。用0.8%甲醛变性琼脂糖凝胶电泳检测,结果(图1)显示,RNA完整性较好,电泳条带清晰,28S rRNA比18S rRNA条带亮度大于11,A260/A280的吸光度比值均在1.86-1.93之间(表1),RNA的质量符合后续芯片试验要求。
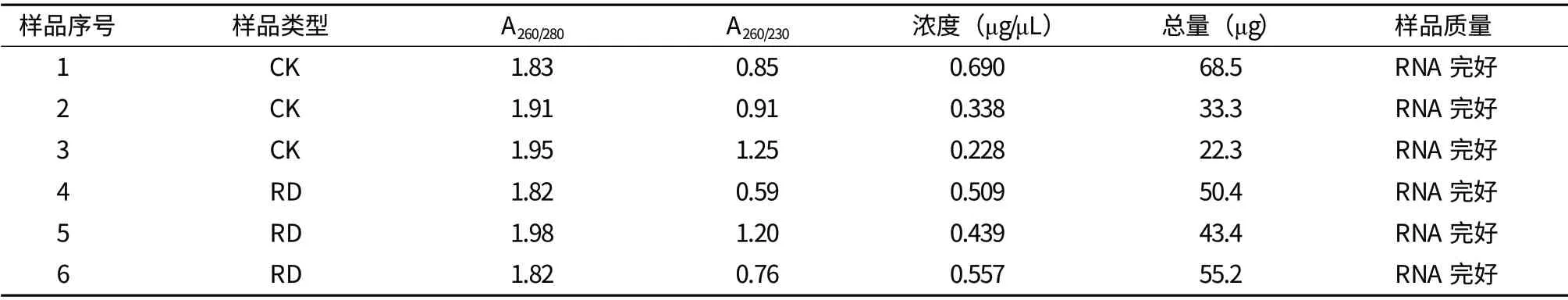
表1 内生菌醇提取物RD处理水稻和对照总RNA
2.2 芯片杂交结果统计
提取内生菌醇提取物RD处理水稻和对照试验的荧光数据,校正后将两张荧光交换的数据进行整合做散点图,通过散点图可以比较直观地看出在两个样品之间基因表达的差异情况。其中X 轴和Y 轴分别以两个样品的荧光信号强度值为坐标,图2中每一个数据点代表芯片上一个基因点的杂交信号,上调基因、下调基因及表达基本无差异的基因如图中所示。以芯片荧光信号对数值(signal log2ratio)>2以及<0.5为阈值,筛选表达量变化在2倍以上基因,由图2可以看出试验中的数据点大多数集中在0.5

2.3 差异表达基因的功能注释
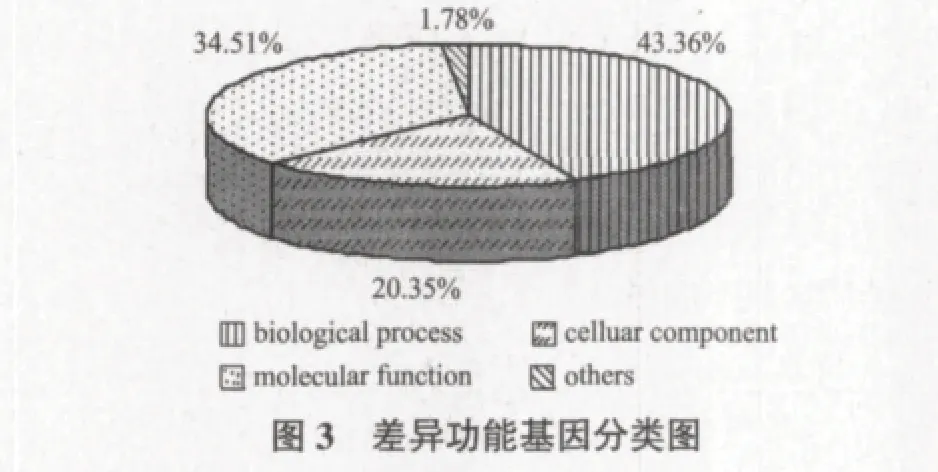
根据基因芯片的试验结果,采用晶芯生物分子功能注释系统V3.0(MAS)和数据库查询,对内生菌醇提取物RD处理获得的1 171个差异表达基因进行功能注释(图3)。其中43.36%基因参与各种生物学过程(biological process);20.35%基因与生成各种细胞组分(celluar component)有关;34.51%基因编码产物则与执行各种分子功能(molecular function)有关。1.78%与GenBank中功能未知序列(others)相对应,这些基因在内生菌醇提取物RD对水稻的促进生长中所起的作用还需进一步研究。差异表达基因的分子功能又归纳为22个功能类群(图4),主要为生理功能、结合功能、刺激应答、转录调控、生殖过程、代谢功能。说明内生菌醇提取物RD处理影响基因的表达不是某个基因孤立、单一的,而是多方面、多层次共同作用的结果。表2中列举了基因表达量变化较大的重要基因及其功能描述。

2.4 代谢途径的变化情况
采用晶芯生物分子功能注释系统V3.0(MAS)中pathway注释系统,利用kegg数据库查询,对内生菌醇提取物RD处理后引起水稻代谢途径的改变进行分析。内生菌醇提取物RD处理后代谢途径的变化存在明显差异,表达量上调的代谢途径数量多于下调的数量。图5进行了表达量上调和下调的代谢途径比较,期中表达量上调代谢途径39条,表达量下调代谢途径24条。
3 讨论
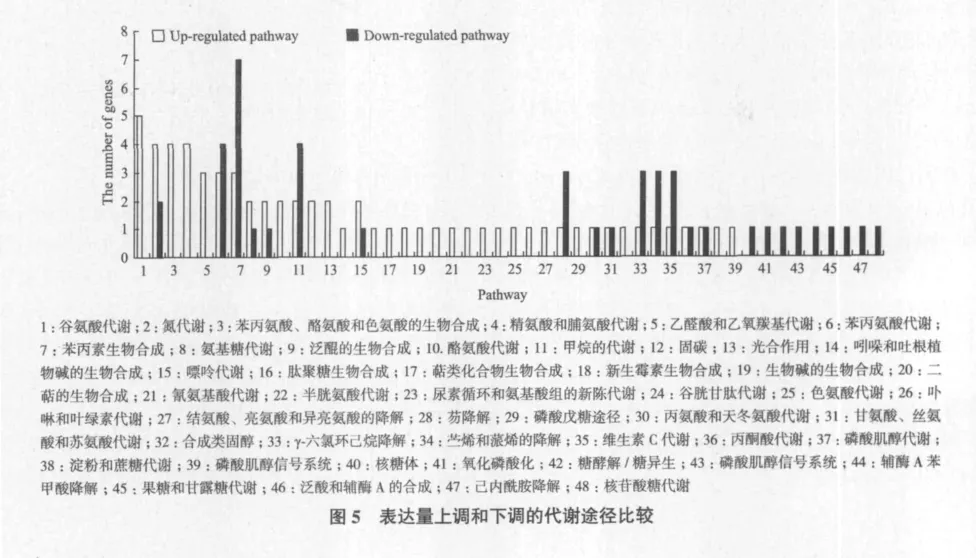
代谢是作物最基本的生命活动过程。内生菌醇提取物RD处理水稻后涉及的代谢途径非常复杂。图5表明,其中表达量上调最为明显的代谢途径有谷氨酸代谢、氮代谢、苯丙氨酸、酪氨酸和色氨酸生物合成、精氨酸、脯氨酸代谢、乙醛酸和二羧酸代谢、酪氨酸代谢等,光合作用是作物生产最基本
的生理过程之一,也是重要的生物合成过程,植物干物质90%以上是通过光合作用合成的,因此是栽培作物产量形成的基础,也是碳代谢的一个重要部分。氮代谢为碳代谢提供酶和光合色素,影响着作物光合同化潜力。谷氨酸代谢、脯氨酸代谢、乙醛酸和二羧酸代谢、酪氨酸代谢等为参与保护、防御和胁迫耐受相关的代谢途径。苯丙氨酸、酪氨酸、色氨酸生物合成对植物蛋白质、信息素、抗氧化剂和木质素等生物质的合成非常重要。

表2 部分差异表达基因
基因表达分析的基础是基因在生命活动过程中有许多变化,由于基因表达与功能特异性一致,因而能够根据基因功能在某个特定生理阶段的上调和下调变化来推导基因功能[7]。图4表明,具有催化活性、代谢功能、细胞过程、生理过程、细胞器分子功能的上调差异表达基因数量远高于下调差异表达基因。表2中列举了基因表达显著上调和下降Ratio>5和Ratio<0.25的部分基因,期中上调最大的基因Ratio=29.09,水稻铁载体基因OslRT1[8],是ZIP基因家族的一种[9],Fe(Ⅱ)转运蛋白作为一种质膜蛋白,在将膜外的Fe(Ⅱ)转运至胞质中起关键作用,它与Fe(Ⅲ)-螯合物还原酶共同完成植物对铁素的吸收[10,11]。草酸氧化酶(oxalate oxidase)又称萌发类似蛋白(germin-like protein),冯洁等[12]研究推断水稻中草酸氧化酶抗病反应中的作用可能与麦类作物中的草酸氧化酶相似。细胞色素P450是一类以还原态与CO结合后在波长450 nm处有吸收峰的含血红色素的多功能氧化酶[13]。目前,已从111种植物中获得1 052个植物细胞色素P450基因,部分P450基因功能已得到鉴定[14]。P450在植物体中具有生物合成和代谢解毒两大功能,其中一些能催化结构抗病物质(如木质素、角质层和树脂)、植保素(如异黄酮和甜椒素)、毒素(即杀虫剂,如生氰糖苷和丁布)、胁迫信号物质(茉莉酸、创伤激素和Divinyl ethers)的合成,从而在植物防御反应中发挥重要的作用[15]。硝酸还原酶(Nitrate reductase)是植物NO3-同化的关键酶,植物体内硝酸还原酶活力(NRA)的高低直接影响介质中NO3-的利用,被作为作物的营养指标之一[16]。许多研究已经表明,几丁质酶(Chitinase)在植物体内的诱导与积累,对于增强植物防卫能力发挥着重要作用[17]。
4 结论
本研究应用基因芯片技术检测来源于野生植物内生菌的醇提取物RD对水稻基因表达差异影响,获得了差异表达基因1 171个,期中上调基因671个,下调基因500个。其中43.36%基因参与各种生物学过程;20.35%基因与生成各种细胞组分有关;34.51%基因编码产物则与执行各种分子功能有关。这些差异表达基因参与了多个生物学过程,包括各种生理过程、生殖过程、刺激应答、代谢功能、生物调节等。采用GO注释系统上调表达基因分为20种生物功能,影响39条代谢通路,下调表达基因分为21种生物功能,影响24条代谢通路。
[1] 肖军, 肇莹, 杨涛, 等.内生真菌提取物对水稻N肥利用率的影响[J].江苏农业学报, 2012, 28(1):72-75.
[2] 杨明星, 高志贤, 王升启.基因芯片及其应用[J].传感器技术, 2002, 21(6):54-58.
[3] Schena M, Shalon D, Davis RW, et al. Quantitative monitoring of gene expression patterns with a complementary DNA microarray[J]. Science, 1995, 270:467-470
[4] 杜士云, 阳菁, 王守海, 等.应用基因芯片分析短日低温条件下新型粳稻光温敏核质互作不育系育性相关基因[J].中国水稻科学, 2010, 24(6):559-566.
[5] Yowe D, Farlow D, Zora JM, et al. Using microarrays for studying the host transcriptional response to microbial infection[J]. Methods in Microbiology, 2002, 32:157-168.
[6] Delseny M, Salses J, Cook R, et al. Rice genomics:Present and future[J]. Plant Physiol Biochem, 2001, 39(3-4):323-334.
[7] Lorkowski S, Cullen PM. Analysing gene expression:A handbook of methods possibilities and pitfalls[M]. New York:John Wiley and Sons, 2003.
[8] Bughio N, Yamaguchi H, Nishizawa NK, et al. Cloning an iron regulated metal transporter from rice[J]. J Exp Bot, 2002, 53(374):1677-1682.
[9] 韩艳, 李争艳, 岳修乐, 等.徐世健.高山离子芥铁转运蛋白基因编码序列的克隆及其抗逆性表达的实时定量分析[J].中国生物化学与分子生物学报, 2008(6):549-555.
[10] Holden MJ, Luster DG, Chaney RL, et al. Fe(Ⅲ)chelate reductase activity of plasma membranes isolated from tomato(Lycopersicon esculentum Mill.)roots:comparison of enzymes from Fe-deficient and Fe-sufficient roots[J]. Plant Physiol, 1991, 97(2):537-544.
[11] Robinson NJ, Procter CM, Connolly EL, et al. A ferric-chelate reductase for iron uptake from soils[J]. Nature, 1999, 397(6721):694-697.
[12] Feng J, Makoto T. Identification of rice oxalate oxidase in defence system against rice blast[J]. Journal of Agricultural Biotechnology, 2004, 12(3):312.
[13] 冷欣夫, 邱星辉.细胞色素P450酶系的结构、功能与应用前景[M].北京:科学出版社, 2001.
[14] 戴素明, 周程爱, 谢丙炎, 等.细胞色素P450表达在植物防御反应中的作用[J].石河子大学学报, 2004(z1):184-187.
[15] Morant M, Bak S, Moller BL, Werck-Reichhart D. Plant cytochromes P450:tools for pharmacology, plant protection and phytoremediation[J]. Current Opinion in Biotechnology, 2003, 14(2):151-162.
[16] 张瑞珍, 张恩和, 孙长占.不同基因型玉米品种氮素营养效率差异的研究[J].吉林农业大学学报, 2003, 25(2):183-186.
[17] Bol JF, Linthorst HJ, Comelissen BJ. Plant pathogenesis-related proteins induced by virus infection[J]. Ann Rev Phytopathol, 1990, 28:113-138.
