原油微生物群落构成及降解菌降解特性的研究
2013-12-23王中华梁静儿杨建强周君李成华李太武
王中华 梁静儿 杨建强 周君 李成华 李太武,3
(1. 宁波大学海洋学院,宁波 315211;2.国家海洋局北海分局,青岛 266033;3.宁波城市职业技术学院,宁波 315100)
溢油事故发生后,原油中某些相对分子质量小,沸点低的烃类组分,数日后可挥发进入大气,占绝大多数的沸点高的烃类组分的化合物随海水运动而扩散转移。自然条件下,这些物质一部分由悬浮颗粒吸附沉降于海底或者被浮游生物所摄取、代谢和分解,而大部分则被微生物降解。目前,处理原油污染主要有物理法,如用抽吸机吸油,用水栅和撇沫器刮油、燃烧除油以及用油缆阻挡石油扩散等;化学法,如喷洒化学药剂使石油加速分解等。然而,当溢油事故发生于近海,漂浮的原油会附着于沙滩,近海岩礁等,甚至会渗透到表面以下几米的地方,普通的物理化学法难以从根本解决问题。而生物法以其处理成本低、效果好等优点被认为是有机污染物修复中最有效和可靠的方法[1]。原油在开采和运输中的附着微生物,适应恶劣生存条件,能够以原油为碳源进行新陈代谢,这也是原油降解微生物的重要来源。
国内外学者已从海洋、油污染土壤当中获得了多株高效高效原油降解微生物[2-5],不同降解微生物对原油组分的降解能力不同。16S rDNA 技术的研究,更好地揭示了原油当中微生物群结构及其遗传的多样性,原油中微生物的组成,并能够为原油降解菌的筛选提供菌种来源。
烃类物质是石油的主要组分,约占石油总量的95%以上,包括正构烷烃、异构烷烃、环烷烃和芳香烃等[6]。对这些组分的研究能够在一定程度上揭示原油的降解过程和特性。本研究采用直接向原油中添加营养物质的方法,在营养物的刺激下活化原油中原有的微生物,对原油降解菌进行分离纯化,通过红外光谱以及气相色谱研究原油的降解过程以及降解菌的降解特性,通过紫外吸收法对其降解率进行分析。
1 材料与方法
1.1 材料
试验用原油取自于宁波港原油运输船金色大地油轮,采集后放入无菌瓶中。海水培养基:牛肉膏3 g,蛋白胨5 g,陈海水1 L,自然pH。原油培养基:海水培养基加0.3%原油,自然pH。油平板:海水培养基加入2.0%的琼脂和0.3%的原油,自然pH。降解培养基:(NH4)2SO40.5 g,NaNO30.5 g,CaCl20.02 g,MgSO40.2 g,KH2PO41.0 g,NaH2PO4·H2O 1.0 g,原油1.0 g,蒸馏水1 000 mL,pH值7.0。
1.2 方法
1.2.1 原油的微生物降解 海水培养基灭菌后加入0.3%原油,37℃、170 r/min条件下摇床培养,得到原油乳化物和细菌的混合体系后,立即进行红外光谱扫描和气相色谱分析。
降解菌体系群转接3次,使其中能够降解石油的微生物得到富集并成为优势菌。将所获得的石油降解菌体系按不同的浓度梯度涂布于含有0.3%的石油的固体平板上,37℃培养24 h,挑取生长在油斑上的菌落,划线法进行纯化。纯化后的单菌落接种到原油培养基,原油降解后立即进行红外光谱扫描和气相色谱分析。
1.2.2 红外光谱法检测原油的降解 以环己烷为萃取剂,近红外谱图测定范围4 000-1-10 000 cm-1,中红外谱图测定范围400-1-4 000 cm-1,扫描次数40次,分辨率8 cm-1,扫描扣除H2O和CO2的干扰,每个样品谱图取5次测量的平均值。调用OPUS 软件(Bruker公司,Germany)进行谱图处理。
1.2.3 气相色谱法检测原油的降解
1.2.3.1 气相色谱条件的确定 GC-2010气相色谱仪(岛津公司,日本),配用FID 检测器,HP-5 石英毛细管柱(30 m ×0. 32 mm ×0. 25 μm)。根据有关资料并结合本仪器的具体情况,经反复比较试验,确定以下试验条件所得结果较理想:进样口温度:280℃,分流比:1/ 1.5,检测器温度:300℃,载气:高纯N2,氢气压力:100 kP,空气压力:156 kP,柱流速:2.75 mL/min。升温程序:初温60℃(保持1 min),从60℃升至100℃(升温速度20℃/ min,保持2 min),从100℃升至280℃(升温速度8℃/ min,保持12 min)。采用GC-2010自动进样器,进样量为1 μL,无分流进样。
1.2.3.2 烷烃标准曲线的确定 准确称取烷烃标准物,用石油醚定容,配成终浓度分别为2、4、6、8、10 mg/mL的烷烃标准液,进行气相色谱分析,确定烷烃标准物保留时间出峰位置,并绘制浓度与峰面积的标准曲线。
1.2.4 原油降解率的测定 将原油溶于石油醚绘制原油标准曲线,采用紫外分光光度法结合公式通过残油浓度[10]来计算原油降解率。计算公式:
降解率(%)=(初始原油浓度-残余原油浓度)/(初始原油度)×100%
1.2.5 降解菌体系微生物多样性分析 提取细菌总 DNA具体步骤参考文献[7]。以所提 DNA 为模板,采用细菌 16S rDNA扩增通用引物16s F:(5'-AGAGTTTGATCCTGGCTCAG-3')和16s R:(5'-CCGTCAATTCCTTTGAGTTT-3')为引物,进行PCR扩增。反应体系:10×buffer 2.5 μL,25 mmol/L MgCl22.5 μL,模板DNA 稀释100倍1 μL,2.5 mmol/L dNTPs 2 μL,10 μmol/L引物各1 μL,1.0 U/反应Taq DNAase,ddH2O补 足 至25 μL。PCR扩 增 条 件 为:95℃预 变 性5 min;94℃变性45 s,55℃退火45 s,72℃延伸1 min,35个循环;72℃延伸10 min。PCR扩增产物用试剂盒回收纯化后与 PMD18- Tvecter载体连接,转化大肠杆菌转化大肠杆菌DH5α,构建构建 16S rDNA文库。
1.2.6 降解菌的鉴定 (1)降解菌的分子生物学鉴定:将原油降解混合体系梯度稀释后涂布于油平板,挑取生长在油上的单菌落,多次划线进行纯化后通过16S rDNA鉴定,PCR方法同1.2.5。结果输入GenBank数据库,与数据库中序列进行比较分析。(2)细菌自动鉴定系统鉴定:根据皂化作用提取降解率最高的2株细菌细胞脂肪酸甲酯,利用细菌自动鉴定系统软件,将细胞脂肪酸甲酯的峰形图与各微生物的模式图进行比较分析以鉴定细菌的分类地位。
2 结果
2.1 原油的降解分析

对原油富集培养产物进行观察后发现,细菌大量生长使培养基浑浊,第 7天原油产生乳化现象,部分原油乳化后进入培养基。到第 21天,原油几乎全部乳化成絮状物,此时培养基由澄清淡、黄色、不透明变为深褐色,浑浊、不透明(图1)。
对原油进行全波长扫描分析后,可见被测石油在波长225 nm 处有明显的吸收,故试验采用225 nm 作为测定波长。根据公式利用UV法测得这些细菌对原油的降解率为58%。
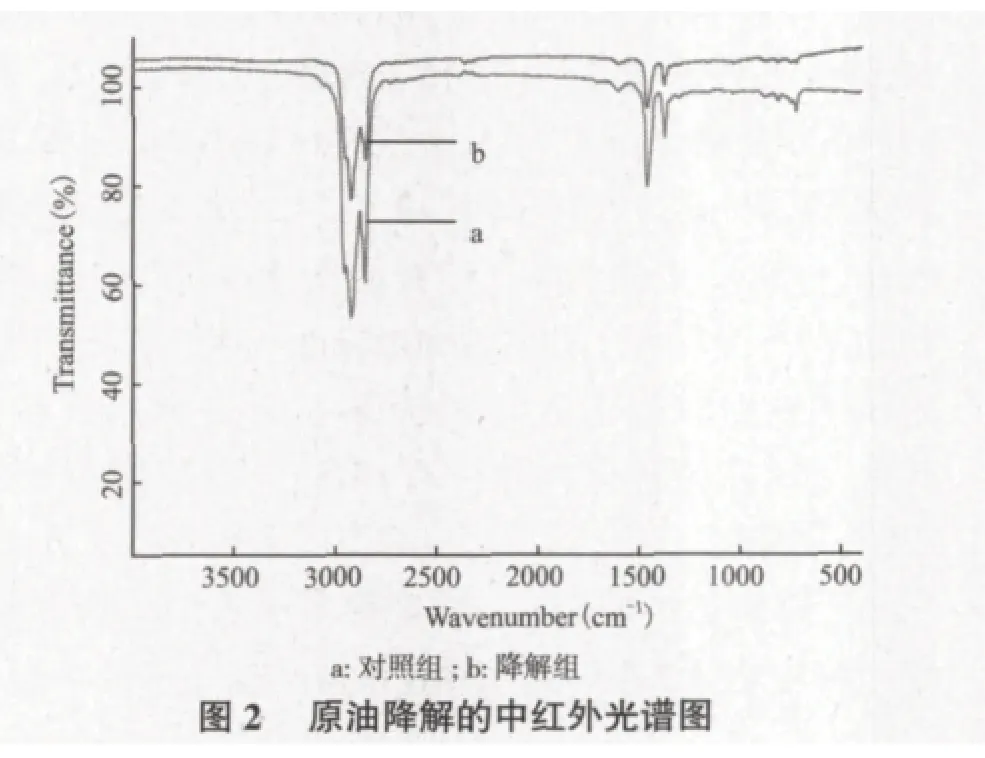
原油中红外光光谱扫描结果,见图2,中红外原油特征谱峰主要有3簇,第一簇峰3 000 cm-1谱带归属为芳烃化合物环的C-H键,降解后消失,2855 cm-1谱带为烷烃甲基伸缩振动,降解后振动减弱;第2簇峰,1 377 cm-1处直链烷烃甲基和亚甲特征吸收峰,1 470 cm-1处烷烃亚碳基变形振动,降解后显著减小,进一步证实了烷烃C-H的氧化分解;第3簇峰800 cm-1、870 cm-1的谱带为芳香族C-H键,降解后几乎消失,723 cm-1为链烯烃以及碳数≥7的直链烷烃亚甲基,细菌作用后也几乎消失。
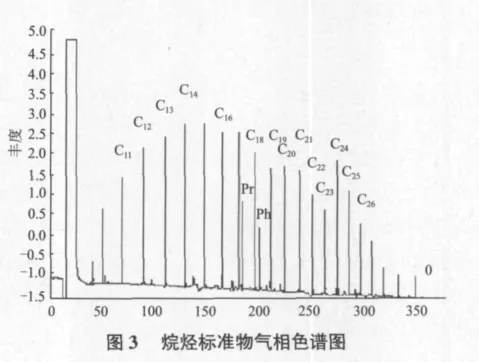

表1 GC法标准曲线测定结果

烷烃标准物的气相色谱图如图3所示,各个组分分离较好,nC10-nC25清晰谱峰,通过保留时间可知各沸点烷烃的出峰位置。5个不同浓度的烷烃标准物和气相色谱峰面积得到标准曲线(表1,图4)。样品和峰面积存在一定联系,随着样品浓度增加,峰面积也相应变大,呈线性关系。
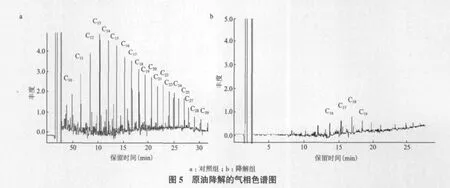
由原油降解的气相色谱图(图5)可知,原油经W-菌群降解处理后气相色谱图中各个组分的色谱峰几乎消失,只有C16-C19还有较弱吸收峰,其余大部分烷烃都已降解。菌群降解原油7 d后,保留时间在8 min之前的低沸点饱和烷烃几乎全部降解,说明从原油中培养得到的微生物群落有很强的降解能力。
2.2 降解菌体系的微生物多样性组成

原油中培养出的细菌种类繁多,通过菌的扫描电镜照片(图6),可见细菌呈现不同形状,有短杆状,长杆状,八叠体等,这些细菌构成一个微小生态群落,使得原油的外观状态发生改变,说明其中一定含有高效降解菌。
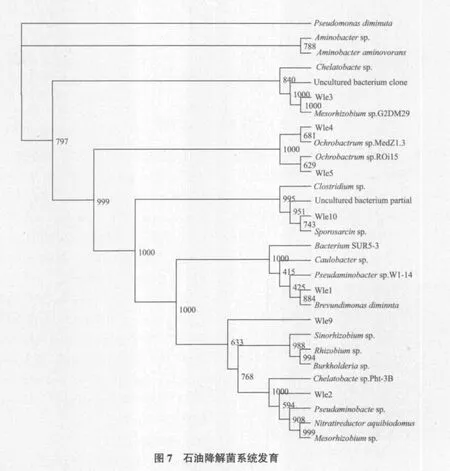
为进一步研究降解菌体系中的微生物群落结构的组成,构建了降解菌体系的克隆文库,随机挑取阳性克隆子进行测序分析,结果输入NCBI数据库进行比对和归类分析,结果(表2)显示序列相似性最高为99%,最低为89%,其中有94% 分别属于Proteobacteria类群(α-Proteobacteria和β-Proteobacteria变形菌门)和Firmicutes类群,而 6%的克隆子与已知类群相似性较低,在GenBank数据库中未找到与其相似的已知细菌序列,属于未知类群,与未获培养细菌marine bacterium(EU741662)和Uncultured bacterium(EU741663)的同源性分别为90%和89%。其中,Proteobacteria类群是文库中第一大类群,而苍白杆菌属又是其中数量最多的一类;在Firmicutes类群中,所占百分比最多的是芽孢杆菌属细菌。根据测得的16S rDNA序列构建降解菌体系系统发育树(图7)。
2.3 降解菌的鉴定
对所分离的降解菌中降解率超过50%的5号菌株命名为Wle-5,经多次分离纯化后进行分子鉴定,结果显示,Wle-5菌株的16S rRNA序列与短小芽孢杆菌(Bacillus pumilus)的16S rRNA序列相似性为100%;测序列已提交到GenBank数据库中,登录号为EU789571。同时对所筛选得的细菌通过微生物自动鉴定系统进行分析,鉴定结果表明Wle-5为短小芽孢杆菌(Bacillus pumilus)与分子生物学鉴定结果相吻合,可以确定所分离的株菌为短小芽孢杆菌。

表2 原油WLE内源菌体系16s rDNA克隆库结果
2.4 降解菌降解能力的测定
2.4.1 红外光谱吸收的变化 原油在近红外谱区有特征吸收峰,且不同种类的原油吸收峰形不同,而近红外光谱可检测到原油组分的细微变化。试验所用原油在4 000 cm-1-4 500 cm-1和5 600 cm-1-6 000 cm-1的两簇普峰有强烈吸收,其中4 000-1-4 500 cm-1谱区由2个主峰和2个小峰组成,特征峰最明显,这是原油的“指纹区”。高效降解菌Wle-5对原油的降解作用通过近红外光谱扫描所得结果,见图8。随着原油降解时间变长,原油特征峰信号都逐渐减弱。

降解菌Wle-5对原油的降解20 d后通过中红外光谱扫描所得结果,见图9。光谱图中第三簇峰在细菌作用20 d后都消失,说明原油的烯烃末端甲基和亚甲基被氧化;第二簇峰信号减弱,但未完全消失,原油的C=O键依旧存在;第一簇峰经Wle-5菌株降解后显示,肩峰(2 960 cm-1)消失,主峰不明显(2 920 cm-1)。

2.4.2 烷烃含量的变化 由原油降解的气相色谱分析可知,经Wle-5降解处理后气相色谱图中各个组分的色谱峰统一呈整体下降趋势,尤其是低沸点饱和烃和部分芳香烃降解效果显著,表明其对不同结构的烃类化合物均具有较强的降解能力。图10-c可见,经过21 d的降解处理后,原油的残余量已经很少,适当延长降解时间后,原油中烃类物质的降解率增加。
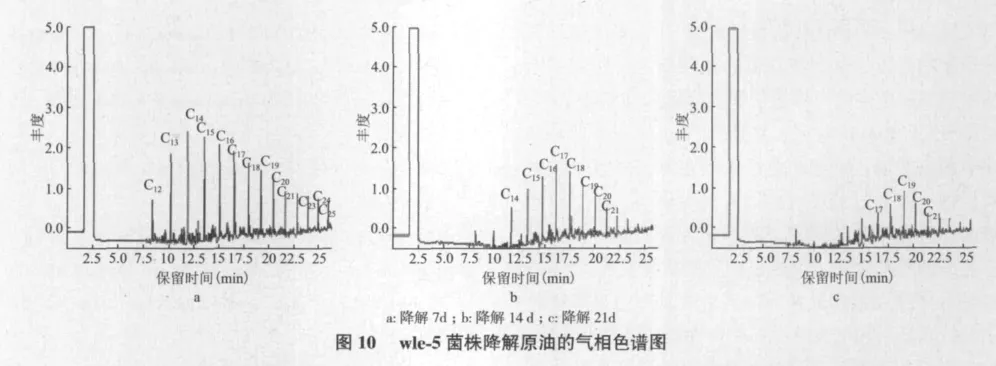

表3 两株菌作用前后原油饱和烃气相色谱分析结果
Wle-5菌株降解原油21 d后,保留时间在8 min之前的低沸点饱和烷烃几乎全部降解,保留时间在20 min以后的高沸点饱和烷烃和芳香烃含量减少,部分被降解。气相色谱分析数据显示(表3),原油经菌种作用以后,饱和烃碳链分布发生了明显的变化,高碳链饱和烃的相对含量降低,低碳链饱和烃的相对含量则相应增加。Wle-5作用原油后,不同程度地引起Pr/nC27与Ph/nC28值分别增加了9.5%和23.1%,进一步从数据是上表明Wle-5对原油中高碳链的饱和烷烃都具有生物降解作用。
3 讨论
原油在储藏和运输过程中所含的细菌可能与原油具有附生关系,有些细菌在原油恶劣环境中突变,受外界营养和温度等因素刺激后能利用原油为唯一碳源。本研究从原油本身的附生细菌出发,经培养所得W-菌群,从菌群中分离得到一株降解菌Wle-5,并对W-菌群和Wle-5的降解能力进行了研究,从气相色谱结果可以看出,W-菌群的降解能力要高于单株降解菌Wle-5,其原因可能是在同一培养基环境中细菌形成了稳定的群落,通过它们之间的协同作用,使得降解能力更强。
传统的富集筛选方法只能培养极少数的微生物[8,9],同时也破坏了微生物之间的相互作用[10-12],通过分析环境样品的16S rDNA克隆文库的序列可以实现对样品中细菌多样性的研究[13]。本试验采用分子生物学方法和传统培养方法相结合,研究了原油中自有的微生物。构建了原油降解菌的克隆文库,结果表明,Proteobacteria类群和Firmicutes类群是文库中两大类群,降解菌体系中存在能够降解原油的微生物,而通过分离纯化的方法也得到一株原油降解菌,紫外吸收法对其降解率研究表明其对原油具有明显的降解效果。气相色谱分析结果显示,Wle-5对某些低沸点饱和烃和部分芳香烃具有明显降解效果,特别是不同结构的烃类化合物其结果尤为显著。
有研究表明,苍白杆菌属能有效降解脂肪族和芳香族烃类[14],脲芽孢八叠球菌的发酵液有很强排油活性及稳定的乳化能力[15]。从气相色谱和红外图谱结果可以看出,原油中的烃类物质发生了降解,从试验所拍摄到的混合菌体系的电镜照片中也可明显看到类似八叠球菌形状的细菌,表明原油中仍可能存在新的降解菌。微生物对烷烃的降解主要是在多种酶的催化下进行的,其方式主要包括,末端氧化、亚末端氧化和ω氧化[16-21]。本研究中所分离的降解菌的中红外结果表明,烯烃末端甲基和亚甲基被氧化,表明该菌对原油降解也可能是在单加氧酶作用下发生的。
4 结论
(1)加入营养物刺激后获得了原油降解菌体系,该混合菌体系对原油烃类物质具有明显的降解效果。对降解菌体系进行研究表明,降解菌体系生物多样性较为丰富,含有多种原油降解菌,共同完成原油的降解。Proteobacteria类群和Firmicutes类群为降解菌体系中的主要类群。
(2)从原油中分开得到降解菌Wle-5,经鉴定为短小芽孢杆菌(Bacillus pumilus)。
(3)红外光谱显示3 000 cm-1,2 855 cm-11 377 cm-1等处的原油特征峰,降解后振动减弱或消失,原油发生降解。
(4)气相色谱和红外光谱结果表明,经 21 d的降解处理后,原油烃大幅减少。适当延长降解时间,原油中烃类物质的降解率增加。
[1] Balba MT, Awadhi NA, Daher RA. Bioremediation of oil contaminated soil microbiological methods for feasibility assessment and field evaluation[J]. Journal of Microbiological Methods, 1998, 32:155-164.
[2] 丁明宇, 黄健, 李永祺. 海洋微生物降解石油的研究[J]. 环境科学学报, 2001, 21(1):84-88.
[3] Maneerat S, Bamba T, Harada K, et al. A novel crude oil emulsifier excreted in the culture supernatant of a marine bacterium, Myroides sp. strain SM1[J]. Appl Microbiol Biotechnol, 2006, 70:254-259.
[4] Mimmi TH, Alexander W, Ellingsen ET, et al Identification of novel genes involved in long-chain n-Alkane degradation by Acinetobacter sp. strain DSM 17874[J]. Appled Environmental Microbiology, 2007, 73(10):3327-3332
[5] Kishore D, Ashis KM. Crude petroleum-oil biodegradation eYciency of Bacillus subtilis and Pseudomonas aeruginosa strains isolated from a petroleum-oil contaminated soil from North-East India[J].Bioresource Technology, 2007, 98:1339-1345.
[6] 于晓丽.油气田废水中石油类物质测定问题的探讨[J]. 油气田环境保护, 1994, 4(2):34-37.
[7] Zhou JL. Distribution of polycyclic aromatic hydrocarbons in water and surface sediments from Data Bay[J]. China Environmental Pollution, 2003, 12(1):269-281.
[8] Rahman MH, Suzuki S, Kawai K. Formation of viable but nonculturable state(VBNC)of Aeromonas hydrophila and its virulence in Goldfish, Carassius auratus[J]. Microbiological Research, 2001, 156(1):103-106.
[9] Dianne KN, Jillian FB. Geomicrobiology:howmolecular-scale interactions underpin biogeochemical systems[J]. Science, 2002, 296(5570):10-71.
[10] Tarasov AL, Borzenkov IA, Milekhina EI. Dynamics of microbial processes in the stratal waters of the Romashkinskoe oil field[J]. Microbiology, 2002, 71(6):735-742.
[11] Nazina TN, Grigoryan AA, Xue YF, et al. Phylogenetic diversity of aerobic saprotrophic bacteria isolated from the Daqing oil field[J]. Microbiology, 2002. 71(1):91-97.
[12] Liu JF, Mu BZ. Extreme environment of oil reservoir and associated microorganisms[J]. Microbiology, 2004, 24(4):31-34.
[13] Darby AC, Birkle LM, Tumer SI, et al. An aphidbome bacterium allied to the secondary symbionts of whitefly[J]. Microbial Ecological, 2001, 36:43-50.
[14] Katsivela E, Edward RB, et al. Biodegradation of aliphatic and aromatic hydrocarbons:specificity among bacteria isolated from refinerywaste sludge[J]. Water, Air, and Soil Pollution, 2003, 3:103-115.
[15] 王靖, 刘元琴, 姜凯, 等. 嗜蜡菌R的代谢特性及其摄取烷烃的机理研究[J]. 中国石油大学学报, 2007, 31(3):143-147.
[16] Kemp PF, Aller JY. Bacterial diversity in aquatic and other environments:what 16S rDNA libraries can tell us[J]. Microbiology Ecology, 2004, 47:161-177.
[17] Kotani T, Kawashima Y, Yurimoto H, et al. Gene structure and regulation of alkane monooxygenases in propane-utilizing Mycobacterium sp. TY-6 and Pseudonocardia sp. TY-7 The Society for Biotechnology[J]. 2006, 102(3):184-192.
[18] van Beilen JB, Smits THM, Whyte LG, et al. Alkane hydroxylase homologues in Gram-positive strains[J]. Environmental Microbiology, 2002, 4(11):676-682.
[19] Smits TH, Rothlisberger M, Witholt B, van Beilen JB. Molecular screening for alkane hydroxylase genes in Gram-negative and Grampositive strains[J]. Environmental Microbiology, 1999, 1(4):307-317.
[20] Whyte LG, Smits THM, Labbe D, et al. Gene cloning and characterization of multiple alkane hydroxylase systems in Rhodococcus strains Q15 and NRRL B-16531[J]. Appled And Environmental Microbiology, 2002, 68(12)5933-5942.
[21] Kahng HY, Malinverni JC, Majko MM, et al. Genetic and functional analysis of the tbc operons for catabolism of alkyl and chloroaromatic compounds in Burkholderia sp. strain JS150[J]. Appl Environ Microbiol, 2001, 67:4805-4816.
