高粱花叶病毒外壳蛋白的原核表达及其抗血清制备
2013-12-23王洪星龚殿孙玉娟张雨良王健华刘志昕
王洪星 龚殿 孙玉娟 张雨良 王健华 刘志昕
(中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
甘蔗是最重要的糖料作物和最具潜力的能源作物,甘蔗栽培中大多以种茎作为繁殖材料和种质交流材料[1],因此容易造成病毒病的逐代积累和远距离传播。世界上报道的甘蔗病毒病害有13种之多[2-4],在甘蔗病毒病中流行范围最广,且对产量和品质影响最大的是甘蔗花叶病[5,6]。甘蔗花叶病毒(Sorghum mosaic virus,SrMV)是引起甘蔗花叶病的一种重要病原,自然界中可由多种蚜虫以非持久方式传播,易机械接种,自然寄主仅限于禾本科植物,在自然条件下只危害高粱和甘蔗[7,8]。SrMV是马铃薯Y病毒属(Potyvirus)的成员[9],编码346-350 kD蛋白质的单个开放阅读框,产物为一聚合蛋白,自身编码的蛋白酶将多聚蛋白加工成10个成熟蛋白[10]。目前还未见SrMV CP基因的原核表达、抗血清制备的相关报道。本研究以SrMV-HN分离物染病植株总RNA为材料,采用RT-PCR方法克隆CP基因编码区,插入到pET32a原核表达载体,转化大肠杆菌表达宿主菌Rosetta(DE3),拟实现CP基因的原核表达,并制备高效特异性抗血清,旨在为建立SrMV检测体系进行田间样品检测打下了良好的基础。
1 材料与方法
1.1 材料
甘蔗花叶病病样及原核表达载体pET-32a由本实验室保存。限制性内切酶、DNA分子量标记(DL2000)、Taq DNA聚合酶、T4 DNA连接酶、PCR 回收试剂盒等均购自大连宝生物工程公司。E.coli DH5α、Rosetta(DE3)菌株由本实验室保存。透析袋购自Sigma公司。IPTG购自Promega公司。低分子量蛋白Marker购自Promega公司;BCIP/NBT底物显色试剂盒、丙烯酰胺、N,N'-亚甲基双丙烯酰胺、三羟甲基氨基甲烷(Tris)均购自Solarbio公司;十二烷基磺酸钠(SDS)、甘氨酸、考马斯亮蓝R-250均购自Amresco公司;其他化学试剂均为国产分析纯。His-Tag单克隆抗体购自Novagen公司;Goat Anti-Mouse IgG(H&L)-AP购自北京康为世纪生物科技有限公司;其他生化试剂及普通化学试剂均为进口或国产生化级或分析级试剂。
1.2 方法
1.2.1 重组原核表达载体pET32a-SrMV CP的构建根据SrMV相关基因序列(GenBank登录号:AJ310-197.1),基因位置:8424-9389。综合考虑酶切位点引物设计的各项原则,设计引物。SrMV-CP引物对所选取的酶切位点为EcoRⅠ和Hind III;所需寡核苷酸引物由上海生物工程公司合成。SrMV-CP引物序列[13]:
SrMV-CP-F:5'- GAAGAATTCGCAGGGGGCGGTACGGT-3',其中下划线部分为EcoR I酶切位点,
SrMV-CP-R:5'- GCCAAGCTTTCAGTGGTGCTGTTGC-3',其中下划线部分为 Hind III酶切位点。方框部分表示与模板相同或互补配对的序列。
以甘蔗花叶病病样的总cDNA为模板,SrMVCP-F和SrMV- CP-R为引物,进行PCR反应:94℃预变性3 min ;94℃变性30 s,55℃ 退火30 s ,72℃延伸1 min,35个循环;72℃终止补偿延伸10 min。取适量PCR产物进行琼脂糖凝胶电泳检测,剩余的回收并纯化。PCR产物纯化采用TIANGEN琼脂糖凝胶DNA回收试剂盒(天根生物技术有限公司),具体操作过程参照试剂说明书进行。回收PCR产物用T-A克隆方法克隆到质粒pMD 19-T simple vector(TaKaRa公司)中,转化到大肠杆菌DH5α。经菌液PCR和质粒双酶切(EcoR I/Hind III)鉴定后,阳性克隆送上海英俊生物技术有限公司测序,获得目的基因重组克隆质粒pMD 19T-SrMVCP。
分别用EcoR I/Hind III 在37℃水浴中过夜双酶切重组克隆质粒pMD 19T-SrMVCP和表达载体pET32a(+),回收具有黏性末端的CP片段和pET32a(+),16℃水浴连接过夜,将回收的目的基因CP片段连接到pET32a(+)上,构建重组表达质粒。连接产物转化到大肠菌Rosetta(DE3)感受态细胞,经菌液PCR鉴定和EcoR I/Hind III质粒双酶切鉴定后,选择阳性单克隆测序,获得重组表达质粒pET32a-SrMVCP。
1.2.2 融合蛋白的诱导表达和可溶性分析 以1∶100的接种量,将转化进重组子pET32a-SrMVCP的大肠杆菌Rosetta(DE3),接种于50 mL LB液体培养基(含氨苄青霉素100 μg/mL)中,37℃摇床振荡培养。OD600值达到0.5-0.6时,加入终浓度为0.1 mmol/L的IPTG,转到30℃继续培养3-6 h。
取1 mL诱导表达的菌液加入2 mL离心管中,12 000 r/min离心1 min,弃上清,沉淀用50 μL双蒸水悬浮,再加入50 μL的2×SDS-PAGE上样缓冲液混匀,沸水浴煮5 min后放置在冰上2 min。在4℃条件下,12 000 r/min离心1 min,取上清10 μL上样,进行SDS-PAGE电泳。电泳结束后,凝胶经考马斯亮蓝R-250染色,分析融合蛋白的表达情况。收集经诱导培养4 h的菌液样品,采用超声波破碎菌体细胞,离心后分别取1 mL上清液和沉淀按上述方法进行SDS-PAGE电泳,对融合蛋白进行可溶性分析。
1.2.3 融合蛋白的纯化 扩大培养重组表达菌1 L,按上述条件诱导表达4 h。于4℃ 6 000 r/min离心30 min,菌体沉淀溶于50 mL Binding buffer中,冰浴放置30 min。经超声波破碎仪破碎细胞,冰浴放置30 min,4℃ 12 000×g离心30 min,上清过0.45 μm滤膜并通过Ni2+-NTA亲和层析柱进行纯化:用6 mL灭菌水洗涤琼脂糖树脂2次后,以6 mL Binding Buffer 平衡亲和柱。上柱后用6 mL Washing Buffer(500 mmol/L NaCl,20 mmol/L imidazole,20 mmol/L Tris-HCl,pH 8.0)洗脱杂蛋白,再以 6 mL Elution Buffer(500 mmol/L NaCl,0.5 mol/L imidazole,20 mmol/L Tris-HCl,pH8.0)洗脱融合蛋白。纯化后蛋白用透析袋经100 mL 1×PBS透析3次即为纯化蛋白。
1.2.4 抗血清制备及血清学检测 纯化的融合蛋白溶液经过透析袋透析获得溶于1×PBS的蛋白溶液。BCA法测定其浓度,与佐剂(1∶1)混匀,采用皮下多点注射抗原的方法免疫2只大白兔[10],每只总注射量为2.0 mg,分3次免疫,每次间隔7-10 d,第3次免疫10 d后,每只白兔耳缘静脉取血0.5-1.0 mL,分离抗血清。以1×PBS的蛋白溶液作抗原,ID-ELISA检测抗血清效价,血清效价未符合要求则继续免疫。血清效价符合要求后,心脏采血,分离抗血清,抗血清效价和工作浓度分别以提纯的CP蛋白和感病的甘蔗叶片汁液为抗原进行IDELISA测定。
1.2.5 抗血清特异性鉴定 诱导表达后的菌体,进行SDS-PAGE凝胶电泳。用蒸馏水漂洗电泳后的凝胶,转入电转液中平衡10 min。利用电转膜方法,以100 V,60 mA转移1 h后,取出NC膜在蒸馏水中漂洗。将NC膜置于TBST缓冲液[20 mmol/L Tris-HCl(pH7.5),150 mmol/L NaCl,0.05% Tween-20]配制的5%脱脂牛奶封闭液中4℃封闭过夜。封闭完成后,用TBST缓冲液漂洗NC膜后,将其转入按1∶1 000稀释的一抗TBST溶液,在37℃下,孵育40 min。取出NC膜,用TBST漂洗后,转入按1∶30 000稀释的碱性磷酸标记的山羊抗兔(IgG)TBST溶液中,37℃孵育40 min。取出NC膜,经TBST漂洗后,在NC膜蛋白面滴加含有330 μg/mL NBT(0.5 g NBT溶于10 mL 70%的二甲基甲酰胺中)和165 μg/mL BCIP(0.5 g BCIP溶于10 mL 100%的二甲基甲酰胺中)的显色液,直到条带清晰后,用蒸馏水漂洗两次,终止显色反应。取出NC膜晾干后进行扫描分析
1.2.6 田间样品检测 从海南各市县采集到25株疑似甘蔗花叶病样品进行ID-ELISA检测,健康组培苗作阴性对照,抗血清的工作浓度为1∶1 000;同时通过RT-PCR方法进行验证。
2 结果
2.1 CP基因克隆和表达质粒的构建
用PCR方法从病样总cDNA中扩增获得的CP基因片段,经1%琼脂糖凝胶电泳后,扩增片段大小约为987 bp(图1)。表达重组质粒pET32a-CP经EcoR I/Hind III双酶切验证,出现特异性DNA条带,其大小约为987 bp(图 2),从而进一步证明已成功构建了重组表达质粒pET32a-CP。

图1 PCR扩增产物
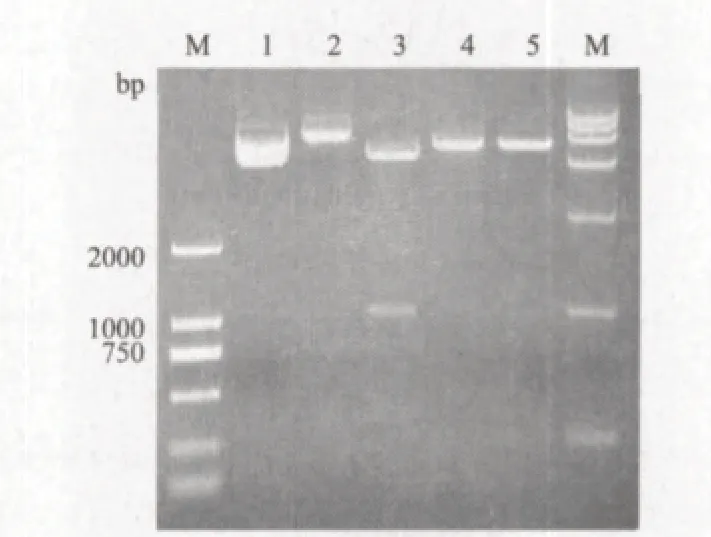
图 2 重组质粒pET32a-CP酶切鉴定
2.2 CP基因的诱导表达及可溶性分析
分别在37℃、25℃和IPTG终浓度0.1 mmol/mL条件下,诱导表达pET32a-CP重组表达菌Rosetta(DE3)。取1 mL菌液样品进行SDS-PAGE电泳分析,重组质粒表达量在Rosetta(DE3)菌(图 3-A)中远高于BL21(DE3)(图 3-B),因此采用在Rosetta(DE3)菌中表达。在Rosetta(DE3)菌中约53 kD处有一明显区别的条带,其大小与预估的融合蛋白大小符合。剩余菌液经细胞破碎仪破碎细胞后,分别取上清与沉淀进行SDS-PAGE电泳分析(图 4)融合蛋白的表达产物主要以可溶性的形式存在。同时对诱导条件的优化发现,IPTG终浓度0.1-1 mmol/L、诱导温度25-37℃、诱导时间1-6 h范围内,均可稳定表达;IPTG终浓度、诱导温度、诱导时间、不是其表达的决定因素。根据优化条件确立了CP基因表达的最佳条件:IPTG终浓度为0.1 mmol/L,诱导时间为4 h,诱导温度为30℃。
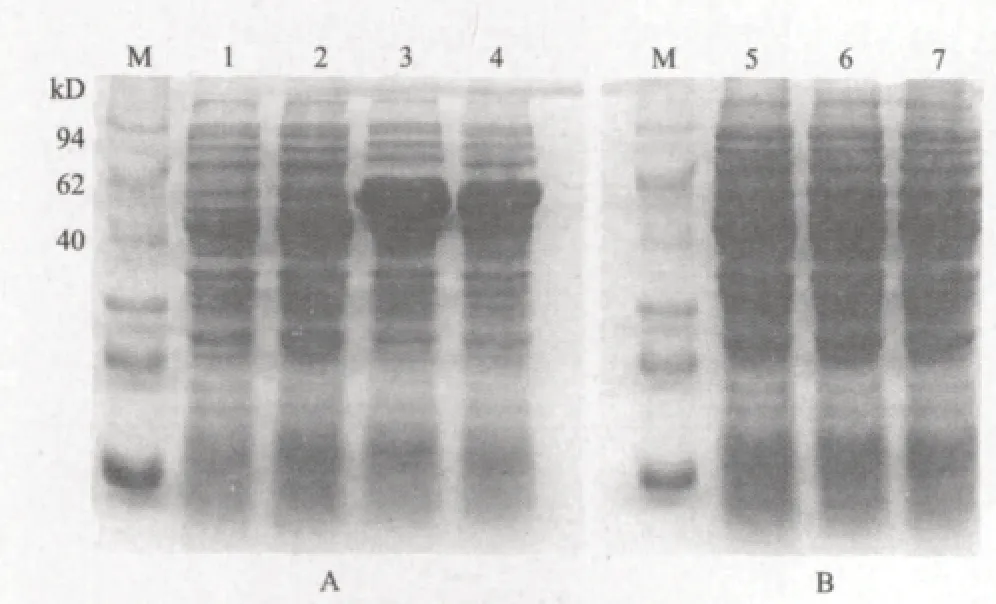
图3 pET32a-CP在不同宿主菌中表达产物的SDS-PAGE分析
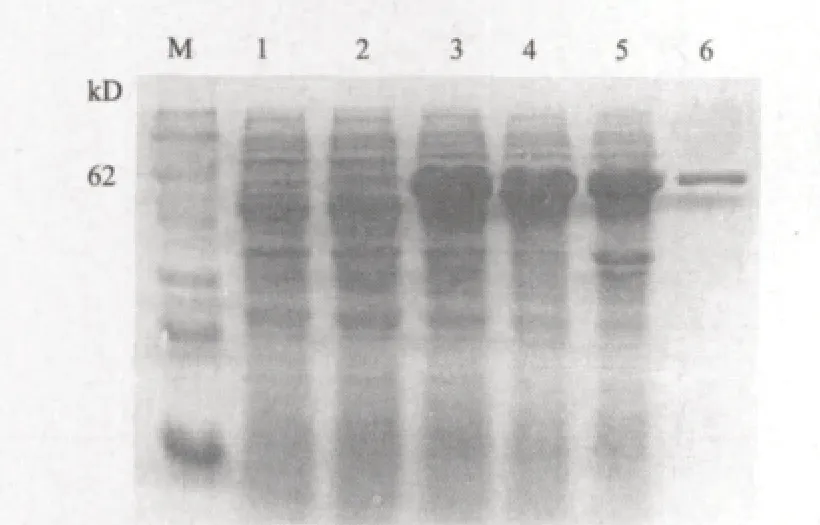
图4 pET32a-CP重组菌表达产物的可溶性分析
2.3 融合蛋白的纯化
在30℃,IPTG终浓度0.1 mmol/mL条件下,对重组表达菌进行诱导培养4 h。获得的融合蛋白含有相对较多的可溶性蛋白,但同时也有一部分是包涵体蛋白。为了尽量保证融合蛋白CP的生物活性和简便操作过程,选择了上清进行可溶性蛋白纯化。Ni2+-NTA亲和层析纯化中,杂蛋白经100 mmol/L咪唑浓度的washing buffer洗脱后,与亲和层析柱Ni2+螯合的目的蛋白纯度已达要求。最终,用500 mmol/L咪唑浓度的washing buffer将融合蛋白溶于其中(图 5)。

图5 pET32a-CP重组菌表达产物SDS-PAGE检测及目的蛋白纯化
2.4 抗血清的制备和效价测定

图6 pET32a-CP重组菌表达产物的可溶性分析
在注射抗原蛋白到白兔前,用ID-ELISA对白兔进行免疫前血清本底水平检测,结果显示,试验所选用的家兔血清本底比较低,符合试验要求。将纯化获得的融合蛋白作为免疫原,第一次与完全佐剂等比例混匀,第2、3次与不完全佐剂等比例混匀,采用肌肉与皮下注射相结合免疫家兔。3次注射后采集血清,以融合蛋白溶液和感病的甘蔗叶片汁液为抗原进行ID-ELISA测定抗血清效价和工作浓度。结果(表1)表明,当以提纯的CP蛋白作抗原时,抗血清稀释104倍仍明显呈阳性反应;当以发病甘蔗叶片汁液为抗原时,抗血清在稀释103倍仍呈阳性反应,抗血清的工作浓度为1∶1 000。
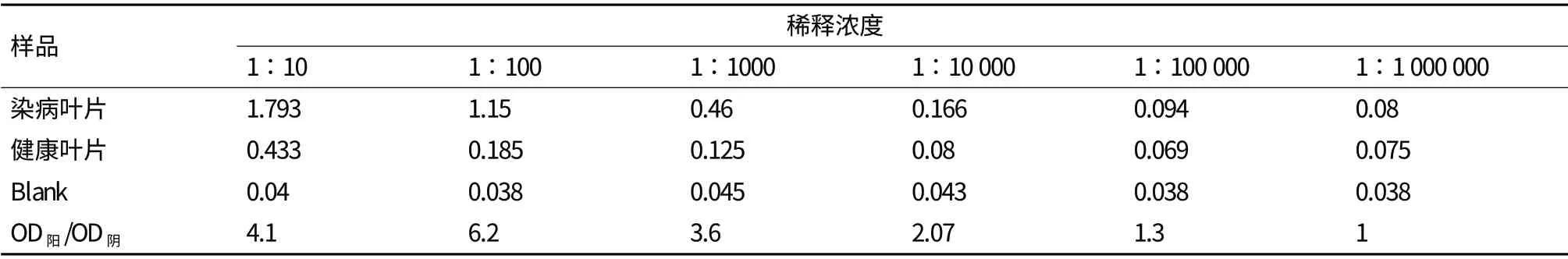
表1 不同稀释度的抗血清与病样的ELISA结果的OD值
2.5 抗血清特异性鉴定
经Western blotting分析,结果(图 6)显示,兔抗CP抗血清仅与诱导表达菌SDS-PAGE凝胶53 kD条带处有反应,与其他条带均无反应。从而证明,抗血清能与纯化后融合蛋白起特异性反应。
2.6 田间样品检测
用所制备的抗血清进行了甘蔗花叶病样品检测,结果(表2)显示,该抗血清测得结果基本与PCR检测结果相符合,说明该抗血清较好的用于甘蔗组培苗的检测。

图 6 表达产物CP蛋白Western Blot检测

表2 甘蔗疑似样品ID-ELISA检测结果
3 讨论
制备高质量的抗血清对抗原的质量要求非常高,提取甘蔗中的SrMV病毒存在一定的困难。甘蔗体内含有较多的多糖和酚类物质,会影响病毒提纯的效率;病毒粒子提纯过程复杂繁琐,需要专门的大型仪器设备(如超、高速离心机,透射电镜),费时、费资、费力。这些大大限制了这类病毒的抗血清的制备。利用提纯的病毒制备的抗血清,由于提纯条件和纯化技术的客观限制,其中难免会含有某些寄主蛋白抗体,这很容易在后续的血清学反应中造成假阳性反应。而用改造好的工程菌来表达病毒的目的蛋白,得到的抗原量不但较多,而且其中不含寄主植物蛋白的成分,由此制备的抗血清会有较好的专化性,不容易出现假阳性。余乃通等[14,15]用香蕉束顶病毒海口分离物核穿梭蛋白(NSP)、CP制得香蕉束顶病毒抗血清;李向东等[16]将SCMV-CP基因克隆到表达载体pET22b(+),Adv Virus Res,制备了专化性强、效价高的抗血清。
4 结论
本研究获得了高粱花叶病毒膜蛋白基因序列,用原核表达载体表达CP基因的全长蛋白,从而用pET32a(+)原核表达载体成功构建了CP基因表达质粒。在诱导表达中,表达量很高,且主要以可溶性蛋白存在。同时优化反应条件发现,IPTG终浓度、诱导温度、诱导时间,不是其表达的决定因素。本试验在低温条件下诱导表达,将获得的可溶性融合蛋白进行纯化,获得大量可溶性蛋白,制备了专化性很强的抗血清。
[1] 周国辉, 许东林, 蔡艳清, 等. 我国南方甘蔗病毒种类初步鉴定[J]. 广西农业生物科学, 2006, 25(3):226-228.
[2] Viswanathan R, Balamuralikrishnan M, Karuppaiah R. Characterization and genetic diversity of sugarcane streak mosaic virus causing mosaic in sugarcane[J]. Virus Genes, 2008(36):553-564.
[3] Viswanathan R, Balamuralikrishnan M, Karuppaiah R. Duplexreverse transcription polymerase chain reaction(D-RT-PCR)-a technique for the simultaneous detection of viruses causing sugarcane mosaic[J]. Sugar Tech, 2008, 10(1):81-86.
[4] Grisham MP, Johnson RM, Zimba PV, et a1. Detecting Sugarcane yellow leaf virus infection in asymptomatic leaves with hyperspectral remote sensing and associated leaf pigment changes[J]. Virol Methods, 2010, 167(2):140-145.
[5] 王建南, 许莉萍, 陈如凯. 甘蔗褪绿线条病致病机理研究初报[J]. 甘蔗, 1995, 2(4):10-13.
[6] 王洪星, 张雨良, 刘志昕,等.应用多重RT-PCR检测甘蔗黄叶病毒和高粱花叶病毒[J], 广东农业科学, 2011, 38(10):128-131.
[7] Shukla DD, Frenkle MJ, Mckern NM. Present status of sugarcane mosaic subgroup ofotyviruses[J]. Archive of Virology, 1992(l5):363-373.
[8] Shukla DD, Ward CW. Structure of potyvirus coat proteins and its application in the taxonomy of the potyvirus group[J]. Adv Virus Res, 1989, 36:273-314.
[9] Van Regenmorte MHV, Fauquet CM, Bishop DHL, et al. Virus Taxonomy[M]. Seventh Report of the International Committee on Taxonomy of Viruses. New York:Academic Press, 2000:691-701.
[10] Chen J, Chcn J, Adams MJ. Characterization of potyviruses from sugarcane and maize in China[J]. Archives of Virology, 2002, 147(6):1237-12.
[11] Harlow E, LanD. Antibodies[M].1st Edition. New York:Cold Spring Harbor Laboratory Press, 1998.
[12] 张婷婷, 叶波平. 包涵体蛋白质的复性研究进展[J]. 药物生物技术, 2007, 144:306-309.
[13] 王洪星, 张雨良, 刘志昕,等.以ScYLV和SrMV为材料进行常见PCR引物优化设计[J]. 中国糖料, 2012(1):16-20.
[14] 余乃通, 冯团诚, 刘志昕, 等. 香蕉束顶病毒海口分离物核穿梭蛋白(NSP)的纯化及抗血清制备[J]. 基因组学与应用生物学, 2010, 29(2):375-378.
[15] 余乃通, 冯团诚, 刘志昕, 等. 香蕉束顶病毒海口分离物CP 基因的原核表达、纯化及其抗血清制备[J]. 热带作物学报, 2010, 31(5):767-771.
[16] 李向东, 范在丰, 石鹏君. 甘蔗花叶病毒CP基因的高效表达和抗血清制备[J]. 生物技术通讯, 2003, 14(4):271-273.
