微波消解-氢化物原子荧光光谱法同时测定贼小豆中的砷、硒、锑
2013-12-23高向阳王莹莹乔明武
高向阳,韩 帅,王莹莹,乔明武
(1.郑州科技学院食品科学系,河南 郑州 450064;2.河南农业大学食品科学技术学院,河南 郑州 450002)
砷及其化合物是环境和食品的重要污染物之一,各国都有严格的限量要求[1-2]。我国明确规定豆类食品中砷限量指标(以无机砷计)为0.1mg/kg[3]。持续接触锑可破坏心脏及肝脏功能,吸入高含量的锑会导致中毒,出现呕吐、头痛、呼吸困难,严重者可能死亡[4]。硒具有抗氧化、降低重金属毒性及增强免疫等多种功能,摄取不足或过多都会影响人身安全[5-7]。贼小豆(Vigna minima)又名山绿豆,属于豆科菜豆亚组豇豆属,一年生缠绕草本,产于我国北部、东南部至南部,生于旷野、草丛或灌丛中,国外亦有分布[8],是有一定开发前景的食品新资源,除铝外[9]目前尚未见其他微量元素和其营养价值研究的报道,对其理化特性和安全性进行深入探讨,进一步充分开发利用,具有一定的现实意义。
氢化物发生-原子荧光光谱法具有精密度高、干扰少、谱线简单、线性范围宽、进样效率和原子化效率高等优点[10-13]。微波设计程序,密闭压力消解样品,试剂用量少、处理速度快、成本低廉,可有效防止待测元素的损失。微波压力消解技术与氢化物发生-原子荧光光谱分析法结合,使两者的优点得到了充分发挥,已用于食品中微量元素的测定[14-18]。食品中砷、硒、锑的测定,国家颁布的标准方法[19-21]是单个元素分别进行分析,本实验以郑州地区野生贼小豆为样品,用微波压力进行程序消解,用氢化物发生原子荧光光谱法同时测定消解液中的砷、硒、锑,试样用量少,消解过程不污染环境也不被环境污染,节省时间和试剂,分析成本大为降低,工作效率得到提高,为进一步开发利用该自然野生资源提供了参考依据。
1 材料与方法
1.1 材料与试剂
贼小豆果实分别于2010年和2011年秋季采集于郑州龙子湖高校园区(113:42E;34:44N),由河南农业大学生命学院朱长山教授鉴定,野生深灰色小豆,籽粒饱满,平均千粒质量为27.1542g(n=5);郑州绿豆,籽粒饱满,产地新郑;南阳绿豆,籽粒饱满,采集于南阳市唐河县桐寨铺镇。
盐酸、硝酸 烟台市双双化工有限公司;过氧化氢 天津市华东试剂厂;氢氧化钾 北京化学试剂三厂;硼氢化钾 国药集团化学试剂有限公司;硫脲 天津市大茂化学试剂厂。砷(GSB 04-1714-2004)、硒(GSB 04-1751-2004)、锑(GSB 04-1748-2004)单元素标准溶液(质量浓度均为1000μg/mL) 国家有色金属及电子材料分析测试中心。
还原剂:质量浓度为0.5g/100mL氢氧化钾溶液和质量浓度为1.5g/100mL硼氢化钾混合液,现用现配;所用盐酸、硝酸为优级纯,其余试剂均为分析纯;水为超纯水(电阻率为18.3MΩ·cm);所用玻璃器皿均用硝酸(1+5)浸泡过夜,依次用蒸馏水、超纯水冲洗后使用。
1.2 仪器与设备
PF6-3型多道全自动原子荧光光度计 北京普析通用公司;砷、硒、锑高性能空心阴极灯 北京有色金属研究总院;屏蔽气及载气均为高纯氩气 河南源正科技发展有限公司;MARS微波消解系统 美国CEM公司;FZ102微型植物粉碎机 浙江上虞盛科仪器制造有限公司;EH20A数显防腐电热板(PLUS) 北京LabTech公司;Milli-Q®Advantage®A10超纯水系统 美国Wasters公司。
1.3 方法
1.3.1 样品的处理
样品除杂、除残粒后,依次用自来水、蒸馏水、超纯水洗净、80℃恒温箱中烘干,用“四分法”取约1kg,用微型植物粉碎机粉碎,弃去最初约50g样品后,其余过60目筛,置于广口瓶中,于干燥器内保存、备用。称取1g左右(称准至0.0001g)恒定质量的均匀样品于微波消解管内,加10mL硝酸,放置过夜后加2mL过氧化氢,轻摇混匀,按表1程序密闭压力消解。冷却后取下盖子,在电热板上继续加热至近干,加入6mol/L盐酸5.00mL,加热至溶液变为清亮无色并伴有白烟出现时止,冷却后将消解液定量转入25mL容量瓶,用1.2mol/L盐酸定容,混匀备用,同时处理空白溶液。

表 1 微波消解程序Table 1 Microwave digestion procedure
1.3.2 仪器测定条件
实验表明,原子荧光光度计在以下仪器条件下进行测定,可以得到令人满意的测定结果。光电倍增管负高压:280.00V;原子化器炉温:200℃;载气流速:300mL/min;读数方式:面积;延迟时间:3s;载液一次进样量:1.50mL;样品进样量:1.00mL;A道为锑(Sb)灯;B道为砷(As)灯;C道为硒(Se)灯;主灯电流:50mA;辅灯电流:50mA;屏蔽气流速:600mL/min;测量方法:标准曲线法;读数时间:13s;载液二次进样量:1.50mL;测量次数:3次。
1.3.3 方法建立及样品测定
用1.2mol/L盐酸逐级稀释1000μg/mL各单元素标准溶液为1μg/mL的标准应用液。吸取1.00mL各标准应用液于100mL容量瓶,加入10.00g/L硫脲溶液10.00mL,用1.2mol/L盐酸定容、摇匀。用仪器自动稀释功能,通过人机对话,将砷、硒、锑的标准工作液稀释为0.00、1.00、2.00、4.00、6.00、8.00、10.00ng/mL,用时现配。以0.24mol/L盐酸为载液,以0.5g/100mL氢氧化钾溶液和1.5g/100mL硼氢化钾混合液为还原剂,待炉温升至190℃以上,按表2仪器工作参数及测定条件进行测定,以相对荧光值为纵坐标,各元素标准工作液质量质量浓度为横坐标,分别绘制标准曲线。
吸取5.00mL试样消解液于50.00mL容量瓶,加入10.00g/L硫脲溶液5.00mL,用1.2mol/L盐酸定容至刻度。以0.24mol/L盐酸为载液,按上述绘制标准曲线的方法进行测定,按下式计算结果:
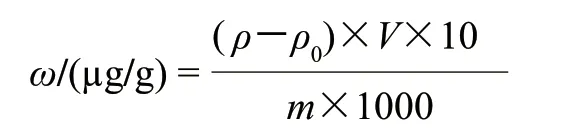
式中:ω为试样中元素的质量分数/(μg/g);ρ为试样消解液测定元素的质量浓度/(ng/mL);ρ0为试样空白消解液测定元素的质量浓度/(ng/mL);V为试样消解液总体积/mL;10为稀释倍数;m为试样质量/g;1000为将“ng”换算为“μg”的系数。
2 结果与分析
2.1 消解体系料液比的确定
利用HNO3-H2O2混合酸溶液,消解效果比较好。称取1.0000g左右过60目筛的样品,按一定料液比于1600W微波功率消解40min,消解效果见表2。

表 2 样品消解效果Table 2 Results of sample digestion
由表2可知,1.0000g左右的样品,加入10.00mL硝酸、2.00mL过氧化氢,微波密闭消解40min的效果最为理想。
2.2 反应介质及酸度的确定
在实验条件下,比较HNO3、HCl、H2SO4介质对3种元素荧光强度的影响,结果表明:HCl为介质时,测定效果较好。实验表明:用1.2mol/L盐酸为介质,0.24mol/L的盐酸作为载液,测定结果较为理想。
2.3 掩蔽剂的选择
在实验条件下,比较硫脲、抗坏血酸、硫脲与抗坏血酸混合液的掩蔽效果。结果表明,硫脲掩蔽铜、铝、镉等离子的效果较好,但应放置30min以上,以增加溶液的稳定性[2]。选择10.00g/L硫脲溶液为掩蔽剂。
2.4 硼氢化钾浓度的选择
硼氢化钾与所测元素反应生成相应的氢化物气体,被载气带入仪器进行测定,加入氢氧化钾可保持其稳定性。硼氢化钾质量浓度太低,会导致反应不完全,浓度太高,会产生大量氢气引起荧光测定信号猝灭。通过对10~20g/L硼氢化钾溶液对荧光强度影响的实验表明:0.5g/100mL氢氧化钾溶液和1.5g/100mL硼氢化钾混合液为还原剂能够满足砷、硒、锑3种元素完全气化的需要。
2.5 干扰实验
以镉、铅、铜、铝、锡等干扰元素大于5倍待测元素的可能存在量,分别对1μg/mL的砷、硒、锑单一元素标准溶液进行干扰实验。结果表明:100μg铅、镉,20μg铜、铝,5μg锡不干扰砷、硒、锑测定。分别在1μg/mL砷、硒、锑单一元素标准溶液中加20倍量的另外两种元素,按照实验方法进行测定,结果表明3种元素间不存在相互干扰。
2.6 标准曲线的回归方程和相关系数
在1.3.2节和1.3.3节测定条件下,绘制标准曲线得出的线性回归方程和相关系数分别为砷:Y=357.18X-19.844,r=0.9997;硒:Y=44.699X-7.3202,r=0.9998;锑:Y=63.241X-97.492,r=0.9991。3种元素测定的质量浓度在0~50ng/mL范围内呈良好的线性关系。
2.7 检出限和精密度
用1.00ng/mL各元素标准溶液分别进行12次平行测定,按3倍标准偏差计算方法的检出限,砷、硒和锑分别为0.020、0.040ng/mL和0.050ng/mL。
在1.3.2节和1.3.3节条件下对2010年10月采集的贼小豆样品进行6次平行测定,用Q检验法检验无可疑值后,计算各元素的精密度如表3所示。

表 3 精密度的测定结果(n=6)Table 3 Precision of the method (n=6)
由表3可知,样品测定的相对标准偏差(RSD)分别为砷2.2%、硒为0.97%、锑为2.6%。
2.8 回收率
在1.3.2节和1.3.3节条件下对各样品中的锑进行加标回收率实验,以6次平行测定的平均值报告,结果见表4。
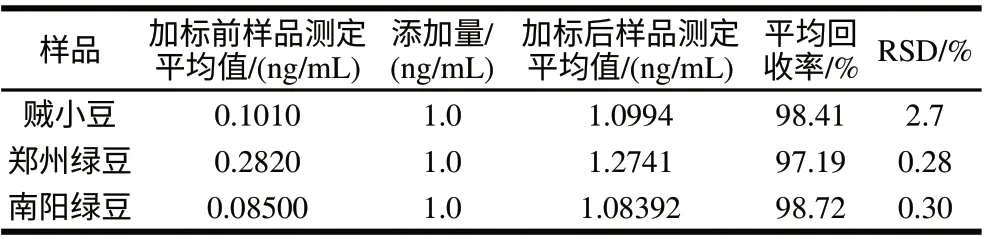
表 4 加标回收率测定结果(n=6)Table 4 Recovery of the method (n = 6)
表4表明,添加量1.0ng/mL条件下,测定锑的加标平均回收率为97.19%~98.72%,RSD为0.28%~2.7%。
2.9 测定结果
同一地方和位置采摘的贼小豆样品与绿豆样品对照,按1.3.2节和1.3.3节步骤对其中的砷、硒、锑元素分别进行6次平行测定,结果见表5。
从表5可以看出,同一地方和位置,2010年9月份采摘的贼小豆样品中测定的砷、硒、锑元素含量较高,之后采集的样品含量基本呈逐步下降态势。郑州绿豆中锑的含量大于贼小豆和南阳绿豆;南阳绿豆中砷的含量明显低于郑州绿豆和贼小豆,并低于砷的国家标准限量[3]。硒的含量高低顺序为:贼小豆>郑州绿豆>南阳绿豆。
表 5 样品中砷、硒、锑的测定结果(±s,n=6)Table 5 Determination of arsenic, selenium, and antimony in samples (±s,n=6)mg/kg

表 5 样品中砷、硒、锑的测定结果(±s,n=6)Table 5 Determination of arsenic, selenium, and antimony in samples (±s,n=6)mg/kg
元素贼小豆郑州绿豆南阳绿豆2010年9月采样2010年10月采样2010年11月采样2011年11月采样Sb 0.181±0.0050.101±0.0010.075±0.0280.065±0.016 0.282±0.007 0.085±0.004 As 0.280±0.0090.270±0.0260.143±0.350.127±0.013 0.268±0.004 0.096±0.019 Se 0.301±0.0020.254±0.0020.210±0.0080.215±0.020 0.175±0.031 0.168±0.001
3 结 论
用硝酸-过氧化氢微波程序消解样品,以硫脲为掩蔽剂、硼氢化钾为还原剂,采用1.2mol/L盐酸为稀释液,0.24mol/L的盐酸为载液,将微波程序消解技术与PF6-3型多道原子荧光光谱仪结合,充分发挥了各自的优点,同时测定样品中的砷、硒和锑。耗时少、成本低、减少了污染,提高了工作效率,应用于样品测定,结果满意。研究结果表明:郑州贼小豆和郑州绿豆中锑的含量存在明显的差异,贼小豆样品中硒的含量高于绿豆样品。为进一步开发利用贼小豆自然野生资源提供了基本数据,为其他食品中砷、硒、锑元素的同时测定提供了技术参考,有一定的推广应用价值。
[1] 张建. 微波消解-原子荧光法测定食品中的砷[J]. 计量与测试技术, 2010, 37(4): 81-84.
[2] 高向阳, 王翠, 张平安, 等. 小麦中有害元素砷的测定及其生物吸收比的研究[J]. 食品科学, 2007, 28(7): 407-410.
[3] 卫生部、国家标化管理委员会. GB2762—2005 食品中污染物限量[S]. 北京: 中国标准出版社, 2005.
[4] 那斯琴高娃, 其其格, 乌尼尔, 等. 微波消解-原子荧光光谱法测定乳和乳制品中的锑[J]. 中国乳品工业, 2010, 38(11): 48-50.
[5] JOHNSON C C, FORDYCE F M, RAYMAN M P. Factors controlling the distribution of selenium in the environment and their impact on health and nutrition[J]. Proceedings of the Nutrition Society, 2010, 69(Suppl 1): 119-132.
[6] 徐文军. 顺序注射氢化物发生-原子荧光光谱法测定富硒鸡蛋中的硒[J]. 食品科学, 2007, 28(8): 318-321.
[7] 张万锋. 超声波提取氢化物发生原子荧光测定茶叶中的硒[J]. 陕西农业科学, 2009, 55(2): 35-36.
[8] 中国科学院中国植物志编辑委员会. 中国植物志: 第41卷[M]. 北京: 科学出版社, 1995: 285 .
[9] 宋晓寒, 韩帅, 高向阳, 等. 微波消解-浓度直读法快速间接测定贼小豆中的微量铝[J]. 河南科学, 2011, 29(7): 795 -798.
[10] 高丽娜, 边疆. 氢化物发生-原子荧光光谱法同时测定保健食品中砷和锑[J]. 中国卫生检验杂志, 2006, 16(11): 1333-1334.
[11] 马小宁, 罗瑞峰. 双道原子荧光光谱法同时测定农产品中的砷和硒[J]. 光谱实验室, 2007, 24(3): 403-405.
[12] 张遴, 乐爱山. 氢化物发生-原子荧光光谱法同时测定与食品接触容器中砷、锑溶出量[J]. 食品科学, 2008, 29(1): 267-269.
[13] 沈锋. 氢化物原子荧光光谱法同时测定食品中砷和硒[J]. 中国实用医学, 2009, 15(4): 242-244.
[14] 赵舒景, 吉耀召, 张向红, 等. 食品中微量硒、砷的微波溶样-原子荧光测定法[J]. 动物医学防制, 2007, 23(7): 548-549.
[15] 赵飞蓉, 彭谦, 陈忆文, 等. 微波消解原子荧光光谱法同时测定罐头食品中硒和锡的研究[J]. 中国卫生检验杂志, 2006, 16(11): 1295-1297.
[16] 王泽科, 程水连. 微波消解-原子荧光光谱法测定紧压茶叶中的锌、硒[J]. 食品与机械, 2011, 27(3): 79-81.
[17] 徐卫河, 韩华云, 郝庆秀. 乌梅中砷、汞、硒的微波消解-氢化物发生原子荧光法测定的研究[J]. 食品科技, 2008, 33(2): 231-233.
[18] 张锂, 陈慧, 韩国才. 微波消解-氢化物发生原子荧光法连续测定砷、硒、锑的研究[J]. 江西师范大学学报: 自然科学版, 2007, 31(3): 271-274.
[19] 卫生部, 国家标准化管理委员会. GB/T 5009.93—2010 食品中硒的测定[S]. 北京: 中国标准出版社, 2010.
[20] 卫生部, 国家标准化管理委员会. GB/T 5009.11—2003 食品中总砷和无机砷的测定[S]. 北京: 中国标准出版社, 2003.
[21] 卫生部, 国家标准化管理委员会. GB/T 5009.137—2003 食品中锑的测定[S]. 北京: 中国标准出版社, 2003.
