染菌培养干辣椒挥发性风味化合物的分析及变化特征
2013-12-23丁筑红郑文宇王知松
丁筑红,刘 海,郑文宇,王知松
(贵州大学生命科学学院,贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
我国辣椒产量居全球之首,产值在全国各类蔬菜中居于首位[1]。干辣椒是成熟红辣椒经自然或人工干制后的产品,是日常餐桌食品、风味食品、调味品生产中的主要原料,目前生产主要采用自然干制和简易烘房干制技术,包装贮藏措施简单粗放,极易染菌,导致在贮藏期出现大量变质椒和变色“花壳”椒[2],其中细菌主要以杆菌为主,真菌主要是曲霉属和根霉属,其中黑曲霉最易污染[3]。目前,国内外在辣椒及辣椒加工中进行风味品质研究报道不多[4],主要针对鲜椒挥发性风味物质提取方法、风味化合物组成、风味描述进行相关研究,而干制辣椒风味化合物分析报道则主要涉及不同处理干辣椒产品风味物质提取方法、风味物质构成及风味特征研究[5-11]。生产中干辣椒原料带菌量大,而微生物对干辣椒风味品质影响方面缺乏关注和研究。电子鼻是根据仿生学原理,由传感器阵列和自动化模式识别系统所组成。它是一种新颖的分析、识别和检测复杂气味和大多数挥发性成分的仪器。在食品生产中,可应用于乳品和肉制品品质监控[12-13]。然而,采用电子鼻检测辣椒风味的相关报道甚少。本实验采用顶空固相微萃取和气质联用(headspace solid phase microextraction combined with gas chromatography-mass spectrometry,HS-SPME-GC-MS)风味化合物分析技术,结合电子鼻检测技术,探讨主要污染菌对干辣椒接种培养后干椒挥发性风味化合物构成及风味品质的变化特征,全面把握干椒染菌前后以及各菌株染菌样品间风味差异性,有利于全面评价干椒品质,并为辣椒生产加工中品质控制提供更多有价值的参考依据。
1 材料与方法
1.1 材料
1.1.1 原料
贵阳市花溪区党武乡新鲜成熟红辣椒,清洗沥干,60℃电热烘干至质量恒定后,粉碎至1~2mm大小,得辣椒粉备用。
1.1.2 菌种
选用自然干制辣椒优势易染菌,均由本实验室提供,从自然干制辣椒样品中分离纯化,4~6℃冰箱保存试管菌种。I号:唾液乳杆菌(Lactobacillus salivarius),II号:反刍真杆菌(Eubacterium ruminantium);III号:黑曲霉(Aspergillus niger)。
1.2 仪器与设备
手动SPME进样器、75μm CAR/PDMS萃取头(100μm聚二甲基硅氧烷(PDMS)萃取头) 美国Supelco公司;HP6890/5975C型GC/MS联用仪 美国安捷伦公司;FOX4000型电子鼻、自动进样器HS100、αSOFTV12软件 法国Alpha MOS公司。
1.3 方法
1.3.1 样品处理
取100g辣椒粉平铺于白瓷盘上,料层厚度1.5cm,润水30%,置于功率为7.7kW微波炉焙烤杀菌,时间4min[14]。将唾液乳杆菌和反刍真杆菌分别接种于50mL无菌营养肉汤液体培养基中扩大培养24h,并将黑曲霉接种于马铃薯葡萄糖水中扩大培养36h,制作菌悬液。将上述焙烤后辣椒粉称取10g于培养皿中,以无菌操作接种5mL上述单一菌悬液,同时注入5mL灭菌蒸馏水,接种唾液乳杆菌和反刍真杆菌的培养皿放入37℃恒温培养箱培养,接种黑曲霉的培养皿放入37℃恒温培养箱培养,其间补充水分,培养15d。
1.3.2 挥发性物质的检测
1.3.2.1 样品风味物质提取
采用固相微萃取法,参照朱晓兰的方法[15]将样品于60℃条件下恒温10min后,插入固相微萃取头,保持60℃顶空吸附30min后,取出插入GC-MS进样口,解吸5min。
1.3.2.2 GC-MS条件
色谱柱H P - 5 M S 5 % P h e n y l M e t h y l Siloxane(30m×0.25mm,0.25μm)弹性石英毛细管柱,柱温45℃(保留0.5min),以5℃/min升温至290℃,保持2min;汽化室温度250℃;载气为高纯(99.999%)He;柱前压7.62psi,载气流量1.0mL/min;分流比20:1。质谱条件:离子源为电子电离(electron ionization,EI)源;离子源温度230℃;四极杆温度150℃。
1.3.3 辣椒粉品质电子鼻检测
载气:合成干燥空气,流速:150mL/min;小瓶中样品体积10mL,样品质量0.4g;顶空产生时间900s,产生温度60℃,搅动速度500r/min;顶空注射体积0.7mL,注射针总体积5.0mL,注射速度0.7mL/s,注射针温度70℃;参数获取时间120s;延滞时间360s。
2 结果与分析
2.1 染菌干辣椒挥发性物质GC-MS结果分析
干辣椒经接种菌种并培养后,比较其挥发性成分的变化情况,结果如图1、表2所示。
由图1可以看出,各样品挥发性风味物质的出峰时间主要集中在30min之前,对照组与唾液乳杆菌、反刍真杆菌、黑曲霉组比较,分别于1.82、2.52、3.57、2.52min开始出峰,对照样品出峰时间较处理组早,在10min以前分别检出14、6、5、6种风味化合物,检出物相对含量分别为27.090%、2.009%、1.230%、0.814%。10~20min出峰期分别检出21、15、20、13种风味化合物,相对含量分别为35.664%、11.187%、15.738%、3.797%,可见对照组低分子挥发性物质种类较处理组多,相对含量较高。20min后各样品检出22、29、30、34种,相对含量分别为35.029%、86.803%、83.033%、95.370%。可见,经受试菌处理的样品出峰时间基本向后迁移,出峰集中在20min后,其间大分子物质检出较多。对辣椒呈味贡献较少,因而使辣椒原有风味特征变化、风味品质改变明显。
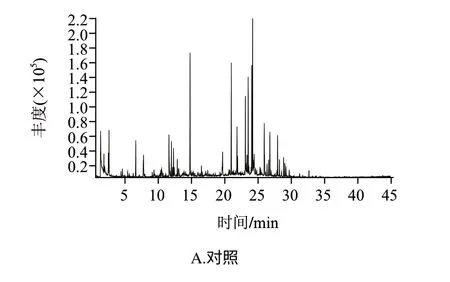
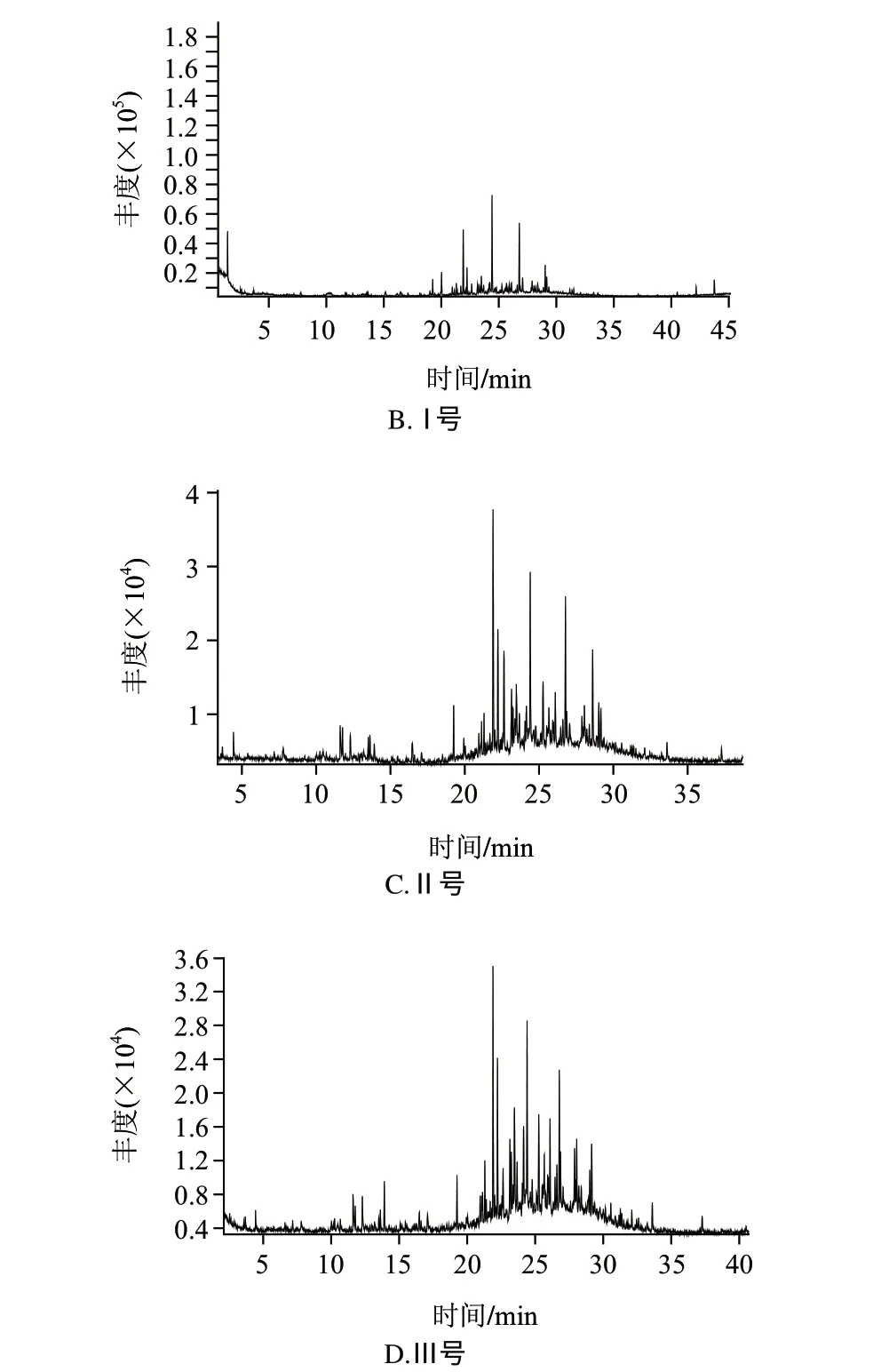
图 1 染菌干辣椒挥发性物质总离子流图Fig.1 Total ion chromatogram of volatile components in chili pepper samples
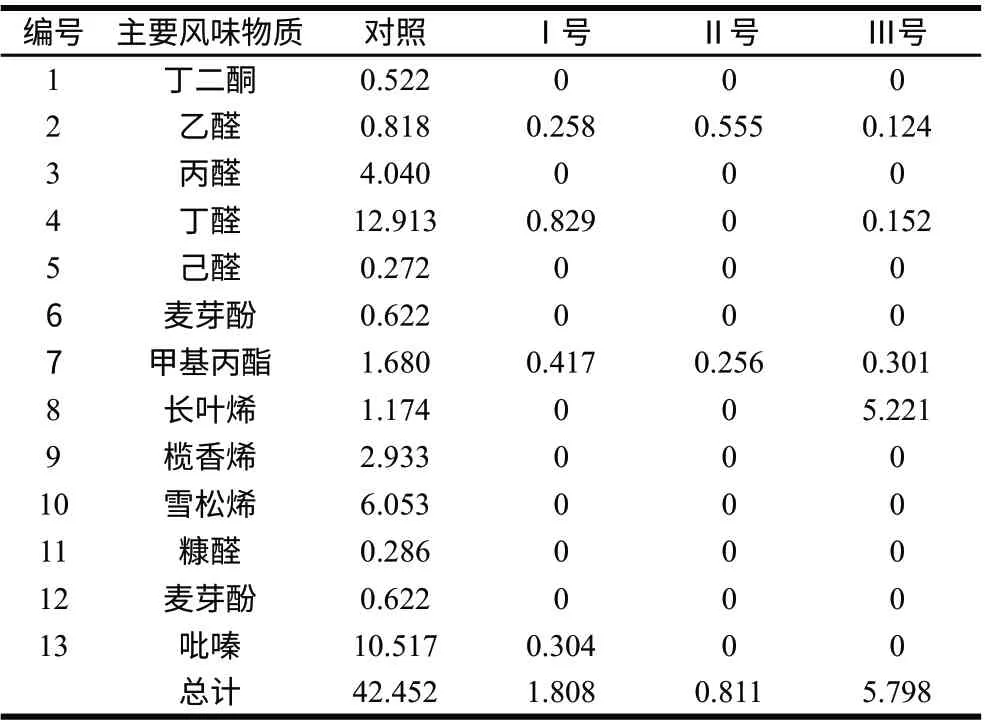
表 1 染菌干辣椒主要挥发性物质相对含量 Table 1 Relative contents of main volatile compounds in chili pepper samples%
通过比较干辣椒中对风味品质有积极贡献的主要挥发性风味化合物[16],从表1可以发现,在对照组原料鉴定结果的主要13种类挥发性成分中,染菌组仅检出2~4种,相对含量也由对照组42.452%降至染菌组的0.811%~5.798%,从而基本上丧失了原料风味特征,产生其他类型产物。
对各处理样品质谱检测解谱后干椒挥发性风味化合物种类统计结果比较,结果如表2所示。结果发现,对照组、以及经唾液乳杆菌、反刍真杆菌、黑曲霉接种培养干辣椒粉进行可挥发性风味物质分离检测,分离定性的可挥发性风味物质分别为57、50、55、53种,染菌后干椒挥发性风味化合物较对照组有所减少。分离和定性的可挥发性风味物质中,处理组与对照组相比,烷烃类化合物组含量增加突出,检出物由9种增加到17~21种,相对含量由17.862%上升到56.704~70.81%,从质谱图谱结果看出,烷烃类化合物集中出现在20min后,主要为大分子烷烃,而大分子烷烃类有呈香特性较弱[16],从而对辣椒风味贡献意义不大。
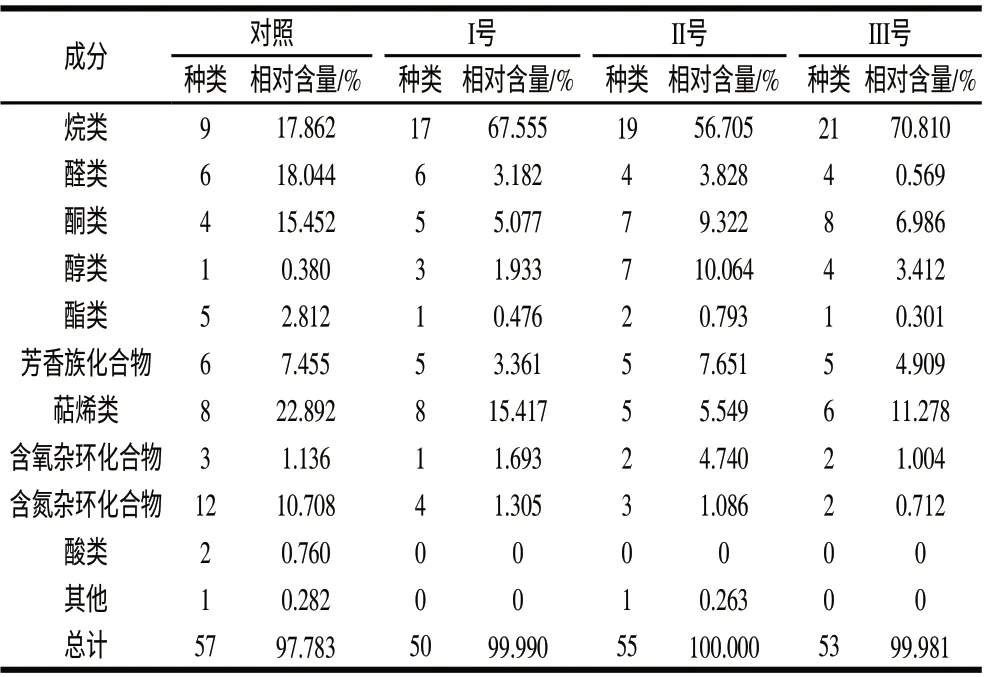
表 2 样品挥发性风味成分种类及相对含量Table 2 Kind and contents of volatile flavor compounds in dried chili peppers
处理组与对照组相比,醛类、相对含量从18.044%、减少到0.569%~3.828%;酮类化合物由15.452%减少到5.077%~9.322%;脂类化合物由2.812%,减少到0.301%~0.793%;具有焙烤香气特性的氮杂环化合物、吡嗪类以及萜烯类化合物[17]经染菌培养后均有所降低,含氮杂环化合物由原有的12种,减少到2~4种,相对含量由10.708%减少到0.712%~1.305%,萜烯类化合物由22.892%减少至5.549%~15.417%。结果发现,微生物染菌培养后,醇类含量有所增加,醇类化合物种类由对照的1种增加到3~7种,相对含量由对照组的0.380%增加到1.933%~10.064%,可能与微生物存在的发酵作用有关,醇类化合物中,C10以上的高碳饱和醇,从其呈味特征来看,气味一般很弱或无嗅感[19],而具有良好风味的醇类相对含量不高,其中苯乙醇的相对含量占0.12%~0.95%,3-甲基-戊醇的相对含量占0.238%、2-乙基-1-己醇0.203%、沉香醇0.552%、叶绿醇2.552%~2.736%。可见,辣椒粉经微生物作用后多数具有芳香性化合物的相对含量都急剧减少,种类减少也比较明显。醇类含量有所增加,可能与微生物发酵作用有关,但因在整体风味化合物中含量有限,其积极的作用难以体现。同时,对香味贡献不大的烷烃类化合物种类相对含量急剧增加,削弱了辣椒的整体良好风味。Cremer等[18]采用顶HS-GS以及SPME提取,GC-MS检测,分析加热后辣椒风味形成动态变化规律,发现热处理后辣椒烷烃类迅速增加,而本实验则进一步发现,微生物污染导致辣椒烷烃类成分较单一热处理的对照大幅度增加。
2.2 电子鼻传感器对辣椒粉挥发性物质的响应结果
为验证电子鼻传感器对干辣椒样品检测的重复性,不同实验样品在优选传感器的检测值(峰高)的相对标准偏差(RSD)如表3所示,从表3可以看出,RSD范围为-4.86%~2.87%,平均相对误差为0.5025%,样品在传感器上具有良好的重现性,实验用电子鼻选用的金属传感器对辣椒挥发性物质具有较好的响应值,适用于辣椒挥发性物质的检测。
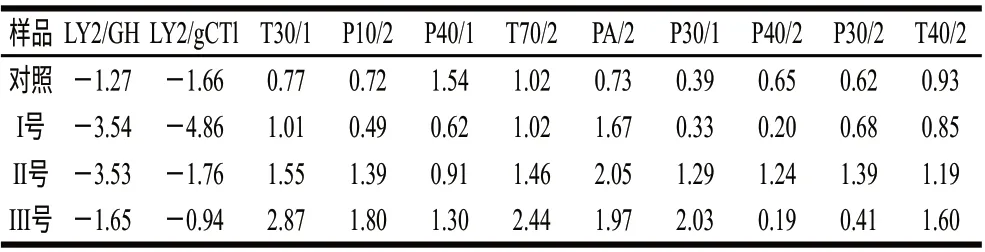
表 3 样品在传感器上的相对标准偏差(RSD)Table 3 Relative standard deviations for detection of dried chili peppers on different sensors%
2.3 电子鼻对干辣椒分析结果
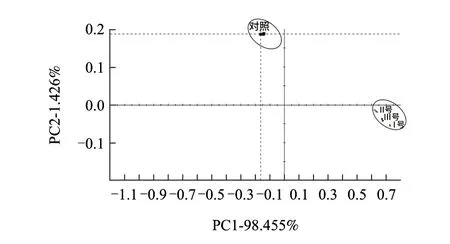
图 2 辣椒样品的电子鼻响应信号的主成分分析(PCA)Fig.2 PCA of electronic nose response signals for dried chili peppers
样品电子鼻检测结果主成分分析图如图2所示。选取2个主成分拟合原数据,PCA的结果可以看出,其中第1和第2主成分的方差贡献率分别为98.455%和1.426%,累计达99%以上,说明PC1和PC2已经包含很大的信息量,能够反映样品的整体信息,贡献率越大说明辣椒气味变化主成分能较好地被区分,主成分PC1贡献率达98.455%,说明主要是第1主成分对样品起作用,在染菌处理组中贡献大。由图2发现,处理组风味改变十分明显,从分布的区域来看,很有规律性,相对对照组来说处理组气味主成分是沿着PC2轴向下分布,同时沿着PC1轴向右分布。其中对照组第二象限内,处理组分不在第四象限内。各样品的差异主要表现在PC1上,PC2主成分也存在差异。对照与处理样品的气味分布距离较远,处理组间气味分布的区域较为接近,该电子鼻系统利用PCA能判定对照组与3种处理组风味特征有明显差异,但处理组间的差异较小。
实验将各样品在18个传感器上的最大响应信号进行了对比,如图3所示,通过各传感器信号的对比得样品相似图谱处理组样品在传感器上的响应值均较小,且响应值都低于对照样品,电子鼻检测唾液乳杆菌、反刍真杆菌、黑曲霉处理组辣椒粉与对照样品相似程度分别为21.64%、31.17%、26.69%,说明微生物污染辣椒样品中挥发性物质较对照样品明显不同,含量明显降低,传感器对风味物质响应值下降,而处理组间风味响应值差异性较小。
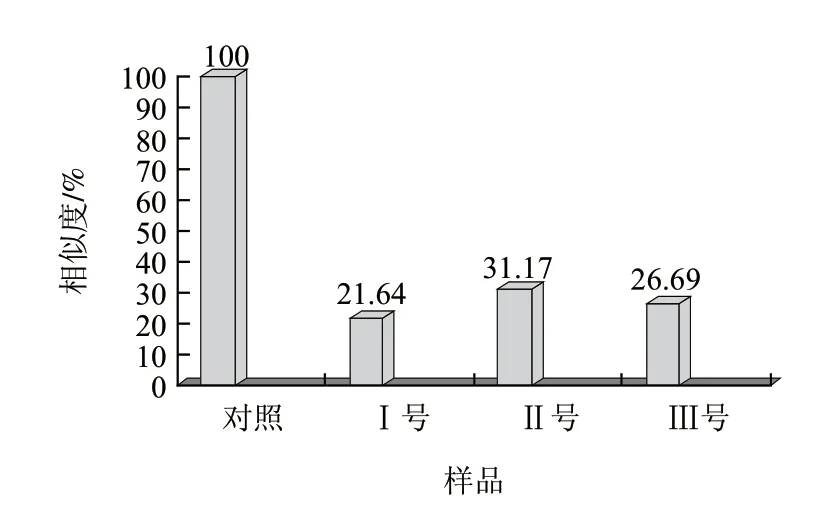
图 3 对照组与处理组气味相似度Fig.3 Odour similarity between control and experimental samples
3 结 论
通过SPME-GC-MS检测,获得干辣椒在染菌后风味化合物变化的基本特点,其出峰时间大多在20min后,明显向后迁移,且为大分子挥发性成分,且占检出物含量的83.033%~95.370%,对辣椒呈味贡献较少,如烷烃类化合物种类相对含量急剧增加,削弱了辣椒的整体良好风味,使辣椒原有风味特征弱化。同时,多数具有芳香性化合物的相对含量都急剧减少,种类减少也比较明显,具良好的风味特性的醛类、酮类、酯类、吡嗪类,萜烯类化合物经过微生物染菌培养后呈下降趋势。醇类含量有所增加,可能与微生物发酵作用有关,但因在整体风味化合物中含量有限,其积极的作用难以体现。同时,在SPME-GC-MS检测方法对样品中风味物质的具体种类和含量进行检测与比较基础上,通过电子鼻分析风味物质总体特征及处理样品间风味差异性大小,电子鼻的相似图谱显示,对照组与处理组风味特征相似度低,仅为21.64%~31.17%。
干辣椒作为传统大宗调味品原料,风味品质是产品品质主要的评价指标,目前市场上干椒原料及相关低水分产品微生物染菌严重[3],微生物对干辣椒营养安全带来隐患已成共识,但对干辣椒风味品质造成的影尚并未引起足够重视。科学完善干辣椒及辣椒粉产品质量安全标准以及生产规范化管理具有重要意义。
[1] 李萌, 龙彭年, 肖四海. 世界辣椒产业经济发展状况与我国的对策思考[J]. 辣椒杂志, 2010(4): 1-5.
[2] 李明远, 武东繁. 干辣椒“虎皮”原因的调查与研究[J]. 植物保护, 1994(2): 21-22.
[3] 张春燕, 蔡静平, 潘峰. 低水分辣椒粉带菌状况及控制技术的研究[J]. 食品科学, 2007, 28(1): 131-134.
[4] 罗凤莲, 欧阳建勋, 夏延斌. 发酵辣椒中主要风味物质的研究进展[J]. 食品工业科技, 2009, 30(7): 346-348.
[5] JUNIOR S B, de MARCHI A, de MELO T , et al. Optimization of the extraction conditions of the volatile compounds from chili peppers by headspace solid phase micro-extraction[J]. Journal of Chromatography A, 2011, 1218(38): 3345-3350.
[6] MAZIDA M M, SALLEH M M, OSMAN H. Analysis of volatilearoma compounds of fresh chilli (Capsicum annuum L.) during stages of maturity using solid phase microextraction (SPME)[J]. Journal of Food Composition and Analysis, 2005, 18(5): 427-437.
[7] RONG Liu, KE Xiong, YANG Chaoluo. Changes in volatile compounds of a native Chinese chilli pepper (Capsicum frutescens var) during ripening[J]. International Journal of Food Science & Technology, 2009, 44(12): 2470-2475.
[8] GUADAYOL J M, CAIXACH J, RIBÉ J. Extraction, separation and identification of volatile organic compounds from paprika oleoresin (Spanish type)[J]. Agric Food Chem, 1997, 45(5): 1868-1872.
[9] ROTSATCHAKUL P, CHAISERI S, CADWALLADER K R. Identification of characteristic aroma components of thai fried chili paste[J]. Agric Food Chem, 2008, 56(2): 528-536.
[10] van RUTH S M, ROOZEN J P. Gas chromatography/sniffing port analysis and sensory evaluation of commercially dried bell peppers (Capsicum annuum) after rehydration[J]. Food Chemistry, 1994, 51(2): 165-170.
[11] COOPER T H, GUZINSKI J A, FISHER C. Improved highperformanse liquid chromatography method for the determiation of major capsaicinoids in capsicum oleoresins[J]. Agric Food Chem, 1991, 39(12): 2253-2256.
[12] YANG Yongjuan, DING Zhuhong. Clustering analysis of volatile aroma compounds in dried chilli (Capsicum annum L.)[J]. Food Science, 2010, 31(4): 187-189.
[13] 徐亚丹, 王俊, 赵国军. 基于电子鼻的对掺假的“伊利”牛奶的检测[J]. 中国食品学报, 2006, 6(5): 111-117.
[14] 李达. 辣椒粉调味品工艺技术与风味品质相关性研究[D]. 贵阳: 贵州大学, 2010.
[15] 朱晓兰, 刘百战, 宗若雯. 辣椒油化学成分的气相色谱-质谱分析[J]. 分析测试学报, 2003, 23(1): 67-68.
[16] van RUTH S, BOSCAINI E, MAYR D, et al. 干辣椒风味物质气相色谱及质谱方法的研究[J]. 辣椒杂志, 2007(1): 41-44.
[17] 李达, 王知松, 丁筑红. 固相微萃取-气-质联用法对干椒烘焙前后风味化合物的分析评价[J]. 食品科学, 2009, 30(16): 269-271.
[18] CREMER D R, EICHNER K. Formation of volatile compounds during heating of spice paprika (Capsicum annuum) powder[J]. Agric Food Chem, 2000, 48(6): 2454-2460.
