正交试验优化鼠曲草色素提取及其稳定性
2013-12-23陈霞霞郑易林万力婷陈伊梦王鸿飞
丁 月,徐 超,陈霞霞,郑易林,万力婷,陈伊梦,王鸿飞*
(宁波大学食品科学与工程系,浙江 宁波 315211)
鼠曲草(Herba Gnaphaii Affinis),为菊科鼠曲草属,又称清明菜、佛耳草等,主要以野生为主,分布于长江中下游一带,如浙江、福建、江苏等省份,《本草拾遗》记载:鼠曲草性味甘、平,无毒,具有止咳化痰、降血压、平喘、解毒等功效[1]。作为一种野生蔬菜,鼠曲草不仅富含人体所必需营养物质,更含有对人体有益的功能因子如黄酮、挥发油、豆甾醇等,有治疗特性,花、根、叶可以药用[2-3]。鼠曲草色素属于叶绿素,在自然状态下主要以叶绿素、叶黄素等形式存在,颜色表现为绿色、浅黄色。本实验以鼠曲草为原料,采用乙醇浸提法提取鼠曲草色素,分别研究乙醇体积分数、料液比及浸提时间等因素对浸提效果的影响,通过L9(34)正交表排列优化提取工艺参数,同时研究了光照、温度、溶液pH值及食品添加剂对鼠曲草色素稳定性的影响。
1 材料与方法
1.1 材料与仪器
鼠曲草 江苏沛县野生蔬菜研究所。
高速药物粉碎机 山东青州市精诚机械有限公司;紫外分光光度计 美国瓦里安技术中国有限公司;电热鼓风干燥箱 重庆银河实验仪器有限公司;电子天平 余姚市金诺天平仪器有限公司;酸度计 美国Thermo公司。
1.2 方法
1.2.1 鼠曲草色素提取工艺流程
新鲜鼠曲草→烘干→粉碎→过筛(60目)→称质量→乙醇浸提
将新鲜鼠曲草于105℃烘干2h,粉碎后过60目筛得到均匀的鼠曲草粉末,称取相同质量的粉末特定条件下进行乙醇浸提。
采用分光光度法,以丙酮为提取剂[4],经测定鼠曲草中叶绿素含量为0.615mg/g。
1.2.2 鼠曲草光谱特性研究
用乙醇溶解色素干粉,以乙醇溶液作为空白对照,于200~800nm波长下,在紫外-可见分光光度计上测定溶液的吸光度,绘制鼠曲草色素的吸收光谱图,确定λmax。
1.2.3 正交试验设计
以吸光度为考察指标,分别研究乙醇体积分数、料液比及浸提时间等单因素对浸提效果的影响。在单因素试验的基础上,采用3因素3水平,按L9(34)正交表排列优化乙醇浸提工艺参数,因素水平设计表见表1,每组试验重复3次。

表 1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
1.2.4 鼠曲草原液的制备
将采集的新鲜鼠曲草于105℃烘干2h,粉碎后过60目筛得到均匀的鼠曲草粉末,称取相同质量的粉末特定条件下进行乙醇浸提。根据鼠曲草最优提取方案,在90%乙醇溶液、浸提时间100min、料液比1:300条件下浸提后,用抽滤装置抽滤浸提液,所得液体即为色素原液。
1.2.5 光照对鼠曲草氧化稳定性的影响
分别取等量鼠曲草色素提取液置于15支试管中,每5支为一组,调节溶液pH值至7,然后分别置于避光,自然光照射处和紫外光照射处,在1、2、3、4h时测其在波长416nm处的吸光度。
1.2.6 温度对鼠曲草氧化稳定性的影响
分别取等量鼠曲草色素提取液3 份,分别放入30~90℃的水浴锅中保持1h,取出冷却并调节溶液pH值至7,测其在波长416nm处的吸光度[5]。
1.2.7 溶液pH值对鼠曲草氧化稳定性的影响
取等量鼠曲草色素提取液6份,分别用已配制好的0.1mol/L NaOH溶液和0.1mol/L HCl溶液标准溶液pH值分别调至5~10,放置1h后,测其在416nm波长处的吸光度[6]。
1.2.8 食品添加剂对鼠曲草氧化稳定性的影响
取等量稀释鼠曲草色素提取液多份,分别加入0.1mol/L NaCl,蔗糖溶液,Fe3+、Cu2+、Al3+、Ca2+、Mg2+、Zn2+溶液,于室温避光条件下放置1h后,测其在416nm波长处的吸光度[7]。
2 结果与分析
2.1 鼠曲草色素最大吸收峰波长的确定
在200~800nm波长范围内对鼠曲草色素提取液进行扫描,结果如图1所示。

图 1 鼠曲草色素此外光光谱图Fig.1 UV-spectrum of pigment from Herba Gnaphaii Affinis
由图1可知,鼠曲草色素在400~700nm间有两个吸收峰,其中416nm处呈现明显的最大吸收峰,因此,选定416nm作为测定鼠曲草色素的最大吸收波长。
2.2 乙醇体积分数对鼠曲草色素提取效果的影响

图 2 乙醇体积分数对浸提效果的影响Fig.2 Effect of ethanol concentration on extraction efficiency
由图2可知,在料液比1:100,室温25℃浸提60min条件下,随乙醇体积分数的增加,吸光度先上升后下降,在体积分数达到80%时到达最大值,表明80%乙醇体积分数是提取鼠曲草色素的适宜体积分数。
2.3 浸提时间对鼠曲草色素提取效果的影响

图 3 浸提时间对提取效果的影响Fig.3 Effect of extraction time on extraction efficiency
由图3可知,在乙醇体积分数80%、料液比1:100,室温25℃条件下,随浸提时间的延长,鼠曲草色素提取液的吸光度逐渐升高,在浸提时间为80min时,吸光度达到最大值;再延长浸提时间至140min,提取液的吸光度变化不明显,为了节省实验时间并达到最理想的提取效果,确定80min为较优化的提取时间。
2.4 料液比对鼠曲草色素提取效果的影响

图 4 料液比对浸提效果的影响Fig.4 Effect of solid to liquid ratio on extraction efficiency
由图4可知,在乙醇体积分数80%、料液比1:100、室温25℃、浸提80min条件下,随着浸提液用量的增加,鼠曲草色素提取液的吸光度先升高后降低,在料液比为1:200是呈现最大值,表明料液比为1:200时,鼠曲草色素提取效果最佳。
2.5 正交试验结果分析

表 2 正交试验设计与结果分析Table 2 Trials and results of orthogonal experiment
采用L9(34)正交试验设计,对乙醇体积分数、料液比、浸提时间在3个不同水平上进行优化试验,结果见表2。根据表2的计算结果可知,鼠曲草色素提取液的乙醇体积分数、料液比、浸提时间的极差分别为0.279、0.015、0.085,各因素对鼠曲草中色素浸提的影响的主次顺序为乙醇体积分数>浸提时间>料液比。鼠曲草色素提取的最适工艺为A3B3C3,即乙醇体积分数90%、浸提时间100min、料液比1:300(g/mL),在此工艺下提取的溶液吸光度最大。
2.6 鼠曲草色素稳定性研究
2.6.1 鼠曲草色素光稳定性

图 5 光照对鼠曲草色素稳定性的影响Fig.5 Effect of light exposure on the stability of pigment from Herba Gnaphaii Affinis
由图5可知,随着光照时间的延长,吸光度逐渐降低。当光照时间小于4h时,吸光度基本稳定,表明色素不易受光照影响;当光照时间超过5h时,吸光度降低明显,表明色素稳定性易受光照影响,光照时间越长,色素被破坏的可能性越大[8-9]。因此,色素应该在避免光照条件下保存。
2.6.2 鼠曲草色素热稳定性

图 6 温度对鼠曲草色素稳定性的影响Fig.6 Effect of temperature on the stability of pigment from Herba Gnaphaii Affinis
由图6可知,当温度低于70℃时,随着温度的增加,吸光度基本稳定,表明鼠曲草色素热稳定性较好;当温度为70℃时,吸光度达到最低;当温度高于70℃时,吸光度随着温度的升高而增大,一方面可能是由于溶液中存在辅色因子,随着温度的升高,辅色物质逐渐释放[10];另一方面可能是由于温度升高,温度大于80℃时,导致乙醇(沸点78℃)挥发增加,从而引起溶液浓缩,吸光度变大。因此,鼠曲草色素应该在较低温度下保存。
2.6.3 鼠曲草的酸碱稳定性
由图7可知,溶液吸光度随着溶液pH值的增大而逐渐增大。当溶液pH值小于7时,吸光度降低,色素稳定性较差,当溶液为pH值大于7时,色素稳定性相对较好。因此,鼠曲草色素在碱性或者中性溶液中稳定性较好,应该避免在酸性溶液中保存[11]。

图 7 pH值对鼠曲草稳定性的影响Fig.7 Effect of pH on the stability of pigment from Herba Gnaphaii Affinis
2.6.4 金属离子对鼠曲草色素稳定性的影响
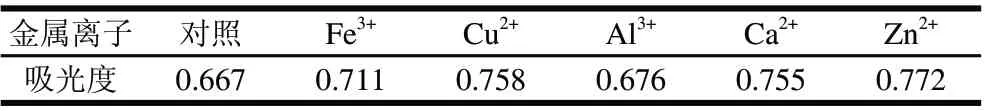
表 3 金属离子对鼠曲草色素稳定性的影响Table 3 Effect of metal ions on the stability of pigment from Herba Gnaphaii Affinis
由表3可知,Cu2+、Ca2+及Zn2+对色素影响较大,Al3+和Fe3+对色素影响较少。蔗糖和食盐对提取液色素的稳定性基本无影响,金属离子对色素溶液有一定影响,一方面可能是由于金属离子溶液本身有色泽;另一方面可能是由于色素分子与金属离子形成了螯合物导致溶液吸光度升高或者降低[12-13]。
3 结 论
在单因素试验的基础上,进行L9(34)正交试验,得到乙醇浸提鼠曲草最适宜的提取工艺参数为:乙醇体积分数90%、料液比1:300(g/mL)、浸提时间100min。通过鼠曲草色素稳定性的研究表明,光照及温度对色素稳定性较少,不过色素应避免长时间光照和高温下保存;溶液pH值对色素有一定的影响,色素应该保存在酸性或者中性溶液中;Cu2+、Ca2+及Zn2+等金属离子会影响色素的稳定性,在保存过程中应该避免与这些金属离子接触。
通过对其稳定性及着色力的应用实践,该色素的稳定性良好、不易受外界因素影响,是一种良好的常用食品染色剂。晋江民间清明节常采摘鼠曲草做糕,成为“鼠曲饼”,有的地区已将该类植物开发制备成特色佳肴。总之,该类植物是具有浓郁民族色彩的食用资源植物[14-16]。再加上其色素稳定性好,染色性强,鼠曲草也是集营养、保健、药用功能于一体的野生植物资源[17],在食品添加剂、天然化妆品等方面均具有良好的开发前景。对鼠曲草色素提取工艺和稳定性进行分析研究,以期能对未来可能的开发起到一定的指导作用。
[1] 王世宽. 功能型野生蔬菜: 鼠曲草的开发利用[J]. 北方园艺, 2006, 8(2): 74-75.
[2] 侯晓艺, 巩江, 高昂, 等. 鼠曲草属植物药学研究概况[J]. 山东中医药大学学报, 2011, 35(4): 372-373.
[3] 潘明, 邓贇, 郭脉玺. 鼠曲草挥发油的提取及GC-MS分析[J]. 食品工业科技, 2009, 30(6): 243-245.
[4] 邓祥元, 高坤, 张丽娟. 不同溶剂萃取桑叶叶绿素效率的初步研究[J]. 中国农学通报, 2011, 27(2): 389-394.
[5] 文廷刚, 杜小凤, 杨文飞, 等. 瓜蒌皮色素提取方法及其理化性质研究[J]. 食品科学, 2009, 30(5): 32-35.
[6] MATSUBARA K, KANEYUKI T. Antiangiogenic activity of nasunin, an antioxidant anthocyanin, in eggplant peels[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 6272-6275.
[7] 周宝利, 张琦, 叶雪凌, 等. 不同品种茄子果皮花青素含量及其稳定性[J]. 食品科学, 2011, 32(1): 99-103.
[8] 张蓝月, 刘念吗, 叶向斌. 天然色素的萃取与纯化[J]. 北方园艺, 2010, 5(20): 216-219.
[9] 席忠新, 王燕, 刘波, 等. 鼠曲草属植物化学成分与药理作用研究进展[J]. 医学导报, 2010, 29(11): 1462-1464.
[10] 李泽鸿, 张晓刚, 张璐, 等. 金盏菊花中色素的提取工艺及稳定性研究[J]. 食品科学, 2011, 32(8): 103-106.
[11] 张秀君, 孙钱钱, 乔双, 等. 菠菜叶绿素提取方法的比较研究[J]. 作物杂志, 2011, 3(6): 57-59.
[12] 杨青珍, 王锋, 孙元琳. 甜樱桃果实红色素的提取和稳定性研究[J]. 食品科学, 2010, 31(4): 120-122.
[13] 吴艳芳, 王新胜. 香花槐花色素的提取及其稳定性研究[J]. 中国酿造, 2011(4): 108-111.
[14] 杨金哲. 江南民间常用药: 鼠曲草[J]. 中国民间疗法, 2001, 9(8): 58.
[15] 展华. 鼠曲草与“清明果”[J]. 家庭中医药, 2008, 15(4): 73-74.
[16] 关佩聪, 罗冠英, 刘厚诚. 广东野生蔬菜资源的分类与利用[J]. 华南农业大学学报, 2000, 21(4): 7-12.
[17] 王世宽, 潘明, 任路遥. 大有开发前景的野生蔬菜: 鼠曲草[J]. 食品研究与开发, 2005, 12(4): 55-58.
