正交试验优化马铃薯龙葵素提取技术
2013-12-23肖文军李政泽
钟 源,肖文军,2,*,马 蕊,李政泽
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.湖南农业大学 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
马铃薯为茄科植物,与水稻、小麦、玉米、高粱并称为世界五大粮食作物。我国是世界上最大的马铃薯生产国,种植面积占世界的1/4,产量占1/5[1]。研究表明,马铃薯中含有一类叫龙葵素的生物碱类活性物质,通常被称为总糖苷生物碱[2],主要包括茄碱和卡茄碱两种[3];具有抑制消化道肿瘤细胞增殖、抗菌、驱虫等生理活性,因而具有很好的开发利用前景[4]。龙葵素在马铃薯中含量为3~10mg/100g[5-6];当马铃薯受到病菌感染、机械等损伤,发芽、变绿或腐烂时,龙葵素的含量会显著提高[7-8]。段光明等[9]研究了单溶剂法、双溶剂法、混合溶剂法对马铃薯龙葵素提取效果,提示混合溶剂提取法效果最好,但试剂成本过高。张薇等[10-11]在比较研究乙醇回流提取、双溶剂提取以及混合溶剂提取3种方法效果的基础上,对马铃薯龙葵素的微波辅助提取进行了工艺优化,但微波产生的高温易破坏龙葵素的结构,且溶剂易挥发。目前国内外对马铃薯的深加工主要集中于淀粉的提取与利用,而对其生物碱(龙葵素)、花色苷等生理活性成分则未能得到综合开发利用,不能满足马铃薯产业发展的要求。为此,本研究在利用正交试验优化双溶剂提取法和超声波辅助提取法提取马铃薯龙葵素的基础上,综合比较乙醇回流提取、微波辅助提取、双溶剂提取、超声波辅助提取4种方法对马铃薯龙葵素提取的效果;以期为马铃薯龙葵素的高效、绿色工业化生产提供科学依据,推动马铃薯产业的综合、高值化发展,具有重要意义。
1 材料与方法
1.1 材料、试剂与仪器
新鲜马铃薯,于室温遮光条件下放置10d左右,待马铃薯皮变绿,发出新芽,取其5mm左右厚的皮,放置60℃烘箱中烘干至恒质量,粉碎过筛备用。
龙葵素标准样品:α-茄碱(纯度≥95%) 美国Sigma 公司。
SK3300H 超声波清洗仪 上海科导超声波仪器有限公司;MM721AAU-PW美的微波炉 广东美的微波炉制造有限公司;UV-2600 型紫外-可见分光光度计 尤尼柯仪器有限公司。
1.2 方法
1.2.1 龙葵素检测[12]及标准曲线的制作
准确称取3mg龙葵素标准品,用1%硫酸溶解,定容至3mL,即得质量溶度为1g/L的龙葵素溶液。分别取龙葵素溶液0.2、0.4、0.6、0.8、1.0mL于5mL容量瓶中,用1%硫酸稀释到2mL,摇匀,即得质量浓度分别为0.1、0.2、0.3、0.4、0.5g/L的龙葵素标准系列溶液。取2mL,于冰水浴中缓慢加入5mL浓硫酸,其时间不少于3min,静置1min,加入1%甲醛2.5mL,其时间不少于2min,静置90min,取一定量进行全波长扫描,确定最大吸收波长为534nm,以2mL 1%的硫酸为空白,于534nm波长处测定吸光度,得到回归方程y=0.9237x+0.0132。
式中:c为样品吸光度对应的龙葵素质量浓度/(g/L);v为提取液的体积/mL;m为样品质量/g。
1.2.2 乙醇回流提取[10]
称取马铃薯皮20g于500mL圆底烧瓶,加入100mL 95%(V/V)乙醇,55~65℃回流提取4h。提取液过滤,50℃旋转浓缩至浸膏状,1%的硫酸多次溶解定容,紫外比色,计算得率,以下提取实验的提取液均按此处理。
1.2.3 微波辅助提取[11]
称取马铃薯皮10g于500mL烧杯,按乙醇:乙酸体积比为100:10,料液比1:20(g/mL),在540W微波功率下提取6min。抽滤后,将滤液和残渣分装入索氏提取器中,在55~65℃抽提16h。
1.2.4 双溶剂(乙醇-乙酸)提取[13-14]
1.2.4.1 单因素试验设计及方法
称取粒径为0.8mm的马铃薯皮20.0g若干份,置于500mL圆底烧瓶中,加入乙醇乙酸体积比为10:3的双溶剂300mL,浸泡搅拌15min,抽滤,将滤液和样品分装入索氏提取器中,80℃条件下提取18h。固定其他条件,分别考察提取时间(12~20h)、提取温度(50~80℃)、料液比(1:5~1:20)、pH值(2.7、2.9、3.2、4.5),对应的乙醇乙酸体积比分别为(10:4~10:1)、原料粒径(0.2~0.8mm)对提取效果的影响,探讨提取时间的影响时固定的提取温度为65℃,探讨原料粒径的影响时固定的乙醇乙酸体积比为10:2。
新会计制度更加重视《中华人民共和国会计法》、《中华人民共和国预算法》的作用,这在一定程度上对行政事业单位的财务工作者起到了规范作用。新制度涵盖了我国各级政府会计主体,对于我国行政事业单位会计信息的完整和准确性统计也更加便利。新会计制度对会计核算内容进行了增加与调整,同时实现了基建数据与会计“大账”数据合并,进一步完善了财政投入资金的会计核算,规范了非财政补助结转、结余及其分配的会计核算,明确了资产计价和入账计量原则,全面完善了科目体系和会计科目使用说明,进一步完善了财务报表体系。提高了会计核算信息的及时性、准确性。
1.2.4.2 正交试验设计及方法
在单因素试验基础上,固定提取温度70℃,按L9(34)进行正交试验,确定最佳提取工艺条件。
1.2.5 超声波辅助提取[15]
1.2.5.1 单因素试验设计及方法
称取粒径为0.8mm的马铃薯皮20.0g 5份,置于250mL锥形瓶中,加入pH3的70%乙醇100mL,70℃条件下,于超声波清洗仪中超声20min。固定其他条件,分别考察乙醇体积分数(10%~95%)、超声温度(40~80℃)、超声时间(10~40min)、pH值(用冰乙酸调节,1~5)、原料粒径(0.2~0.8mm)、料液比(1:5~1:20)对提取效果的影响。其中探讨乙醇体积分数的影响时固定的超声温度为65℃。
1.2.5.2 正交试验设计及方法
在单因素试验的基础上,固定乙醇体积分数70%、pH3,按L9(34)进行正交试验,确定最佳提取工艺条件。
2 结果与分析
2.1 双溶剂提取马铃薯龙葵素的工艺参数优化
2.1.1 双溶剂提取马铃薯龙葵素单因素试验结果与分析图1A显示,随着提取时间的延长,龙葵素的得率增大,当提取时间为18h时,提取效果最好;提取时间再延长,乙酸挥发增多,导致酸性过强,龙葵素结构破坏,提取效果下降。图1B表明,随着提取温度的升高,龙葵素得率增加,70℃时提取效果最好。温度进一步升高,得率呈下降趋势,其原因可能是龙葵素结构受到破坏。由图1C可知,随着料液比的增大,提取效果越好,当料液比达到1:15后,料液比再增大,龙葵素的得率增加不明显。从图1D可看出,随着提取料液pH值的降低,龙葵素得率增大,这是因为龙葵素显弱碱性,于强酸下可形成盐,溶解度增大;当pH值达到3.2时,提取效果增加不再明显,pH值达到2.9之后,酸性过强,龙葵素结构被破坏,提取效果下降。图1E表明,原料粒径由大变小,龙葵素得率先增大后减少,粒径为0.45mm时提取效果最好。原料经粉碎后粒度变小,表面能增加,浸出速度加快,粒度越小,比表面能越大,浸出速度越快。但粉碎过细,样品粉粒表面积过大,吸附作用增强,反而影响扩散速度,并不利于有效成分的溶出。


图 1 双溶剂提取各单因素条件对提取效果的影响Fig.1 Effect of single factors on extraction efficiency by dual solvent extraction
2.1.2 双溶剂提取马铃薯龙葵素的正交试验
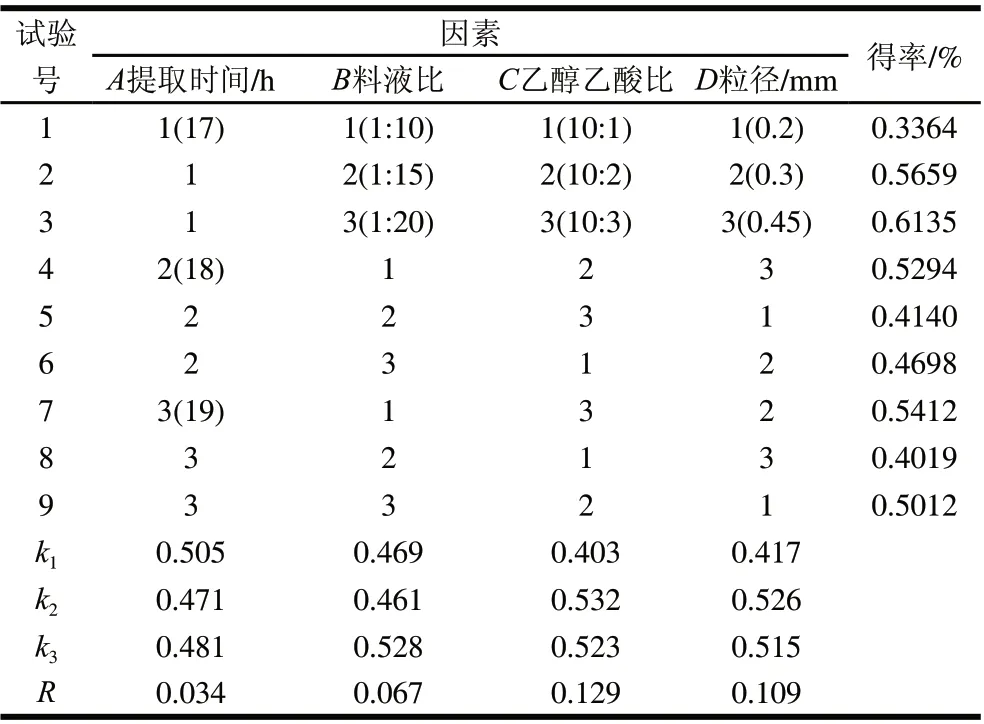
表 1 双溶剂提取马铃薯龙葵素正交试验设计及结果Table 1 Experimental design and results of orthogonal experiment for dual solvent extraction
根据单因素试验结果,以龙葵素得率为考察指标,选择较优因素,对双溶剂提取时间(A)、料液比(B)、双溶剂比(C)、原料粒径(D)影响因素设计L9(34)正交试验(表1)。极差分析可知,4个因素对马铃薯龙葵素提取得率的影响大小依次为C>D>B>A,即:乙醇乙酸比>粒径>料液比>时间。双溶剂提取马铃薯龙葵素的最佳工艺为提取温度70℃、提取时间17h、料液比1:20、乙醇乙酸比10:2(pH3.2)、原料粒径0.3mm。
在上述最佳工艺参数条件下,进行3次验证性实验,马铃薯龙葵素得率分别为0.6384%、0.6463%、0.6403%,平均得率为0.6417%。
2.2 超声波辅助提取马铃薯龙葵素的工艺参数优化
2.2.1 超声波辅助提取马铃薯龙葵素单因素试验结果与分析
由图2A可知,随着乙醇体积分数的增加,龙葵素得率增加,增至70%后,提取效果反而下降。这主要是因为乙醇体积分数增大,溶剂极性变小,生物碱的浸出量相对减少。图2B表明,超声温度升高,龙葵素得率增加,70℃时提取效果最好,但温度进一步升高,龙葵素结构被破坏,得率呈下降趋势。图2C显示,随着超声提取时间的延长,龙葵素得率先增大后减少;超声20min提取效果最好。超声时间过长,超声波的机械、空化效应可能破坏生物碱的结构。由图2D可知,当料液pH值为3时,提取得率最高。图2E表明,超声波辅助提取马铃薯龙葵时,原料粒径为0.45mm时提取得率最高。图2F显示,随着料液比的增大,提取效果越好,当料液比达到1:10后,料液比再增大,龙葵素的得率增加不明显。


图 2 超声波辅助提取各单因素条件对提取效果的影响Fig.2 Effect of single factors on extraction efficiency by ultrasonic-assisted extraction
2.2.2 超声波辅助提取马铃薯龙葵素的正交试验

表 2 超声波辅助提取马铃薯龙葵素的正交试验设计及结果Table 2 Results and analysis of orthogonal experiment of ultrasonic-assisted extraction
根据超声波辅助提取马铃薯龙葵素的单因素试验结果,以龙葵素得率为考察指标,选择较优因素,对超声温度(E)、超声时间(F)、料液比(G)、原料粒径(H)影响因素设计L9(34)正交试验(表2)。极差分析可知,4个因素对马铃薯龙葵素提取得率的影响大小依次为H>G>E>F,即:粒径>料液比>超声温度>超声时间,其最佳工艺参数为乙醇体积分数70%、pH3、超声温度65℃、提取时间20min、料液比1:15、原料粒径0.3mm。
在上述最佳提取工艺技术组合条件下进行3次验证实验,马铃薯龙葵素得率分别为0.6994%、0.7311%、0.7173%,平均得率为0.7159%。同时,每超声提取一次,分离提取液与残渣,残渣进行下一次提取,依次进行4次,检测每一次龙葵素的提取得率(图3)。图3显示,超声提取两次已达到基本提取完全的要求,龙葵素的累计得率达到0.8356%。
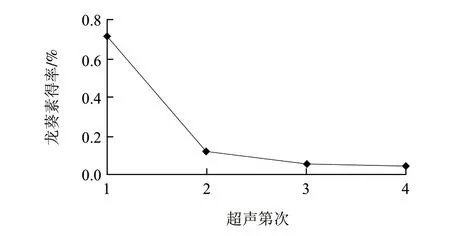
图 3 超声次数实验Fig.3 Effect of extraction times on extraction efficiency
2.3 不同提取方法提取马铃薯龙葵素的比较

表 3 不同提取方法提取马铃薯龙葵素的比较Table 3 Comparison of different extraction methods
由表3可知,在马铃薯龙葵素的乙醇回流提取、微波辅助提取、双溶剂提取、超声波辅助提取4种方法中,以超声波辅助提取的得率最高,达到0.8356%。超声波辅助提取与其他方法相比,具有提取时间短,提取条件较温和、溶剂用量少等优点,同时,不会产生有机溶剂由于沸点较低在短时间内会急剧蒸发膨胀溢出以及过热现象而导致的提取效果下降等缺点。
3 讨论与结论
马铃薯中龙葵素的含量极低,而马铃薯中的主要成分是淀粉,开发利用龙葵素需建立在淀粉开发利用的基础上,才能达到资源的充分利用。通过实验建立高效、便捷、环保提取马铃薯龙葵素的方法,再对龙葵素进行纯化,得到较高纯度的龙葵素产物,以利于高效液相色谱、高速逆流色谱等先进设备分离得到高纯度的龙葵素提取物或其单体,并对龙葵素单体进行药理药效及高价值产品开发研究,将是今后马铃薯龙葵素研究的重点。
本实验综合比较研究了乙醇回流提取、微波辅助提取、双溶剂提取、超声波辅助提取4种方法对马铃薯龙葵素的提取效果,得出了马铃薯龙葵素的最佳提取方法及其工艺为超声波辅助提取、70%乙醇、pH3、超声温度65℃、提取时间20min、料液比1:15、原料粒径0.3mm、超声两次,龙葵素得率达到0.8356%;此方法相比与其他3种方法具有提取时间短、提取条件较温和、溶剂用量少等优点;为马铃薯龙葵素的高效、绿色工业化生产及高价值产品开发研究提供了科学依据和保障。同时,本实验利用160W 超声波清洗仪进行超声波辅助提取实验,在实验过程中未能考虑超声波强度对马铃薯龙葵素提取效果的影响,这是实验局限之所在,对于相关科学问题,也尚有待于进一步研究。
[1] 周文龙, 李猛刚. 把小土豆做成大产业[J]. 中国国情国力, 2007(9): 4-7.
[2] LISINSKA G. Potato science and technology[M]. London: Elsevier Applied Science, 1989.
[3] 段光明, 冯彩萍. 马铃薯糖苷生物碱[J]. 植物生理学通讯, 1992, 28(6): 457-461.
[4] 段光明, 刘加, 李霞. 马铃薯糖苷生物碱的生物学作用及开发利用[J]. 资源开发与市场, 1995, 1l(2): 61-65.
[5] FRIDMAN M. Analysis of biologically active compounds in potatoes (Solamum tuberosum), tomatoes (Lycopersicon esculentum), and jimson weed (Datura stramonium) seeds[J]. Journal of Chromatography A, 2004, 1054(1/2): 143-155.
[6] PEKSA A, GOŁUBOWSKA G, RYTEL E, et al. Influence of harvest date on glycoalkaloids contents of three potato varieties[J]. Food Chemistry, 2002, 78(3): 313-317.
[7] OSMAN S, ZACHARIUS R, KALAN E, et al. Stress metabolites of the potato and other solanaceous plants[J]. Journal of Food Protection, 1979, 42(6): 502.
[8] KORPAN Y I, NAZARENKO E A, SKRYSHEVSKAYA I V, et al. Potato glycoalkaloids: true safety or false sense of security[J]. Trends in Biotechnology, 2004, 22(3): 147-151.
[9] 段光明, 宗会. 不同溶剂系统对马铃薯糖苷生物碱的提取效果[J]. 植物生理学通讯, 1993, 29(5): 365-368.
[10] 张薇, 熊兴耀, 李霞. 马铃薯中龙葵素的提取方法[J]. 湖南农业大学学报, 2006, 32(6): 665-667.
[11] 张薇, 文雄, 潘双银, 等. 微波辅助提取马铃薯龙葵素[J]. 园艺学报, 2008, 35(9): 1393-1396.
[12] COXON D T, PRICE K R, JONES P G. A simplified method for the determination of total glycoalkaloids in potato tuber[J]. Sci Food Agric, 2006, 30(11): 1043-1049.
[13] HADDADIN M S Y, HUMEID M A, QAROOT F A, et al. Effect of exposure to light on the solanine content of two varieties of potato (Solanum tuberosum) popular in Jordan[J]. Food Chemistry, 2001, 73(2): 205-208.
[14] 李俶, 阎娜, 沈佩仪, 等. 响应面优化荷叶生物碱盐提取工艺[J]. 食品科学, 2011, 32(18): 54-58.
[15] 潘明. 超声波强化提取荠菜中总生物碱的研究[J]. 化学与生物工程, 2006, 23(11): 33-35.
