超强磁性微球提取深加工转基因食品DNA
2013-12-23王爱迪冉晓华赵卫东
王爱迪,冉晓华,陈 磊,*,赵卫东
(1.天津大学药物科学与技术学院,天津 300072;2.天津出入境检验检疫局动植物和食品检测中心,天津 300461)
自1994年首例转基因植物——转基因耐储藏番茄在美国批准进入市场以来,转基因植物的研发、生产和试验规模均快速增长。转基因植物主要有大豆、马铃薯、番茄等,并被广泛加工成食品流入市场[1-3]。基于对转基因食品的安全及生物环境安全的考虑,各国政府相继建立法规,对转基因植物的研究、生产、运输、贮存、销售和进出口等所有环节进行监控[4-6]。目前食品中转基因成分的检测方法应用较广泛的是聚合酶链式反应(polymerase chain reaction,PCR)和实时定量PCR(quantitative real time-polymerase chain reaction,qRTPCR),即通过对样品基因组核酸中的外源基因的扩增和定量来进行转基因成分的定性和定量检测[7-9]。使用PCR法检测深加工食品中的转基因成分,面临的最大挑战是如何有效地提取到DNA模板,其难度不仅在于食品加工过程中DNA会遭到严重破坏,而且受物理、化学和生物等因素的影响使DNA质量降低[10]。
由于深加工产品的DNA提取技术是转基因成分定性和定量检测的瓶颈,因此,很多实验室都在研究深加工产品的DNA提取方法。现有的DNA提取技术大多依赖各种试剂盒,花费较高;一些研究通过其他手段提取DNA,但提取过程繁杂,较为耗时[11-12]。
尽管已有多种DNA提取方法可供选择,深加工食品如马铃薯淀粉和食用大豆油中DNA降解严重,含量低,样品基质黏稠,因此此类样品中的DNA提取仍然是一个具有挑战性的课题。本实验以磁响应性高、表面包覆二氧化硅的磁性四氧化三铁微球为固相吸附剂,从植物源食品中提取基因组DNA模板,然后选择适当序列的引物,对DNA模板中的内源和外源基因进行PCR扩增。内源基因的扩增用以验证纯化DNA的可扩增性;外源基因的扩增用于转基因成分的检测。通过与传统方法的DNA提取量、纯度、PCR扩增效果、qRT-PCR数据结果、提取时间、费用等几个方面比较,对磁性微球提取基因组核酸方法与qRT-PCR相结合的检测方法用于深加工食品中转基因检测进行综合评价。
1 材料与方法
1.1 材料、试剂与仪器
大豆(抗草甘膦基因)、马铃薯(抗Bt基因)阳性对照品 天津市出入境检疫局动植食检测中心;其他食品 市购。
十二烷基硫酸钠、聚乙二醇8000 北京鼎国生物技术有限公司;蛋白酶K 德国Merck公司;盐酸胍 天津市光复精细化工研究所;10×PCR Buffer、10×Ex Taq Buffer、dNTP Mix(2.5mmol/L)、rTaq(5U/μL)、Ex Taq HS (5U/μL)、各种引物等生物试剂均由TaKaRa公司合成(表1);Affimag FEO磁性四氧化三铁微球(200nm,饱和磁化率78emu/g) 天津市倍思乐色谱技术开发中心;Omega®磁珠核酸提取试剂盒、Omega®硅胶柱核酸提取试剂盒、Wizard®磁珠核酸提取试剂盒 美科美(北京)生物医学有限公司。
UV2450紫外分光光度计 日本岛津公司;PCR仪 德国Biometra公司;Light Cycler 480实时定量PCR仪 德国Roche公司;DYCP-31C水平电泳槽 美国Bio-Rad公司;BioDoc-IT220凝胶成像系统 美国UVP公司。

表 1 引物序列及其大小Table 1 Sequences and fragment sizes of primers
1.2 方法
1.2.1 核酸的提取
Affimag磁珠法:将大豆(种子研磨)、豆腐、腐乳、大豆油、马铃薯(鲜品)、薯条、薯泥和淀粉(马铃薯)等固体样品用液氮研磨。各称取0.5g于离心管中,加入预热的细胞裂解液(0.01mol/L Tris-HCl,0.15mol/L NaCl,0.002mol/L乙二胺四乙酸二钠,2g/100mL十二烷基硫酸钠(SDS),pH8.0)5mL,5mol/L的盐酸胍溶液0.5mL,10mg/mL的蛋白酶K溶液0.05mL。55℃温育30min,加入10μL 3mg/mL的RNase,反应5min,12000r/min离心5min得到样品液。取0.5mL 10mg/mL的磁性微球悬液放于1.5mL的离心管中,磁分离弃去清液,加入吸附液(聚乙二醇8000 20g/mL,2mol/L NaCl)1.0mL,振摇混匀,加入样品液0.5mL,室温充分混匀10min。磁场分离,弃去清液。再加入吸附液1.0mL,同法处理一遍。70%乙醇洗涤磁珠两遍,弃去洗涤液,室温下风干。加入TE(0.01mol/L EDTA,0.025mol/L Tris-HCl,pH8.0)缓冲液0.5mL,轻轻颠倒10min,使磁珠充分分散均匀。磁分离,清液即为DNA提取液,备用。豆油体积为200mL,淀粉质量为10g,提取步骤同前。
十六烷基三甲基溴化铵(CTAB)法,操作步骤见参考文献[15];Omega®硅胶试剂盒、Omega®磁珠试剂盒、Wizard®磁珠试剂盒的使用参照说明书进行。
每种方法针对每种样品做3个重复。
1.2.2 DNA样品的检测
1.2.2.1 DNA质量浓度和纯度的测定
用紫外分光光度计检测基因组DNA在260nm波长处的吸光度(A260),计算所提DNA的质量浓度,DNA的质量浓度/(μg/mL)=A260×50。检测基因组DNA在260nm和280nm 波长处的吸光度,根据A260/A280值判断DNA 纯度。
1.2.2.2 琼脂糖凝胶电泳检测
将提取的DNA进行凝胶电泳检测,制备1%的琼脂糖凝胶,上样配比为5μL 核酸样品溶液+1μL 6×Loading Buffer+1μL 100×SYBR Green。取上述混合配比溶液5μL。电泳条件为80V,40min。
1.2.2.3 PCR扩增反应

表 2 PCR以及qRT-PCR反应体系Table 2 Reaction system of PCR and qRT-PCR
普通PCR反应体系(表2)的反应条件为95℃、1min,95℃、10s,60℃、40s,72℃、40s,35个循环;72℃ 10min。选择25μL反应体系。制备3%的琼脂糖凝胶,上样配比同1.2.2.2节,电泳条件为80V,40min。
qRT-PCR的反应体系(表2)的反应条件为95℃、30s,95℃、15s,60℃、40s,45个循环;40℃、30s。选择25μL反应体系,每个模板DNA做2个平行,Ct值取平均值。
1.2.3 实际样品的转基因检测
选择几种常见的市售食品,用Affimag磁珠法提取样品DNA(每个样品做3个重复),并对其进行内源基因以及外源基因启动子CaMV35S和终止子NOS检测,提取步骤以及qRT-PCR反应体系参照1.2.2节和1.2.3节。每个DNA模板做2个平行。其中Ct值表示反应管的荧光信号到达设定的阈值时所经历的循环数,该值越小,表明反应管内DNA含量越高。Ct<36表示该目的基因为阳性;Ct>40表示目的基因为阴性;36<Ct<40,需要做重复实验判断阳性阴性结果[13]。
2 结果与分析
2.1 5种方法提取基因组DNA的检测

图 1 样品基因组DNA电泳结果Fig.1 Agarose gel electrophoresis of the DNA from samples
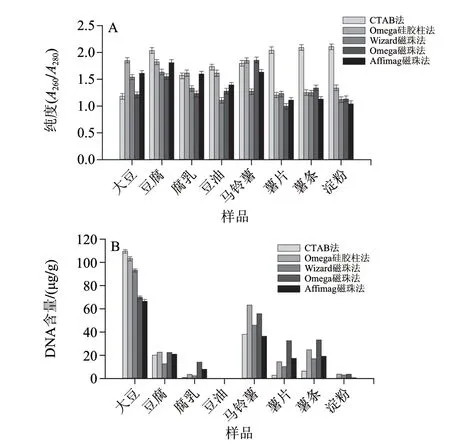
图 2 5种DNA提取方法提取的样品DNA的纯度(A260/A280)(A)和含量(B)Fig.2 Purity (A260/A280) (A) and quantity (B) of extracted DNA samples determined by five different methods
采用CTAB法、Omega®硅胶柱法、Wizard®磁珠法、Omega®磁珠法和Affimag磁珠法5种不同方法提取DNA样品,结果见图1。未经过加工的大豆和马铃薯鲜品,采用不同的提取方法都可以得到整齐明亮的DNA条带,为基因组DNA,分子质量大于10kbp;经过加工后的豆腐,薯条,薯泥,只能观察到一些弥散拖尾的小片段DNA,分子质量基本小于1kbp;而深加工的大豆油,腐乳和马铃薯淀粉样品中的DNA含量很低,用不同方法提取的样品在琼脂糖凝胶电泳上均未看到明显的DNA条带,将通过后续PCR以及qRT-PCR来检测DNA的提取效率。为了定量检测所提取的DNA的含量和纯度,利用紫外分光光度计测定DNA样品在260nm和280nm波长处的紫外吸光度,根据1.2.2.1节中的公式计算其质量浓度,结果如图2所示。由于豆油的DNA质量浓度很低,在图2B中不能显示,其结果是CTAB法为0.002μg/g,Omega® 硅胶柱法为0.017μg/g,Wizard®磁珠法为0.012μg/g,Omega® 磁珠法为0.024μg/g,Affimag 磁珠法为0.032μg/g。由图2可知,采用Affimag磁珠提取方法所提取的DNA含量大部分样品较高,A260/A280比值为1.10~1.80,表明此方法在DNA提取过程中细胞裂解液裂解程度较完全,去除杂质(糖类、蛋白质类)能力较强;同时在提取过程中避免了高速离心,只需要吸附、洗涤、洗脱步骤即可得到DNA样品,提取过程中对DNA机械力损伤较小。
2.2 5种方法提取DNA的PCR和qRT-PCR检测
以5种方法提取的各种食品的基因组DNA为模板,对大豆样品和马铃薯样品分别进行大豆内源基因Lectin和马铃薯内源基因UGP的PCR扩增,将扩增产物经3%琼脂糖凝胶电泳检测,结果见图3。

图 3 不同方法提取的样品内源基因PCR电泳检测Fig.3 Agarose gel electrophoresis patterns of PCR products
对于CTAB法来说,大豆类食品中只有大豆和豆腐扩增到目的条带,而腐乳和大豆油由于样品加工程度深,并且加入了一些添加剂,所提取的核酸样品未能得到目的条带,电泳中条带为引物二聚体扩增条带;马铃薯样品中,只有马铃薯淀粉由于加工程度较深未能扩增到目的条带。而几种试剂盒方法,腐乳只有Omega®硅胶柱法可以扩增到目的基因,大豆油和马铃薯淀粉未能扩增到目的条带,一方面可能是由于样品本身原因导致提取核酸样品质量少低于PCR或凝胶电泳的检测限,另一方面可能是所提取的核酸样品中核酸聚合酶抑制剂的存在导致不能有效扩增。本实验采用的Affimag磁珠方法,大豆和马铃薯所有样品都能扩增得到目的条带,尤其大豆油和马铃薯淀粉均可以扩增出特异的目的条带(图3),并且在含量、质量和纯度等方面满足了PCR和目的扩增基因的电泳检测灵敏度的要求,扩增的目的条带清晰。表明该方法更加适用于从深加工食品中提取核酸样品。
同时,为了验证PCR扩增结果的可靠性,同时进行了大豆和马铃薯内源基因的qRT-PCR扩增,由于qRT-PCR在反应中加入了荧光标记引物,除了可以进行定量研究之外,还提高了核酸扩增反应的准确性以及检测的灵敏度[16],因此,为了进一步验证核酸的可扩增性,以5种方法提取的各种食品的基因组DNA为模板,对内源基因进行qRT-PCR扩增,从所得的扩增曲线以及Ct值(表3)可得到从待检样品中检测到各样品对应内源基因的含量,Ct值结果与普通PCR扩增到的目的条带亮度(图3)基本一致。同时,qRT-PCR进一步验证了本方法在相同样品量的条件下所提取的大豆油和马铃薯淀粉的DNA含量最高(Ct值分别为34.10和28.64),表明本方法所提取的DNA可以用于qRT-PCR检测。

表 3 各种样品DNA qRT-PCR的Ct值Table 3 qRT-PCR Ct of the DNA samples
2.3 市售产品转基因成分的检测
为了检测几种市售食品是否含有转基因成分,采用本方法提取所购买的样品核酸,并且通过qRT-PCR扩增内源基因(大豆类食品扩增Lectin基因片段,马铃薯类扩增UGP基因片段)以及外源基因CaMV35S启动子和NOS终止子,通过实验结果的Ct值(表4)对各种转基因食品中的转基因含量进行测定,结果表明,各食品内源基因扩增的Ct值均小于36,表明所提取的DNA样品为各自对应的基因组DNA,大豆、马铃薯Ct值较小,表明所提取的DNA相对含量较高;其他几种食品由于受加工过程的影响,以及食品本身的特性,Ct值较大,DNA含量较低。根据CaMV35S启动子和NOS终止子的扩增Ct值(均大于36)表明,所购买食品均为非转基因食品。qRT-PCR用时短,仅需70min,不需后续电泳检测,减少了检测时间。将本方法与qRTPCR联合应用,可以缩短转基因食品的检测时间,减少检测结果假阴性的可能性,提高转基因检测的准确性。

表 4 样品各基因组qRT的Ct值Table 4 qRT Ct of the DNA samples
3 结 论
本实验以超高磁性的四氧化三铁磁珠为分离基质,提取深加工食品的基因组或片段DNA的量较高,纯度较高,能够满足PCR以及qRT-PCR实验的要求,均达到或超过试剂盒的提取效果,同时,仅有Affimag方法可以从淀粉、豆油等深加工食品中提取得到基因组DNA碎片,并且通过PCR电泳检测到目的基因,且qRT-PCR的Ct值均小于36,也证明了所提取DNA可以用于目的基因的检测,表明该方法可以从深加工食品中提取到核酸片段,该方法的提取效率和灵敏度较高。此过程无需使用有机溶剂,安全性较高,操作较简单,耗时短,不到1.5h即可完成DNA提取步骤,满足高通量自动核酸提取技术发展的要求,可以应用于出入境大批量常规样品检验的DNA快速提取,加快检验速度。
[1] HOLST J A. Testing for genetically modified organisms (GMOs) past, present and future perspectives[J]. Biotechnol Adv, 2009, 27(6): 1071-1082.
[2] JAMES C. Global status of commercialized biotech/GM crops: 2010[J]. International Service for the Acquisition of Agri-biotech Applications, 2011, 42: 1-6.
[3] SARAH R, MURRAY R C, BUTLER A K, et al. Use of quantitative real-time PCR to estimate maize endogenous DNA degradation after cooking and extrusion or in food products[J]. J Agric Food Chem, 2007, 55(6): 2231-2239.
[4] FISHER F. European Commission Regulation (EC) No. 1829/2003 and 1830/2003[J]. Off J Eur Communities, 2003, 18(268): 1-28.
[5] Notification 2000-31. Ministry of Agriculture and Forestry of Korea[Z]. Seoul, Korea, 2000.
[6] Order 10. Ministry of Agriculture of the People’s Republic of China[Z]. Beijing, China, 2002.
[7] FARID E. Detection of genetically modified organisms in foods[J]. Trends in Biotechnology, 2002, 20(5): 215-223.
[8] 张建伟, 王广印, 陈碧华, 等. 转基因食品检测技术的应用与发展Ⅲ. 检测技术的影响因素和发展方向分析[J]. 食品科学, 2008, 29(12): 739-743.
[9] 杨铭铎, 张春梅, 华庆, 等. 转基因食品快速检测技术的研究进展[J]. 食品科学, 2004, 25(11): 424-427.
[10] GRYSON N. Effect of food processing on plant DNA degradation and PCR-based GMO Analysis: a review[J]. Anal Bioanal Chem, 2010, 396(6): 2003-2022.
[11] PINTO A D, FORTE V T, GUASTADISEGNI M C, et al. A comparison of DNA extraction methods for food analysis[J]. Food Control, 2007(18): 76-80.
[12] 蔡翠霞, 肖维威, 康文杰, 等. 转基因食品DNA提取研究进展[J]. 中国生物工程, 2011, 31(5): 121-125.
[13] SN/T 1204—2003 植物及其加工产品中转基因成分实时荧光定量PCR定性检测方法[S].
[14] Community Reference Laboratory for GM Food and Feed. EH92-527-1 event-specific method for quantification of amylopectin potato event EH92-527-1 using real-time PCR[S].
[15] LIPP M, BRODMANN P, PIETSCH K, et al. IUPAC collaborative trial study of a method to genetically modified soy beans and maize in dried powder[J]. Journal of AOAC International, 1999, 82(4): 923-928.
[16] KIRSCH S, FOURDRILIS S, DOBSON R, et al. Quantitative methods for food allergens: a review[J]. Anal Bioanal Chem, 2009, 395(1): 57-67.
