茶多酚并紫杉醇对食管癌Eca-109细胞增殖与凋亡影响
2013-12-23,,,
,,,
(青岛大学医学院附属医院,山东 青岛266003 1 肿瘤科; 2 中心实验室)
食管癌是世界常见的恶性肿瘤之一,全球每年约有30万人死于食管癌,位居肿瘤死因第6位。目前,对食管癌的治疗,早期以根治性手术为主,对食管癌尤其晚期病人化疗仍占有非常重要的地位,但总有效率并不乐观。因此,寻找对食管癌更有效的药物和治疗方法具有重要意义。目前认为紫杉醇(Paclitaxe)是治疗食管癌最有效的药物之一,单药缓解率(RR)为32%[1],是临床上一线治疗食管癌的药物,但因毒副作用严重,其应用及疗效受到了限制。大量实验证实,绿茶提取物茶多酚(TP)可通过抑制细胞增殖、诱导细胞凋亡发挥抗肿瘤作用[2-3],但TP对食管癌体外作用的报道少见。本研究以不同浓度的TP、Paclitaxel对食管癌Eca-109细胞分别进行单独及联合用药,检测TP、Paclitaxel对肿瘤细胞生长、细胞凋亡及凋亡相关调节基因Caspase-3表达的影响。
1 材料与方法
1.1 试剂及来源
Paclitaxel(相对分子质量853.92),哈药集团生物工程有限公司生产; TP(含量98%),西安奥泽生物科技有限公司生产,用高纯水配成浓度5 g/L溶液,直径0.22 μm的滤器过滤,置于-20 ℃冰箱,避光保存备用;RPMI-1640培养液与胎牛血清,均为Hycloneg公司产品;溴化噻唑蓝四唑(MTT),Sigma公司产品;AnnxineV/PI凋亡检测试剂盒,购自碧云天生物技术研究所;Caspase-3引物[4](上游引物:5′-TGGAACAAATGGACCTGTTGACC-3′,下游引物:5′-AGGACTCAAATTCTGTTGCCACC-3′),由上海生工生物工程技术服务有限公司合成,预扩增片段为365 bp;逆转录PCR试剂盒购自宝生物工程有限公司。内参照基因为GAPDH,上游引物: 5′-CTGCACCACCAACTGCTTAG-3′, 下游引物:5′-TGAAGTCAGAGGAGACCACC-3′,预扩增片段为135 bp。
1.2 细胞培养
食管癌Eca-109细胞购于中国科学院上海细胞库,用含体积分数0.10胎牛血清的RPMI-1640培养液(内含100 kU/L青霉素和100 kU/L链霉素)培养,置于37 ℃、体积分数0.05 CO2、饱和湿度的培养箱中,当细胞融合至80%~90%时,进行细胞传代。
1.3 细胞增殖抑制的检测
采用MTT法。收集处于对数生长期的Eca-109细胞,以1×107/L的密度接种于96孔板中,每孔100 μL,置培养箱中培养,等待细胞完全贴壁。将处于对数期的细胞随机分为TP组、Paclitaxel组、两药联合组,分别加入100 μL含不同浓度TP(125、250、500、1 000 mg/L)、Paclitaxel(0.2、1.0、5.0、25.0 mg/L)及TP+Paclitaxe(500 mg/L TP+1 mg/L Paclitaxel)的培养液,并设立阴性对照组、空白对照组,每组5个副孔。置于培养箱中避光培养12、24、48 h后,每孔加150 μL MTT,避光培养4 h,将孔内液体吸出,再向每孔内加20 μL的二甲基亚砜,震荡10 min,在酶标仪上测定490 nm处的吸光度(A)值,计算细胞增殖抑制率(IR)。IR=(1-实验组A值/对照组A值)×100%。
1.4 细胞形态观察
收集对数生长期细胞,接种于6孔板,每孔2 mL、细胞数40×104,置于培养箱内培养,等待细胞贴壁。将处于对数生长期的细胞随机分为TP组(500 mg/L)、Paclitaxel组(1 mg/L)、 两药联合组(TP 500 mg/L+1 mg/L Paclitaxel)组,对照组不加药物,24 h后,显微镜下观察各组细胞的形态学变化。
1.5 细胞凋亡周期与细胞凋亡率检测
1.5.1细胞凋亡周期的检测 采用PI单染法。细胞处理及实验分组同1.4,每组设3个副孔。收集细胞至离心管,1 000 r/min离心5 min沉淀细胞,去上清。加入1 mL预冷体积分数0.70的乙醇,混匀,4 ℃固定24 h。离心,去上清,PBS洗涤。每管内加入PI 25 μL、RNaseA 10 μL,缓慢并充分重悬,400目筛网过滤,37 ℃避光温浴30 min,流式细胞仪(美国B.D公司)检测细胞周期的分布。
1.5.2细胞凋亡率的检测 采用AnnxineV/PI双染法。细胞处理及实验分组同1.4,每组设3个副孔。收集细胞,1 000 r/min离心5 min沉淀细胞,去上清,冷PBS洗涤。再离心,去上清,重悬细胞于100 μL 1×buffer中。加入AnnexinV 5 μL +PI1 μL,室温下培育15 min。加入400 μL 1×buffer,充分重悬细胞,400目筛网过滤,用流式细胞仪(美国B.D公司)检测细胞凋亡率。
1.6 Caspase-3 mRNA检测
采用半定量逆转录多聚酶链反应(RT-PCR)方法。细胞处理及实验分组同1.4,药物作用24 h后,收集细胞,加入TRIzol、氯仿、异丙醇、冰预冷体积分数0.75的乙醇提取细胞总RNA。取总RNA5 μL,在PCR仪上行逆转录反应。反应条件:65 ℃ 5 min、4 ℃ 5 min变性,退火反应,45 ℃ 20 min,95 ℃ 5 min。取逆转录产物1 μL,引物0.4 μL,总反应液10 μL,在PCR仪上行逆转录反应:95 ℃5 min变性,60 ℃ 30 s退火,72 ℃延伸1 min,30个循环。PCR产物用10 g/L琼脂糖凝胶电泳,以内参基因GAPDH作对照,应用图像分析系统半定量分析Caspase-3 mRNA的表达。
1.7 统计学分析
2 结 果
2.1 TP和Paclitaxel对Eca-109细胞IR的影响
随着TP、Paclitaxel浓度升高和作用时间延长,细胞IR增加,差异有显著性(F=134.46~423.75,P<0.05)。两药联合组作用12、24、48 h,对细胞的IR分别明显高于TP组、Paclitaxel组(q=8.63~26.96,P<0.05)。采用相互作用指数[5](CDI)评价两药的相互作用(CDI=AB/(A×B),其中A、B是两药单独作用吸光度值与对照组吸光度值的比值,AB为两药联合组吸光度值与对照组吸光度值比值。CDI>1时,两药相互作用为拮抗作用;CDI=1,两药作用性质为相加;CDI<1时,两药相互作用为协同)。结果显示,作用12、24、48 h,CDI值分别为0.91、0.89、0.85,两药有协同作用(图3)。
2.2 TP和Paclitaxel对Eca-109细胞形态的影响
光镜下,TP组、Paclitaxel组、两药联合组细胞稀疏,形态变圆,细胞皱缩,染色质致密,细胞核固缩,胞质内有凋亡小体产生,两药联合组表现更为明显(图4)。对照组细胞密集,贴壁生长,分裂旺盛,形态规则,呈铺路石样改变,细胞核位于细胞中部(图5)。
2.3 TP和Paclitaxel对Eca-109细胞周期及凋亡率的影响
2.3.1细胞周期 TP、Paclitaxel及两药联合诱导Eca-109细胞24 h后,细胞周期均发生明显改变,G1期细胞数与对照组比较明显增高(F=54.52,q=5.39~17.53,P<0.05),而S期与G2期细胞比例减少。见表1。
2.3.2细胞凋亡率 TP组、Paclitaxel组、两药联合组诱导24 h的Eca-109细胞凋亡率分别为(17.54±0.95)%、(10.27±0.93)%、(25.24±0.91)%,差异有统计学意义(F=446.82,q=16.27、31.64,P<0.05)。
2.4 TP和Paclitaxel 对食管癌Eca-109细胞Caspase-3 mRNA表达的影响
与TP组、Paclitaxel组比较,两药联合组诱导24 h后,Eca-109细胞Caspase-3 mRNA的表达量分别增高17.22%、11.63%,差异有显著意义(F=108.33,q=30.37、20.52,P<0.05)。见图6。
3 讨 论
食管癌是全世界高发恶性肿瘤之一,临床确诊时大多数病例已属中晚期,化疗在食管癌的治疗中占重要地位。Paclitaxel为食管癌的临床一线用药,是治疗食管癌最有效的药物之一,但其毒副作用比较严重。在体外,TP可通过选择性阻断信号传导通路、抑制尿酸氧化酶活性等多种途径抑制肿瘤的发生、发展[6]。但TP对食管癌的体外作用以及TP联合Paclitaxel对食管癌的作用国内罕见报道。
细胞增殖失控是恶性肿瘤重要的生物学特征。本文研究显示,TP、Paclitaxel均能显著抑制食管癌Eca-109细胞的增殖,并与时间、浓度呈正相关,这与有关文献报道结果相似[7-8]。而当两药联用时,对食管癌Eca-109细胞的IR明显提高。光镜及流式细胞仪均能观察到细胞凋亡的发生,其中两药联合组更加明显。提示TP能抑制Eca-109细胞生长、诱导细胞凋亡,与Paclitaxel联用能增强其抑制细胞生长、诱导细胞凋亡的作用。
凋亡是细胞的程序化死亡过程,如细胞凋亡受阻可导致肿瘤无限增殖。本文结果显示,Eca-109细胞经TP、Paclitaxel及两药联合作用后,均出现细胞周期阻滞,G1期细胞比例增高,也出现细胞凋亡,表明细胞周期阻滞、诱导细胞凋亡可能也是TP、Paclitaxel抗肿瘤作用的重要机制之一。

表1 两药对Eca-109细胞周期的影响(n=3,χ/%)
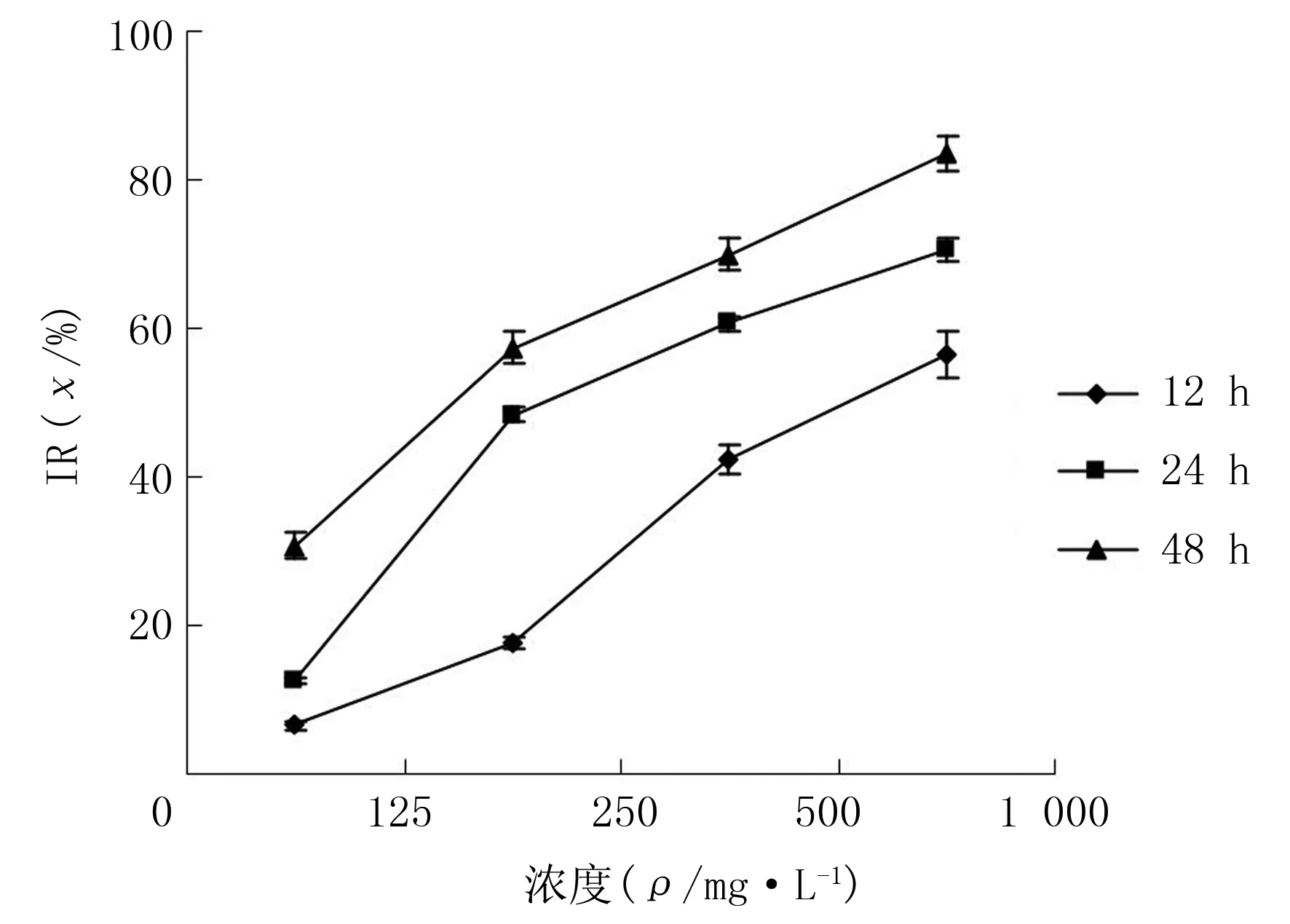
图1 TP对Eca-109细胞IR的影响
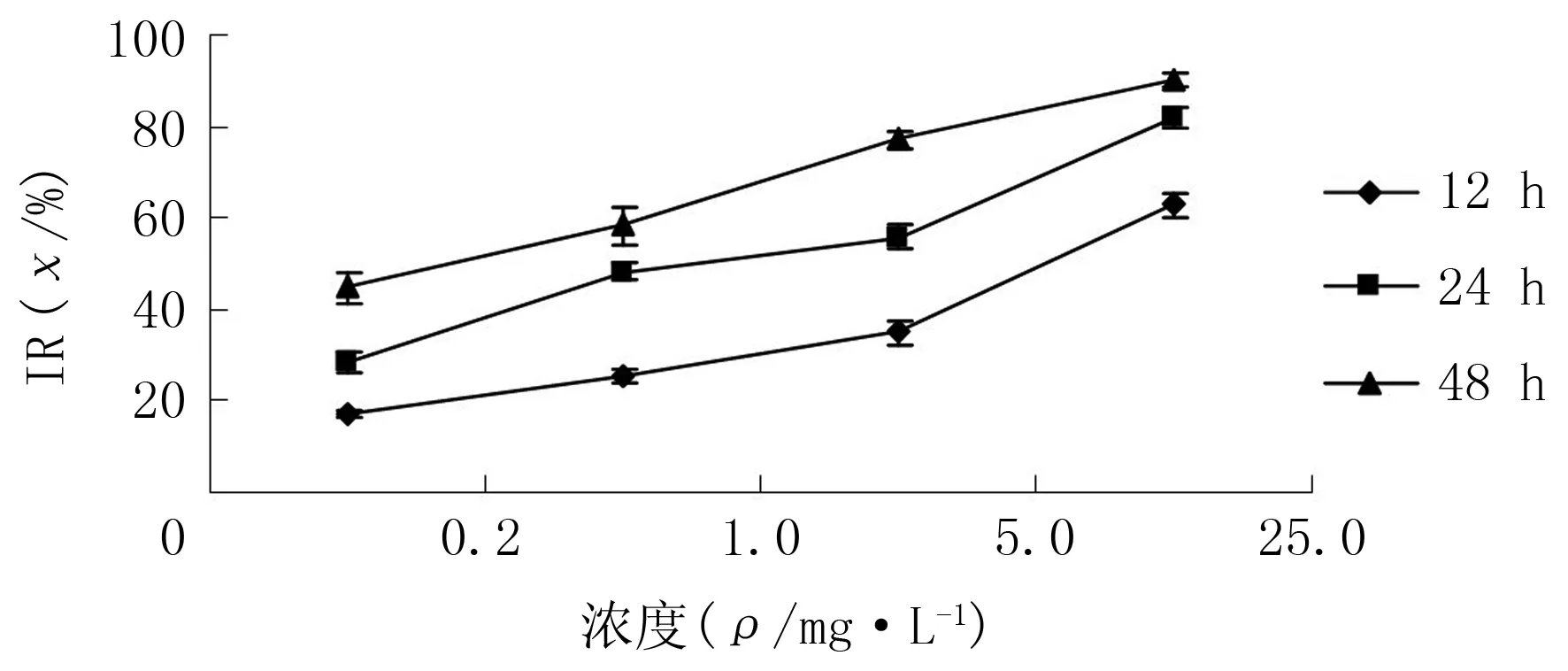
图2 Paclitaxel对Eca-109细胞IR的影响
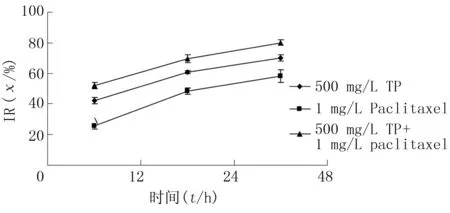
图3 TP、Paclitaxel联合对Eca-109细胞IR的影响

图4 两药联合组Eca-109细胞形态 (×100)

图5 对照组细胞形态 (×100)

M为Marker;①、⑤对照组;②、⑥TP组;③、⑦Paclitaxel组;④、⑧两药联合组。
细胞凋亡是非常复杂的蛋白酶级联反应过程。目前认为药物诱导肿瘤细胞的凋亡受一个或多个基因的调控[9]。众所周知,Caspase-3为与细胞凋亡密切相关的蛋白酶家族[10]。诱导细胞凋亡的典型途径包括:对Caspase-3的依赖性(细胞外途径)和对线粒体靶向性(细胞内途径),而Caspase-3是两种细胞凋亡途径中的关键酶和执行者,是级联反应的必经之路[11-12]。Caspase-3由12 000和17 000大小两个亚基构成,是编码35 000大小半胱氨酸蛋白酶的基因。TP在诱导肿瘤细胞凋亡的过程中,具有对Caspase-3的依赖性和线粒体靶向性[13]。本文结果显示,随着细胞凋亡率增加,Caspase-3 mRNA表达增加,提示Caspase-3 mRNA的表达与细胞凋亡过程有关,但其信号传导具体途径仍不清楚,可能与Caspase-3的活化相关。由于活化的Caspase-3能特异性地切断DNA,使参与DNA损伤修复过程中的DNA依赖蛋白激酶(DNA-PK)和聚ADP核糖聚合酶(PARP)失活,导致核酸激活和染色质聚集,促使细胞凋亡[14]。ODONKOR等[15]的研究结果表明,Caspase-3依赖性途径是Paclitaxel细胞毒性作用的重要途径,Caspase活化和效能对Paclitaxel治疗肿瘤的敏感性具有良好的指示作用。本研究RT-PCR结果显示,TP组、Paclitaxel组和两药联合组Caspase-3表达均增高,两药联合组作用更明显,这与流式细胞术检测结果一致,提示TP、Paclitaxel诱导细胞凋亡与上调Caspase-3表达有关。
综上所述,TP和Paclitaxel不仅能抑制食管癌Eca-109细胞的分裂,阻滞细胞周期于G1期,使其增殖指数下降,从而抑制细胞的增殖,而且在一定的范围内呈时间、浓度依赖性;同时,二者也可通过上调Caspase-3表达,诱导细胞凋亡,提示Caspase-3 mRNA表达与细胞的凋亡密切相关。但TP、Paclitaxel通过Caspase-3信号传导通路途径诱导细胞凋亡的具体机制并不清楚,尚需更深入的研究。
[1] AJANI J A, DAUGHERTY K. Activity of taxol in patients with squamous cell carcinoma and adenocarcinoma of theesophagus[J]. Journal of the National Cancer Institute, 1994,86(14):1086-1091.
[2] 罗非君,胡智,赵晓荣,等. 茶多酚诱导鼻咽癌细胞cyclin D1表达下调[J]. 癌症, 2001,20(4):358-362.
[3] 毛小强,那万里,赵丹,等. 茶多酚对前列腺癌PC-3M细胞增殖与凋亡的影响[J]. 中国实验诊断学, 2010,14(2):170-173.
[4] LI R, PEI H, PAPAS T. The p42
variant of ETS1 protein rescues defective Fas-induced apoptosis in colon carcinoma cells[J]. Immunology, 1999,96(7):3876-3881.
[5] CAO S S, ZHEN Y S. Potentiation of antimetabolite antitumor activity in vivo by dipyridamole and amphotericin B[J]. Cancer Chemotherapy and Pharmacology, 1989,24(3):181-186.
[6] 刘刚,陆劲松. 茶多酚对肿瘤防治作用的研究进展[J]. 中国癌症杂志, 2002,12(3):74-77.
[7] JUDSON P L, WATSON J M, GEHRIG P A, et al. Cisplatin inhibits paclitaxel-induced apoptosis in cisplatin-resistant ova-rian cancer cell lines: possible explanation for failure of combination therapy[J]. Cancer Research, 1999,59(10):2425-2432.
[8] 孟显峰,宋扬,杨伟品. IP6诱导肝癌细胞HepG2凋亡及其对Bcl-2和Bax蛋白表达影响[J]. 青岛大学医学院学报, 2011,47(4):311-313.
[9] 金鑫,姚良萍,卢云. 康莱特对HepG2细胞凋亡及其Caspase-3和Survivin表达影响[J]. 齐鲁医学杂志, 2012,27(1):1-3.
[10] POP C, SALVESEN G S. Human caspases: activation, specificity, and regulation[J]. Journal of Biological Chemistry, 2009,284(33):21777-21781.
[11] HASTAK K, AGARWALM K, MUKHTAR H, et al. Ablation of either p21 or Bax prevents P53-dependent apoptosis induced by green tea polyphenol epigallocatechin3-gallate[J]. Faseb Journal, 2005,19(7):789-791.
[12] ZOU H, HENZEL W J, LIU X, et al. Apaf-1, a human protein homologous to C. elegans CED-4, participates in cytochrome C-dependent activation of caspase-3[J]. Cell, 1997,90(3):405-413.
[13] ODONKOR C A, ACHILEFU S. Differential activity of caspase-3 regulates susceptibility of lung and breast tumor cell lines to Paclitaxel[J]. The Open Biochemistry Journal, 2008,2(2):121-128.
