TRAIL联合放射线对肺癌细胞增殖及凋亡影响
2013-12-23,,,,,,
,,,,,,
(青岛大学医学院附属医院,山东 青岛 266003 1 肿瘤科; 2 肿瘤放疗中心; 3 中心实验室)
肺癌是最常见的肺原发性恶性肿瘤,是目前世界上发病率及病死率均居首位的肿瘤,并且呈逐年上升的趋势。肺癌分为小细胞肺癌及非小细胞肺癌,其中非小细胞肺癌占75%左右。非小细胞肺癌的主要治疗方式包括手术切除、放疗、化疗、分子靶向治疗和生物免疫疗法。在我国,非小细胞肺癌病人诊断时大多数已处于中晚期,丧失了手术治疗的时机,而放疗、化疗虽能提高局部控制率,但同时正常细胞和组织也受到损伤,有时甚至抵消了局部控制率提高带来的益处。因此,目前亟需能够改善局部及远期控制率的肿瘤特异性治疗方法。肿瘤坏死因子相关凋亡诱导配体(TRAIL)是近年发现的肿瘤坏死因子超家族新成员[1-2]。TRAIL通过与死亡受体DR4、DR5结合,启动一系列凋亡信号传导,促进肿瘤细胞凋亡。研究表明,TRAIL能够诱导多种肿瘤细胞及转化细胞凋亡,而对正常细胞没有损伤,成为目前肿瘤生物治疗研究的新热点[1]。但有资料显示,部分肿瘤细胞对TRAIL表现出抵抗性或耐受性,且反复使用TRAIL也可产生获得性耐药,而与放疗、化疗、免疫治疗结合的联合治疗方法,能够发挥协同抗肿瘤作用[3-12]。本研究通过Lewis 肺癌细胞体外培养,观察TRAIL单独应用及联合X射线照射对体外肿瘤细胞增殖及凋亡的影响。
1 材料与方法
1.1 实验材料
Lewis肺癌细胞购于中国科学院上海生命科学研究院,TRAIL蛋白由上海恰尔生物技术有限公司惠赠,MTT购于美国Sigma公司,AnnexinV-Alexa Fluor 488/PI试剂盒购于Invitrogen公司,流式细胞仪为美国BD公司产品。
1.2 细胞培养
Lewis肺癌来源于C57BL小鼠,其细胞株为半贴壁生长的细胞,采用含体积分数0.10胎牛血清、青链霉素各100 mg/g的DMEM高糖培养液,置于37 ℃、体积分数0.05 CO2培养箱中常规培养。
1.3 体外细胞增殖抑制实验
取对数生长期的Lewis肺癌细胞,调整细胞悬液密度为5×107/L,每孔100 μL细胞悬液接种于96孔板,培养至对数生长期后,分别加入浓度为0、10、50、100、200、400、800 μg/L的TRAIL(为培养孔中的终浓度),每个浓度设5个复孔,同时设调零孔(加同体积的培养液),分别作用12、24、48 h后加入MTT溶液(终浓度为5 kg/L),震荡10 min,待结晶完全溶解后,用酶联免疫分析仪于490 nm处测量吸光度(A)值。按如下公式计算细胞增殖抑制率(IR):IR=((对照组平均A值-空白组平均A值)-(实验组平均A值-空白组平均A值))/(对照组平均A值-空白组平均A值)×100%。
1.4 流式细胞仪检测细胞凋亡
取对数生长期的Lewis肺癌细胞,以5×108/L的密度接种于12.5 mm2培养瓶中,并随机分为空白组(A组)、TRAIL组(B组)、单纯照射组(C组)和照射+TRAIL组(D组)。培养至对数生长期后,B组及D组加入浓度为100 μg/L的TRAIL[13],A组及C组加入等量培养液,作用12 h后,C组及D组给予2 Gy的6 MV的X线照射[7],A组及B组只摆位未照射。按照凋亡试剂盒的步骤收集作用24 h后Lewis细胞,用Annexin V-FITC和PI染色,常温避光孵育15 min,1 h内上流式细胞仪检测凋亡率;按照细胞周期试剂盒步骤检测细胞周期。
1.5 统计学处理

2 结 果
2.1 不同浓度TRAIL对Lewis细胞增殖作用的影响
不同浓度TRAIL作用于Lewis肺癌细胞,其抑制率比较,差异均具有统计学意义(F=9.017~12.465,P<0.05)。见表1。
2.2 各组细胞凋亡比较
D组的凋亡率与A、B、C组相比,差异均有统计学意义(F=203.175,P<0.05)。见图1、表2。
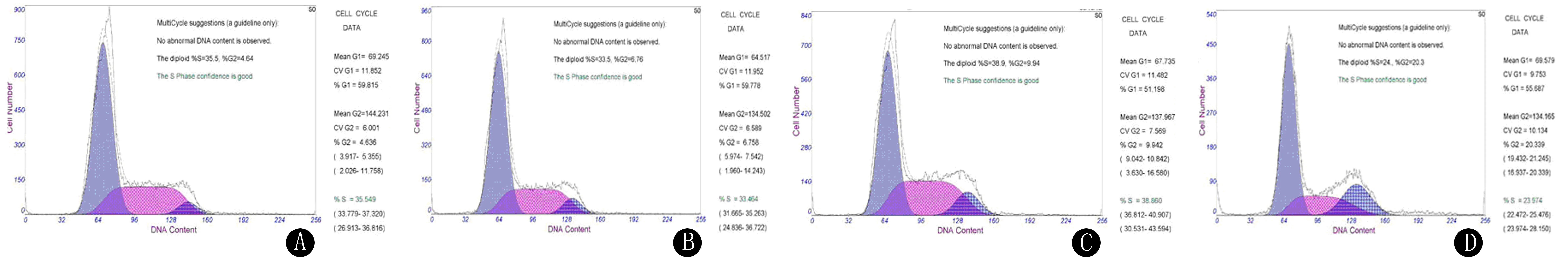
2.3 各组细胞周期比较
D组G2/M期所占比例与A、B、C组相比,差异具有统计学意义(F=149.276,P<0.05)。见图2、表2。

表1 不同浓度TRAIL对Lewis细胞抑制率的影响

表2 各组凋亡率及G2/M期所占比例
3 讨 论
TRAIL即凋亡素2配体(Apo2L),于1995年由WILEY首先报道,是肿瘤坏死因子超家族成员之一,属于Ⅱ型跨膜蛋白,其mRNA广泛表达于正常人的脾、肺、肾、胸腺、前列腺、心脏、胎盘等多种组织中,而在脑、肝和睾丸中无表达[1-2]。TRAIL的受体有DR4、DR5、DcR1、DcR2及OPG,其中死亡受体DR4、DR5是介导Apo2L/TRAIL诱导凋亡的受体。TRAIL通过两条途径诱导细胞凋亡:线粒体依赖途径(外源性通路)和非线粒体依赖途径(内源性通路),其中非线粒体依赖途径是TRAIL诱导凋亡的主要方式。两条凋亡途径都是通过激活一系列半胱-天冬氨酸蛋白酶(caspase)从而引发细胞最终凋亡。但是由于肿瘤细胞的个体差异性,不同肿瘤对TRAIL的敏感性不同,许多肿瘤细胞对其表现出抵抗性或经过长期治疗后出现耐药。因此,通过其他治疗方式增强肿瘤细胞对TRAIL的敏感性成为Apo2L /TRAIL治疗肿瘤的关键所在。
放射线直接或间接引起DNA损伤,通过DNA损伤介导的细胞凋亡信号转导通路及MAPK、AKt/PKB信号转导通路,可以激活一系列基因、因子或蛋白[14],最终导致细胞凋亡。而TRAIL作用于肿瘤细胞后能够引起DR4、DR5的高表达,促进细胞凋亡。国外有文献报道,TRAIL与放射线联合在体外能够引起多种肿瘤细胞凋亡率增加,DR4或DR5表达增加;而在体内则能够减缓或抑制肿瘤生长[15-18]。

A~D分别为A、B、C、D组流式细胞仪检测所得出的散点图,横轴为Annexin V染色,纵轴为PI染色。
A~D分别为A、B、C、D组流式细胞仪检测结果。
本实验结果表明,TRAIL对Lewis肺癌细胞具有增殖抑制作用,且呈剂量限制性,其抑制作用的实质是促凋亡作用。X射线也可以促进肿瘤细胞凋亡。X射线与TRAIL联合作用于Lewis肺癌细胞,可使其凋亡率明显升高,G2/M期比例显著升高,与对照组、单用TRAIL组及单用X射线照射组相比,差异均有统计学意义。
本文在细胞水平验证了TRAIL可对肺癌细胞产生促凋亡作用,而与高能X射线联合应用能够增强TRAIL凋亡诱导作用。TRAIL作用于Lewis细胞24 h的半数抑制剂量IC50达到19 mg/L,与对TRAIL敏感肿瘤细胞(24 h IC50≤100 μg/L)相比,Lewis细胞对此药的敏感性较低。其原因可能由于Lewis细胞为鼠源性的肺癌细胞,因种属的差异,细胞表面TRAIL受体的表达存在差异,诱导凋亡的作用不如对人源性肿瘤细胞敏感性高[19],具体原因尚需要进一步研究。
既往资料显示,放射线可克服TRAIL非敏感的肿瘤细胞对TRAIL的抵抗性[20]。其可能的机制包括:死亡受体DR4、DR5表达增加;含半胱氨酸的天冬氨酸蛋白水解酶家族成员caspase8、caspase9、caspase3等的表达[16-21]。除此之外,两者的联合治疗还涉及细胞因子及细胞凋亡相关基因。有研究结果表明,死亡受体的上调与细胞核因子NF-κB的激活、cFLIP及IAPs的过度表达、Bax和Bak基因突变等有关[22]。有文献报道,TRAIL引起的凋亡不依赖于p53的表达,且与Bcl-2的水平呈负相关[23]。但也有资料证明,死亡受体DR5 mRNA的上调与p53有关[24]。本实验进一步证实,TRAIL联合放射线可以提高肿瘤对TRAIL的敏感性并增强其促凋亡作用,具体机制尚在研究中。TRAIL与放射线的联合治疗增加了对肿瘤的杀伤作用,有望成为肿瘤治疗史上令人期待的新方案。
[1] WILEY S R, SCHOLEY K, SMOLAK P, et al. Identification and characterization of a new member of the TNF family that induces apoptosis[J]. Immunity, 1995,3:673.
[2] PITTI R M, MARSTERS S A, RUPPERT S, et al. Induction of apoptosis by Apo-2 ligand, a new member of the tumor necrosis factor cytokine family[J]. J Biol Chem, 1996,271:12687-12690.
[3] EGGERT A, GROTZER M A, ZUZAK T J, et al. Resis-tance to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis in neuroblastoma cells correlates with a loss of caspase-8 expression[J]. Cancer Res, 2001,61:1314-1319.
[4] GUILLAUME J, SARAH S, OLIVIER M. Combining naturally occurring polyphenols with TNF-related apoptosis-inducing ligand: a promising approach to kill resistant cancer cells[J]? Cellular and Molecular Life Sciences, 2010,67:3115-3130.
[5] ZHANG L D, FANG B L. Mechanisms of resistance to TRAIL-induced apoptosis in cancer[J]. Cancer Gene Therapy, 2005,12:228-237.
[6] MARCEL V J, CONCHITA V, BAUKELIEN V T. Novel therapeutics in combination with radiotherapy to improve can-cer treatment: rationale, mechanisms of action and clinical perspective[J]. Drug Resistance Updates, 2010,13:29-43.
[7] LI J D, LIU X G, SONG H, et al. The study of apoptosis-2 ligand as radiosensitizer in lung adenocarcinima A549 cell lines[J]. Progress in Modern Biomedicine, 2012,12(25):4820-4825.
[8] 孙非凡,孙铭娟,王梁华,等. TRAIL联合吉西他滨对肺癌NCI-H460细胞增殖和凋亡的影响[J]. 中国肿瘤生物治疗杂志, 2011,18(3):296-300.
[9] 江亚南,李沛,李芳芳,等. TRAIL联合低剂量顺铂对食管癌EC9706细胞增殖的影响[J]. 肿瘤基础与临床, 2010,23:7-9.
[10] 徐玉生,秦红霞,苗金红,等. TRAIL联合顺铂对横纹肌肉瘤细胞Fas表达和caspase3活性的影响[J]. 中华肿瘤防治杂志, 2007,14(6):418-421.
[11] YOSHIKI N, KAZUNORI K, MAKI T, et al. Interleukin-2 gene transfer potentiates the α-galactosylceramide-stimulated antitumor effect by the induction of TRAIL in NKT and NK cells in mouse models of subcutaneous and metastatic carcinoma[J]. Cancer Biology & Therapy, 2009,8(18):1763-1770.
[12] LIAN H, JIN N Y, LI X, et al. Induction of an effective anti-tumor immune response and tumor regression by combined administration of IL-18 and apoptin[J]. Cancer Immunol Immunother, 2007,56:181-192.
[13] PATRIZIA M, VERANA J, ELISE D, et al. Molecular requirements for the combined effects of TRAIL and ionising radiation[J]. Radiotherapy and Oncology, 2003,68:189-198.
[14] 陈海英,韩志武,郭沈波,等. 辐射诱导的凋亡及其信号转导通路研究进展[J]. 齐鲁医学杂志, 2006,21(4):365-368.
[15] PATRIZIA M, ANGELIKA S, VERENA J, et al. Irradiation specifically sensitises solid tumour cell lines to TRAIL mediated apoptosis[J]. BMC Cancer, 2005,5(5):1471-1482.
[16] ZHANG X C, CHEUNG R M, KOMAKI R, et al. Radiotherapy sensitization by tumor-specific TRAIL-gene targeting improves survival of mice bearing human non-small cell lung cancer[J]. Clin Cancer Res, 2005,11(18): 6657-6668.
[17] MOMOKO T, HIRONOBU Y, AKI O, et al. X irradiation combined with TNF α-related apoptosis-inducing ligand(TRAIL) reduces hypoxic regions of human gastric adenocarcinoma xenografts in SCID mice[J]. J Radiat, 2008,49:153-161.
[18] SRDJAN V, ANDREW D C, MICHELLE A L, et al. Targeting tumour-initiating cells with TRAIL based combination therapy ensures complete and lasting eradication of multiple myeloma tumours in vivo[J]. PLoS ONE, 2012,7(5):1-12.
[19] 王梁华,朱玉平,蔡清萍,等. TRAIL诱导肿瘤细胞凋亡及其与FHIT基因突变关系的初步研究[J]. 第二军医大学学报, 2002,23(2):136-139.
[20] VICRORIAFEAD I, CHARLIE G B. Sub-lethal irradiation of human colorectal tumor cells imparts enhanced and sustained susceptibility to multiple death receptor signaling pathways[J]. PLoS ONE, 2012,7(2):1-9.
[21] 张明,周梁. 肿瘤坏死因子相关凋亡诱导配体与放化疗联用对喉癌细胞的协同杀伤效应及机制[J]. 中华耳鼻咽喉头颈外科杂志, 2009,44(7):565-570.
[22] 王衍刚,窦以河,刘世海,等. 重组分泌型TRAIL腺病毒载体的构建及鉴定[J]. 齐鲁医学杂志, 2011,26(6):494-497.
[23] ESTHER H J W, INGE V, STEFAN R, et al. TRAIL enhances efficacy of radiotherapy in a p53 mutant,Bcl-2 overexpressing lymphoid malignancy[J]. Radiotherapy and Oncology, 2006,80:214-222.
[24] ARUL M, CHINNAIYAN, UTTARA P, et al. Combined effect of tumor necrosis factor-related apoptosis-inducing ligand and ionizing radiation in breast cancer therapy[J]. PNAS, 2000,97:754-1759.
