相分离法在丙氨酸分离中的应用
2012-10-27冷一欣顾长宏黄春香
冷一欣,顾长宏,黄春香
(常州大学石油化工学院,江苏 常州 213164)
相分离法在丙氨酸分离中的应用
冷一欣,顾长宏,黄春香
(常州大学石油化工学院,江苏 常州 213164)
采用相分离法分离卤代酸法生产的丙氨酸。在20℃条件下,粗品与洗涤液质量比为1:16,对丙氨酸粗产品进行分离,考察相分离洗涤液循环次数对氯化铵脱除率、丙氨酸纯度、丙氨酸回收率的影响。结果表明:洗涤循环10次时,氯化铵脱除率达到88.0%以上,丙氨酸的纯度大于98.0%,平均回收率为93.6%。相分离操作简单,分离效果较好,适于卤代酸法生产丙氨酸的分离和纯化。
丙氨酸;相分离;氯化铵;提纯
丙氨酸是组成人体蛋白质的20种氨基酸之一[1],同时也是一种重要的化工中间体,广泛应用于食品、化妆品和医药领域中[2-4]。在食品领域中,丙氨酸可作为调味剂来改善酱腌菜、腊肉等腌渍类食品的涩味,调节豆豉、泡菜、酸奶等发酵类食品的酸味,增加肉类、海藻类、果实类等食品的鲜味,缓和柑橘精制品、茶、咖啡等饮料的苦味;丙氨酸可作为防腐剂来用于豆制品、水产品、腌制品等的保鲜和防止蛋黄酱、油类等食品的氧化;丙氨酸也可作为营养剂来保持人体精力、消除人体疲劳、提高人体免疫力;丙氨酸还是合成二肽甜味剂阿力甜的重要原料。
随着人们对丙氨酸需求量的不断增加,丙氨酸的分离和纯化也受到越来越多的关注。目前国内主要采用卤代酸法生产丙氨酸,此反应液中含有大量铵盐,与丙氨酸的性质十分相似,导致丙氨酸分离困难、成本高、效率低,分离效果不理想。工业上主要采用甲醇醇析分离法(反应母液与甲醇体积比1:(3~4)),此法需消耗大量甲醇,甲醇易燃易爆,易造成毒害及污染环境。除此之外,丙氨酸分离和纯化的方法还有离子交换法[5-6]、膜分离法[7-9]、萃取法[10]和沉淀法[11-13]。离子交换法分离周期长、速度慢、效率低;膜分离法主要用于混合氨基酸的分离;萃取法适合提取浓度较低的氨基酸;沉淀法所得氨基酸杂质较多,且沉淀剂难以回收利用。
相分离是二元或多元系统在一定的温度和成分范围内,存在着两个成分不同的相的稳定平衡,当某一环境条件变化时,相与相之间出现分离的不稳定倾向。针对目前国内丙氨酸分离工艺毒性高、污染大的缺陷,以及分离方法效率低、速度慢的不足,本实验对卤代酸法合成丙氨酸的反应液进行初步分离,然后采用相分离法来分离和纯化丙氨酸,该方法简单、高效、无污染,且国内外未见相关文献报道,为丙氨酸的工业化分离和纯化提供参考。
1 材料与方法
1.1 材料与试剂
高氯酸(分析纯) 上海桃浦化工厂;冰醋酸、结晶紫、氨水(均为分析纯)、乌洛托品(化学纯) 国药集团化学试剂有限公司;2-氯丙酸(工业级) 常州大进化工科技有限公司。
1.2 仪器与设备
SHZ-E循环水真空泵 河南巩义市英峪予华仪器厂;JA2003电子天平 上海良平仪器仪表有限公司;D-8401机械搅拌器 天津市华兴科学仪器厂;RE2000旋转蒸发仪 上海亚荣生化仪器厂;SHA-C台式恒温振荡器 常州国华电器有限公司;DHG-9076A电热鼓风干燥箱 上海精宏实验设备有限公司;HJ-4磁力搅拌器 金坛市杰瑞尔电器有限公司。
1.3 丙氨酸的合成及分离流程

1.3.1 丙氨酸的合成
准确称量5.0g乌洛托品、10.0mL去离子水,室温下搅拌溶解,加入80.0mL氨水,然后缓慢滴加25.0g 2-氯丙酸,在65℃水浴中反应8h,得到丙氨酸的反应母液。
1.3.2 丙氨酸的初步分离
反应母液经浓缩、冷却、抽滤,滤饼于70℃干燥[14],得到丙氨酸粗品。
1.3.3 丙氨酸的相分离
实验中的相分离是指用饱和丙氨酸溶液溶洗丙氨酸粗品,从而除去其中的氯化铵,达到分离和纯化丙氨酸的目的。准确称取10.0g丙氨酸粗品加入到160.0g饱和丙氨酸溶液中,即粗品与洗涤液质量比为1:16,20℃搅拌30min,抽滤,滤饼为丙氨酸产品,滤液用作下一次的洗涤液,进行连续的相分离。
1.4 氯化铵的脱除率及丙氨酸纯度的计算
1.4.1 氯化铵脱除率计算公式
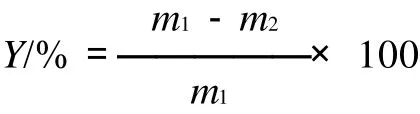
式中:Y为氯化铵的脱除率/%;m1为分离前丙氨酸粗品中氯化铵的质量/g;m2为分离后丙氨酸产品中氯化铵的质量/g。
1.4.2 丙氨酸含量(纯度)测定[15]
准确称取0.2000g丙氨酸,置于干燥的锥形瓶中,加50mL乙酸,加2滴结晶紫指示液(2g/L),用0.1mol/L高氯酸标准溶液滴定至溶液呈蓝绿色。同时做空白实验。
丙氨酸含量计算公式:

式中:X为丙氨酸的质量分数/%;V1为高氯酸标准滴定溶液的体积/mL;V2为空白试验消耗高氯酸标准滴定溶液的体积/mL;c为高氯酸标准滴定溶液的浓度/(mol/L);0.08909为与1.00mL1.000mol/L高氯酸标准滴定溶液,以克表示丙氨酸的质量;m为丙氨酸的质量/g。
2 结果与分析
2.1 丙氨酸的初步分离
卤代酸法生产丙氨酸的反应母液中含有丙氨酸、乌洛托品、氯化铵,其中丙氨酸未达到饱和,不能从母液中直接析出,因此要对其进行浓缩,增大丙氨酸在母液中的浓度,促使丙氨酸析出。初步分离可以除去乌洛托品和大部分的氯化铵,得到丙氨酸粗品。控制结晶温度30℃,结晶时间12h,根据1.3.2节方法,考察反应母液的浓缩程度对丙氨酸粗品质量和纯度的影响,结果见表1。

表1 浓缩程度与粗品质量、纯度的关系Table 1 Effect of concentration ratio on the recovery and purity of alanine
从表1可以看出,反应母液的浓缩量对丙氨酸粗品质量和纯度的影响较大。不浓缩时,用盐酸调节pH值到丙氨酸的等电点(pH6.02)使丙氨酸结晶,所得粗品质量较大,这是由于丙氨酸在其等电点时溶解度最低,析出的丙氨酸粗品较多,但在不浓缩时,纯度偏低,这是因为调节pH值到丙氨酸等电点的过程中,产生了氯化铵,使得母液中的杂质氯化铵的浓度增加,导致丙氨酸粗品纯度偏低。随着母液浓缩量从10%增加,丙氨酸粗品的质量也逐渐增加,纯度降低。当浓缩量达到40%和45%时,母液稠化严重,结晶时易于形成聚结体,中间夹杂母液,导致产品的纯度大大降低。因此,在兼顾产品质量和纯度的情况下,选用浓缩量为35%的丙氨酸进行相分离。
2.2 丙氨酸的相分离
2.2.1 洗涤液中物质浓度的变化及过程分析
在对丙氨酸进行分离的整个洗涤过程中,丙氨酸洗涤液质量为160.0g保持不变,丙氨酸在洗涤液中的初始质量分数为其饱和溶液13.6%(D点),随着过程的进行,洗涤液溶解粗品中的氯化铵,洗涤液中氯化铵的质量分数在缓慢增加,而丙氨酸质量分数由于氯化铵的溶入而缓慢变小(从D点到E点),氯化铵饱和溶液的质量分数为27.1%(E点)。这可由三元相图解释,如图1所示。

图1 20℃,Ala-NH4Cl-H2O三元相图Fig.1 Ternary phase diagram of Ala-NH4Cl-H2O at 20 ℃
丙氨酸粗品中丙氨酸纯度82.7%为图中x0点,D和F分别是纯丙氨酸和纯氯化铵在水中的溶解度,E为同时饱和了丙氨酸和氯化铵的饱和溶液的相点。区域ADEFA是含有丙氨酸和氯化铵的不饱和溶液单相区,区域DBED是固相B(Ala)丙氨酸与其饱和溶液共存的二相区,区域FECF是固相C(NH4Cl)氯化铵与其饱和溶液共存的二相区。
在丙氨酸粗品中加入纯水洗涤,洗涤过程的状态点沿x0A移动;若粗品中加入饱和丙氨酸溶液洗涤,其状态点将沿x0D移动,Q1的位置与饱和丙氨酸溶液的量和粗品的量有关,符合杠杆定律。即对粗品丙氨酸进行第1次洗涤时,m(丙氨酸粗品):m(洗涤液)=Q1D:x0Q1,此时体系固液两相平衡,平衡两相的组成由连接线的两端点所确定,连BQ1线并延长交DC线得N1点,B点为纯的丙氨酸晶体,N1点为滤出丙氨酸晶体后的洗涤液1。固液两相的量服从杠杆规则,两相的质量比m(丙氨酸):m(洗涤液1)=Q1N1:BQ1,完成一次相分离。第2次洗涤时,过程的状态点将沿着x0N1移动,Q2的位置与洗涤液1的量和粗品的量有关,符合杠杆定律,m(丙氨酸粗品):m(洗涤液1)=Q2N1:x0Q2,同样连BQ2线并延长交DC线得N2点,N2点为滤出丙氨酸晶体后的洗涤液2。此时体系固液两相平衡,两相的量服从杠杆规则,两相的质量比m(丙氨酸):m(洗涤液2)=Q2N2:BQ2,完成第二次相分离……第t次时,过程状态点沿着x0Nt-1移动到达Qt,两相的量同样服从杠杆规则。
用过滤后的溶液(洗涤液1、洗涤液2、……、洗涤液t)作为循环用的洗涤液顺序洗涤,对丙氨酸进行相分离,洗涤完成后滤出固体丙氨酸,液相组成会沿着N1、N2、…、Nt点向E点移动并最终到达E点,此刻洗涤液里面的氯化铵已经达到饱和,洗涤液不能继续使用。由图1可知,在洗涤的前几次,洗涤液能完全溶解而除去丙氨酸粗品中的氯化铵,对分离结果几乎没有影响,随着循环次数增加,洗涤液中氯化铵的浓度会增大并最后达到饱和,此后,洗涤液对氯化铵杂质失去了脱除作用。因此,相分离的洗涤液应该在达到E点之前结束使用。
2.2.2 洗涤液循环次数对氯化铵脱除率的影响
氯化铵脱除率对丙氨酸的分离纯度有直接的影响,氯化铵脱除率越大,分离效果越好,丙氨酸纯度越高。控制温度20℃,用饱和丙氨酸溶液160.0g洗涤丙氨酸粗品10.0g,洗涤时间30min,考察相分离过程中洗涤液循环次数对氯化铵脱除率的影响,结果如图2所示。

图2 洗涤液循环次数对氯化铵脱除率的影响Fig.2 Effect of repeated washing number on the removal rate of ammonium chloride
由图2可知,随着洗涤次数的增加,氯化铵的脱除率在逐渐降低。这是因为随着洗涤次数的增加,丙氨酸粗品中的氯化铵溶解到洗涤液中,导致洗涤液中氯化铵的浓度增大,从而阻碍了对氯化铵的脱除。洗涤20次后,脱除率仍然比较理想为77.0%,说明相分离能有效地除去混晶中的氯化铵杂质。当洗涤循环到第10次时,氯化铵脱除率为88.0%,此时脱除效果较好,所以实验中洗涤液循环洗涤10次较为适宜。
2.2.3 洗涤液循环次数对丙氨酸纯度的影响
控制温度20℃,用饱和丙氨酸溶液160.0g洗涤丙氨酸粗品10.0g,洗涤时间30min,考察相分离过程中洗涤液循环次数对丙氨酸纯度的影响,结果如图3所示。
从图3可以看出,随着洗涤液循环次数的增加,分离后丙氨酸的纯度在逐渐降低,但降低程度不明显。随着洗涤的进行,洗涤液中氯化铵的浓度逐渐增大,但是还未达到饱和。混晶中的氯化铵已经被完全溶解而除去,但洗涤液里面溶解的氯化铵粘附在丙氨酸晶体表面,导致了丙氨酸纯度的降低。丙氨酸的纯度,从第1次洗涤后的99.8%到第20次洗涤后的94.8%,仅下降了5%,表明相分离法分离的效果较好。实验中洗涤循环到第10次时,分离后纯度为98.0%仍较为理想,所以循环洗涤10次之内为佳。
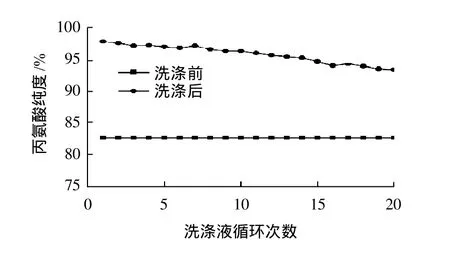
图3 洗涤液循环次数对丙氨酸纯度的影响Fig.3 Effect of repeated washing number on the purity of alanine
2.2.4 洗涤液循环次数对丙氨酸回收率的影响
控制温度20℃,用饱和丙氨酸溶液160.0g洗涤丙氨酸粗品10.0g,洗涤时间30min,考察洗涤液循环次数对丙氨酸回收率的影响。每次相分离完成,得到丙氨酸的回收率如图4所示。

图4 洗涤次数对丙氨酸回收率的影响Fig.4 Effect of repeated washing number on the recovery rate of alanine
从图4可以看出,第1次相分离丙氨酸回收率达到102.9%,高于平均值93.6%,这是因为用饱和丙氨酸溶液洗涤丙氨酸粗品时,洗涤中的丙氨酸由于过饱和而析出一部分;第2次丙氨酸的回收率小于平均值,这是由于洗涤液里丙氨酸由于析出而不再饱和,从而使产品里面的丙氨酸溶解到洗涤液中,导致回收率的降低。在20次的相分离分离过程中,丙氨酸的回收率趋于稳定为93.6%,说明洗涤的次数对丙氨酸的回收率基本没有影响。
3 结 论
实验主要采用相分离法分离卤代酸法生产的丙氨酸,在20℃,粗品与洗涤液质量比1:16,洗涤循环10次时,氯化铵脱除率达到88.0%以上,丙氨酸的纯度大于98.0%,平均回收率为93.6%。相分离法设备简单廉价,操作简单快速,而且处理量大、效率高、损失小、没有任何污染,洗涤液可以循环使用,是一种高效的绿色分离方法,为卤代酸法生产丙氨酸的分离提供了一定的工业参考价值。
[1] 库热西·玉努斯, 关亚群. 生物化学[M]. 北京: 科学出版社, 2006: 5.
[2] 刘志新. 氨基酸的应用与发展前景[J]. 生物学教学, 2008, 33(6): 57-58.
[3] 陈燕珠. 氨基酸的应用与发展趋势[J]. 化工时刊, 2001, 15(7): 4-7.
[4] 周锡梁, 杨飚, 林妙佳, 等. 氨基酸的应用与开发[J]. 深圳大学学报, 1999, 16(4): 1-6.
[5] BOWEN W R, MORAN E. Separation of amino acids at a synthetic ion exchange resin: thermodynamics and energetics[J]. Industrial and Engineering Chemistry Research, 1996, 35(2): 573-585.
[6] 李玉山. 胡芦巴中4-羟基异亮氨酸的提取分离工艺研究[J]. 食品科学, 2009, 30(8): 128-131.
[7] HONG S U, BRUENING M L. Separation of amino acid mixtures using multilayer polyelectrolyte nanofiltration membranes[J]. Journal of Membrane Science, 2006, 280(1/2): 1-5.
[8] BUKHOVETS A E, SAVEL, EVA A M, ELISEEVA T V. Separation of amino acids mixtures containing tyrosine in electromembrane system [J]. Desalination, 2009, 241(1/3): 68-74.
[9] SHEN Jingqing, YIN Weiping, ZHAO Yongxin, et al. Extraction of alanine using emulsion liquid membranes featuring a cationic carrier[J]. Journal of Membrane Science, 1996, 120(1): 45-53.
[10] JUANG R S, WANG Y Y. Amino acid separation with D2EHPA by solvent extraction and liquid surfactant membranes[J]. Journal of Membrane Science, 2002, 207(2): 241-252.
[11] 刘宇红. 氨基酸分离提纯的研究进展[J]. 内蒙古石油化工, 2006, 32 (5): 5-7.
[12] 刘艳梅, 周美华. 氨基酸的分离与提纯[J]. 浙江化工, 2004, 35(7): 16-19.
[13] 张金龙, 王静康, 尹秋响. 氨基酸的提取与精致[J]. 化学工业与工程, 2004, 21(2):101-106.
[14] 周骏山. 实用氨基酸手册[M]. 江苏: 无锡市氨基酸研究所科技情报室, 1989: 139.
[15] GB 1295—1993 化学试剂DL-丙氨酸[S]. 北京: 中国标准出版社, 1993.
Application of Phrase Separation in Alanine Purification
LENG Yi-xin,GU Chang-hong,HUANG Chun-xiang
(School of Petrochemical Engineering, Changzhou University, Changzhou 213164, China)
This work reports the application of phase separation for the separation of alanine produced with halogenated carboxylic acid. The purification of crude alanine with washing solution at a solid-to-solvent ratio of 1:16 was carried out under the condition of 20 ℃ to investigate the effect of number of washing cycles on the removal rate of ammonium chloride and the recovery and purity of alanine. Over 88.0% of the impurity ammonium chloride was removed after the tenth washing cycle and the purity and average recovery of alanine were larger than 98.0% and equal to 93.6%, respectively. The process of phase separation was easy, effective and suitable for the separation and purification of alanine produced by halogenated carboxylic acid method.
alanine;phrase separation;ammonium chloride;purification
TB14;TS201.2
A
1002-6630(2012)18-0250-04
2011-07-18
冷一欣(1961—),女,教授,博士,研究方向为绿色化学及药物中间体。E-mail:rxslyxcn@yahoo.com.cn
