疏肝健脾方药对NASH 大鼠Kupffer 细胞NF-κB p65 和IKKβ mRNA 及蛋白表达的影响*
2013-12-23杨钦河杨雪松胡巢凤张玉佩冯高飞王文晶何秀敏王彦平程少冰闫海震
韩 莉, 杨钦河, 杨雪松, 胡巢凤, 张玉佩, 冯高飞, 王文晶,何秀敏, 王彦平, 程少冰, 金 玲, 闫海震, 黄 进
(暨南大学1附属第一医院,2医学院中医系,3医学院组胚系再生医学教育部重点实验室,4医学院病理生理学系、国家中医药管理局病理生理三级实验室,广东 广州510632)
核因子κB(nuclear factor κB,NF-κB)是一种十分重要的核转录调控因子,在非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)动物模型和患者中,肝脏NF-κB 的表达显著增加[1-2],IκB 激酶β(IκB kinase β,IKKβ)是IκB 激酶复合体(IκB kinase,IKK)中的一个催化亚基,通过经典途径激活NF-κB,参与免疫应答、炎症反应等一系列病理生理过程[3],实验证明IKKβ 在NF-κB 信号通路活化过程中发挥重要的作用[4-5]。活化的NF-κB 通过信号转导通路调控下游靶基因高表达,其产物参与肝脏的急慢性炎症、肝纤维化、肝细胞再生和凋亡等病理生理过程[6]。NF-κB 的激活可能是肝脏和全身胰岛素抵抗(insulin resistance,IR)的根源,参与NASH 的发病。因此,抑制IKKβ 和NF-κB mRNA 及蛋白的表达,可能成为有效防治NASH 的途径之一。NASH 的发生发展的机制,目前尚不完全清楚,研究认为NASH 是一种遗传、环境及代谢应激相关性疾病,其发病机制与IR、氧化应激、脂质过氧化等作用相关,其中从炎症信号通路的研究成为近年研究的热点。我们以往的研究发现[7-9],疏肝健脾方药可以抑制Kupffer 细胞ERK1/2 蛋白的表达,下调肝组织NFκB p65 蛋白的表达,下调IKKβ mRNA 和蛋白表达,从而具有良好的抗NASH 效果。本实验实验通过观察大鼠Kupffer 细胞IKKβ 和NF-κB mRNA 及蛋白在疏肝健脾方药干预后的变化,探讨疏肝健脾方药抗大鼠NASH 的分子机制,旨在阐明NASH 发病机制为临床防治提供理论及实验依据。
材 料 和 方 法
1 材料
1.1 动物 SPF 级雄性SD 大鼠48 只,体重(200 ±20)g,购于广州中医药大学实验动物中心,动物许可证号为 SCXK (粤)2008-0020;粤监证字为2008A020。
1.2 实验用药
1.2.1 疏肝方( 柴胡疏肝散) 柴胡6 g,川芎5 g,枳壳5 g,陈皮6 g,白芍5 g,香附5 g,炙甘草3 g。
1.2.2 健脾方( 参苓白术散) 人参15 g,白术15 g,茯苓15 g,薏苡仁9 g,砂仁6 g,山药15 g,桔梗6 g,白扁豆12 g,莲子9 g,炙甘草9 g。
1.2.3 综合方 柴胡疏肝散与参苓白术散合方。
1.3 主要试剂 Nycodenz 细胞分离液(No.1002424-1)购自瑞典Axis-shield;Ⅳ型胶原酶(No.C8160-100)购 自 Gbico;Anti-Lysozyme (No. bs-0816R)购自武汉博士德生物技术有限公司;Quant cDNA 第1 链合成试剂盒(No. KR103)、SYBR Green荧光定量PCR 试剂盒(No. FP202)购自北京天根生化有限公司;Anti-IKKβ(No.2684)和Anti-Phospho-IKKβ(No.9958)购自Cell Signaling Technology;Anti-NF-κB p65(No.sc-372)购自Santa Cruz;核蛋白提取试剂盒和BCA 蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司。
2 方法
2.1 动物分组及给药 各组大鼠适应性饲养1 周后采用随机数字表法随机分为8 组,每组6 只。分别为:正常组(蒸馏水灌胃)、模型组(蒸馏水灌胃)、高剂量疏肝方组(9. 6 g·kg-1·d1柴胡疏肝散灌胃)、低剂量疏肝方组(3.2 g·kg-1·d-1柴胡疏肝散灌胃)、高剂量健脾方组(30.0 g·kg-1·d-1参苓白术散灌胃)、低剂量健脾方组(灌服10.0 g·kg-1·d-1参苓白术散)、高剂量综合方组(39.6 g·kg-1·d-1柴胡疏肝散与参苓白术散合剂)和低剂量综合方组(13.2 g·kg-1·d-1柴胡疏肝散与参苓白术散合剂)。各方药组成和剂量均参考上海科学技术出版社《方剂学》[10]。低剂量组药物为临床常规用量,高剂量组药物为临床常规用量的3 倍用量。上述药物均为中药配方颗粒剂,使用前蒸馏水调配,深圳华润三九医药股份有限公司生产,购于暨南大学附属第一医院中药房。
2.2 大鼠模型建立 NASH 大鼠模型的建立参照我们以往的实验方法[7-9],并加以改进。除正常组大鼠给予基础饲料喂养外,其余各组均以高脂饲料喂养。在施以造模因素的同时,各组按10 mL·kg-1给予相应的药物或蒸馏水灌胃,各药物组大鼠相应的药物剂量按大鼠体表面积折算,每天早晚各1 次。各组动物自由饮水进食,分笼饲养于暨南大学医学院病理生理学实验室内[(24 ±2)℃,明暗各12 h],每周定时称重,根据体重调整药量,连续16 周。
2.3 标本采集与样本制备 各组动物均于末次给药后,禁食不禁水12 h,3% 戊巴比妥钠腹腔麻醉(1mL/kg),剖腹,游离门静脉主干并插管固定,迅速注入肝素钠2 mL 1.5 ×106U/L)。采用离体循环灌注Ⅳ型胶原酶,差速离心、密度梯度离心和选择性贴壁分离Kupffer 细胞,Typan blue 染色和流式细胞术(flow cytometry,FCM)进行细胞活性和纯度鉴定。
2.3.1 Kupffer 细胞分离与纯化 细胞上清液经800 ×g 4 ℃离心10 min,沉淀加RPMI-1640 培养基垂悬。取15 mL 离心管若干支,最下层铺24%Nycodenz 2.5 mL,倾斜离心管45°用滴管沿管壁缓缓滴加11%Nycodenz 2.5 mL,用同样方法最上层加入2.5 mL 细胞悬液,1 500 × g 4 ℃离心15 min(正常组Kupffer 细胞分离采取10.8% Nycodenz-17.2% Nycodenz 密度梯度)。离心完毕,可看到4 个分层:最上层是含有细胞碎片的培养基;最上层和11% Nycodenz 之间呈云雾状细胞层为内皮细胞层;24% Nycodenz 和11% Nycodenz 之间云雾状细胞层为Kupffer细胞层;管底沉淀为部分肝细胞、红细胞及细胞碎片。吸管逐层吸弃前两层,收集Kupffer 细胞层于15 mL 离心管中加Gey's 平衡盐溶液垂悬,800 ×g 4 ℃离心5 min 2 次洗涤,沉淀用10%胎牛血清培养基垂悬,取悬液9∶1 Typan blue 进行染色,调整细胞浓度为(2 ~5)×109/L,接种于培养瓶,置于37 ℃、5%CO2培养箱中培养。Kupffer 细胞贴壁能力很强,分离后15 min 开始贴壁,3 h 后几乎完全贴壁,洗去未贴壁的细胞,更换新培养基,此即为纯化的Kupffer细胞。
2.3.2 Kupffer 细胞FCM 鉴定 细胞用胰蛋白酶消化后,PBS 洗涤2 次,加入固定剂固定15 min,离心去上清后加入破膜试剂,加入Ⅰ抗Anti-Lysozyme 室温孵育30 min,加入Ⅱ抗(羊抗兔IgG-FITC)室温孵育30 min,用破膜试剂洗涤2 次后上机检测。
2.3.3 Kupffer 细胞IKKβ 和NF-κB p65 mRNA 测定
Trizol 提取Kupffer 细胞RNA,测定含量并计算浓度,采用Oligo(dT)逆转录法,将RNA 逆转录为cDNA。从 GenBank 中 查 找 大 鼠 NF-κB (XM _342346.4)、IKKβ (NM_053355.2)和内参照GAPDH(NM_017008.3)的cDNA 序列,引物由上海捷瑞生物工程有限公司设计并合成。IKKβ 上游引物5’-CCGTGACTGTTGACTACTG-3’,下游引物5’-GTCCACTTCGCTCTTCTG-3’;NF-κB 上 游引 物5’-TGCATTCTGACCTTGCCTAT-3’,下 游 引 物 5 ’-TCCAGTCTCCGAGTGAAGC-3’;GAPDH 上游引物5’-CAAGTTCAACGGCACAGTCAA-3’,下游引物5’-TGGTGAAGACGCCAGTAGACTC-3’。反应体系:2.5 ×Real Master Mix/20 ×SYBR solution 9 μL,上、下游引物各2 μL,DNA 模板1 μL,加灭菌双蒸水补至总体积20 μL。反应条件:95 ℃预变性1 min,95 ℃10 s,GAPDH 57.5 ℃、IKKβ 52 ℃、NF-κB 60 ℃退火20 s,68 ℃延伸30 s,扩增40 个循环,反应完成后再于72℃至95 ℃,持续5 ~10 s 绘制熔解曲线。反应完毕,采用Opticon Monitor 3. 1 软件分析结果,用公式2-ΔΔCt方法进行相对定量。Ct 值=每个反应管内的荧光信号到达所设定的阈值时所经历的循环数,ΔΔCt = (Ct目的基因-Ct内参照基因)实验组-(Ct目的基因-Ct内参照基因)正常组,以未处理的空白组基因表达水平为1,2-ΔΔCt=实验组目的基因的表达相对于正常组的变化倍数。
2.3.4 Western blotting 分析Kupffer 细胞中IKKβ 和NF-κB p65 蛋白的表达 计数新鲜分离的细胞,每(5 ~10)×106加入1 mL RIPA 裂解液,对于核蛋白提取(检测NF-κB 表达水平)参照碧云天细胞核蛋白与细胞浆蛋白抽提试剂盒(No. P0027),全程冰上操作。匀浆,裂解30 min 后,将裂解液移至1.5 mL EP 管中,4 ℃、12 000 r/min 离心5 min,取上清置于-80 ℃保存。配制BSA 标准液,混匀后室温放置2 min,在分光光度计上比色分析,检测样品蛋白含量。配置凝胶,上样,电泳进行蛋白质的电转移与膜的封闭,将滤纸和滤膜在转移缓冲液中浸泡15 min,将滤膜放在平皿中,用1 × 丽春红溶液于脱色摇床上轻摇,染膜5 min 左右,然后用双蒸水洗,将滤膜放在平皿中,封闭液室温震摇1 ~2 h,4 ℃过夜,封闭结束后,将膜放入一塑料带中,加入溶有Ⅰ抗的新鲜配制的封闭液;4 ℃轻轻振摇2 h,用封闭液清洗3 次,每次约10 ~15 min,以除去过量的Ⅰ抗;将膜转入另一塑料袋中,加入溶于封闭液的Ⅱ抗;封口后室温振摇孵育1 ~2 h;取出滤膜,用TBST 漂洗3 ~5 次,每次10 ~15 min,洗去未结合的Ⅱ抗,曝光、显影、定影,凝胶图像分析。
3 统计学处理
数据采用SPSS 13.0 统计软件进行分析,数据以均数±标准差(mean±SD)或中位数(最小值~最大值)表示,组间均数比较采用单因素方差分析(Oneway ANOVA),中位数比较采用Kruskal-Wallis 检验,以P <0. 05 表示差异有统计学意义。
结 果
1 Kupffer 细胞计数、活性和形态
每只NASH 大鼠纯化后获得Kupffer 细胞数量为(1.5 ~2.0)×107个。取少量用胰蛋白酶消化后行Typan blue 染色,血细胞计数板在倒置相差显微镜下细胞计数,测定其活力均在95%以上。新鲜分离的Kupffer 细胞呈圆形,体积较小,约15 min 后开始贴壁,3 h 后贴壁完全,部分细胞已伸出伪足,见图1。

Figure 1. Isolated rat Kupffer cells culfured for 3 h (×100).图1 纯化后的Kupffer 细胞
2 FCM 鉴定Kupffer 细胞
如图2 所示,M1 为低浓度标记峰标志,FITC 为异硫氰酸荧光素。以M1 起始点与横坐标做平行线,平行线左侧表示阴性细胞,右侧表示阳性细胞,左图应用兔IgG 作为阴性对照,未见阳性细胞,右图可见阳性细胞。Anti-Lysozyme 检测Kupffer 细胞:共检测细胞10 000 个,表达lysozyme 的细胞共9 018 个,占所有细胞比例为90.18%,即Kupffer 细胞纯度为90.18%。

Figure 2. The purity of Kupffer cells identified by flow cytometer. Isolated kupffer cells positive for lysozyme were more than 90.18%.图2 FCM 细胞鉴定结果
3 各组大鼠Kupffer 细胞IKKβ 和NF-κB p65 mRNA 表达
与正常组比较,模型组Kupffer 细胞IKKβ 和NF-κB p65 mRNA 明显升高(P <0.01);与模型组比较,IKKβ mRNA 以高剂量综合方组、健脾方组和疏肝方组降低有统计学意义(P <0.01 或P <0.05)。NF-κB p65 mRNA 以高低剂量综合方组、高剂量健脾方组和高剂量疏肝方组降低有显著差异(P <0.01或P <0.05),其中高剂量综合方组和高剂量健脾方组降低趋势最明显,见表1、2。这提示NASH 的发生可能与Kupffer 细胞IKKβ 和NF-κB p65 mRNA 的高表达有关,而疏肝健脾方药能不同程度降低其表达水平。
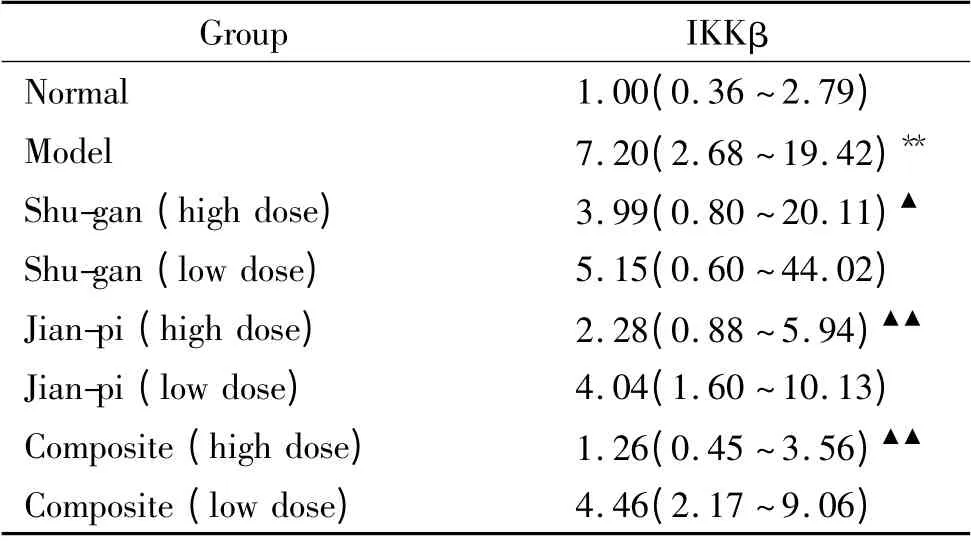
表1 Kupffer 细胞中IKKβ mRNA 的相对表达水平Table 1. The expression of IKKβ mRNA in Kupffer cells in each group[median(minimum ~maximum).n=6)]
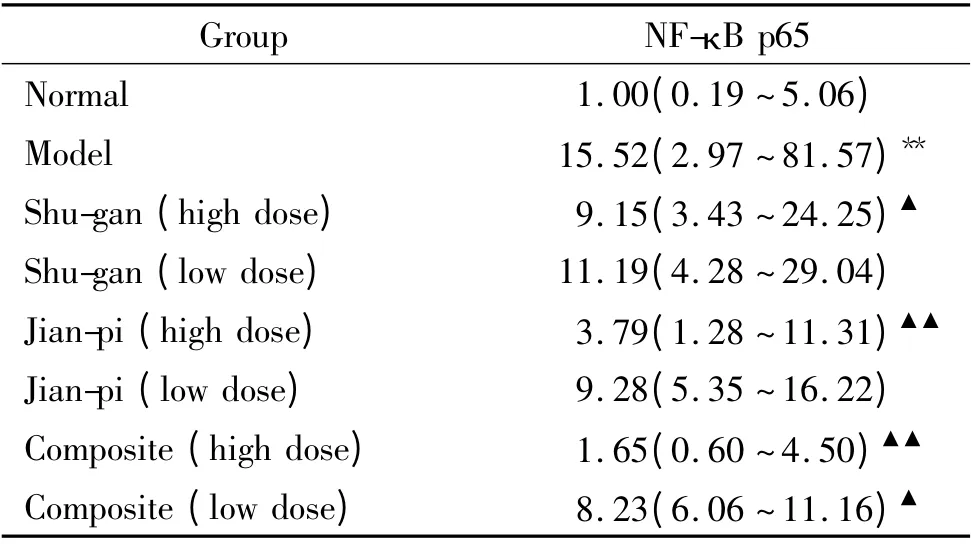
表2 Kupffer 细胞NF-κB p65 mRNA 相对表达水平Table 2. The expression of NF-κB p65 mRNA in Kupffer cells in each group[median(minimum ~maximum).n=6)]
4 各组大鼠Kupffer 细胞IKKβ、p-IKKβ 和NF-κB p65 蛋白表达
与正常组比较,模型组Kupffer 细胞IKKβ、p-IKKβ 和NF-κB p65 蛋 白 表 达 均 显著 升 高(P <0.01);与模型组相比,各药物组IKKβ 蛋白表达都有不同程度降低(P <0.01 或P <0.05),组间比较高剂量健脾方组优于其它各组(P <0.01),IKKβ 和p-IKKβ 表达由低到高依次为高剂量健脾方组﹤高剂量综合方组﹤低剂量综合方组﹤高剂量疏肝方组﹤低剂量疏肝方组﹤低剂量健脾方组。各用药组NFκB p65 蛋白表达也明显降低(P <0.01),高剂量健脾方组较其它各组降低更明显(P <0.01 或P <0.05),见图3 和表3。上述结果表明,NASH 模型Kupffer 细胞可能存在着IKKβ/NF-κB 信号通路蛋白的高表达及活化,而疏肝健脾方药在一定程度上能降低上述蛋白表达水平及活化,以高剂量健脾效果最明显高剂量。
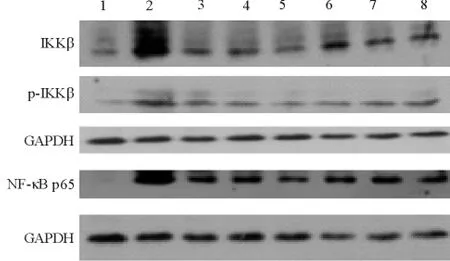
Figure 3. Expression of IKKβ,p-IKKβ and NF-κB p65 proteins in Kupffer cells. 1:normal group;2:model group;3:Shu-gan(high dose)group;4:Shu-gan (low dose)group;5:Jian-pi (high dose)group;6:Jianpi (low dose)group;7:composite (high dose)group;8:composite (low dose)group.图3 各组大鼠Kupffer 细胞IKKβ、p-IKKβ 和NF-κB p65蛋白的表达

表3 Kupffer 细胞NF-κB 信号通路蛋白表达比较灰度值比较Table 3. Expression of IKKβ,p-IKKβ and NF-κB proteins in Kupffer cells in each group (mean±SD. n=6)
讨 论
NF-κB 是一类重要的转录调控因子,在机体应激反应和免疫细胞活化、增殖、分化、凋亡及肿瘤的形成中发挥重要作用。能激活IκB 的一类蛋白被称为IKK 复合物,是NF-κB 信号通路上游的调节蛋白,几乎所有与NF-κB 激活有关的信号分子都要通过IKK 复合物介导产生效应[11]。研究表明,IKKα 和IKKβ 在NF-κB 信号通路的激活中发挥重要作用,尤其是IKKβ 在NF-κB 经典信号通路活化中发挥尤为重要的作用[12]。
NF-κB 通过2 种途径参与NASH 的发病。(1)TIR (Toll/interleukin-1 receptor,TIR)家族。蛋白被配体激活后,通过活化MyD88-TRAF6-TAK1,从而启动IKK-NF-κB 信号通路。(2)肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)家族。TNFR被配体激活后,发生三聚体化,与TNFR 相关死亡结构域蛋白(TRADD)形成TNFR-TRADD 复合物,募集TNFR 相关因子2(TRAF2)和受体相关蛋白(RIP),TRAF 使RIP 泛素化,通过与IKK 的IKKγ 亚基结合使IKK 集聚于TNFR 复合物,从而活化IKK-NF-κB信号通路[13-14]。
本研究结果显示,与正常组比较,NASH 模型组Kupffer 细胞IKKβ、NF-κB mRNA 及IKKβ、p-IKKβ、NF-κB 蛋白明显升高,表明NASH 发病中可能存在着Kupffer 细胞IKKβ-NF-κB 信号通路的活化。与模型组比较,各用药组Kupffer 细胞IKKβ mRNA 表达以高剂量综合方组和高剂量健脾方组、高剂量疏肝方组降低有统计学意义,NF-κB mRNA 表达以高低剂量综合方组、高剂量健脾方组和高剂量疏肝方组降低明显,IKKβ 及NF-κB mRNA 以高剂量综合方组和高剂量健脾方组下降趋势更明显。与模型组比较,各用药组IKKβ 及磷酸化蛋白表达都有不同程度下调,高剂量健脾方组IKKβ 蛋白表达水平下降更为明显,表达趋势和IKKβ mRNA 基本相同。各用药组NF-κB 表达也明显降低,高剂量健脾方组较其它各组降低更明显。这提示高剂量健脾方组和高剂量综合方组药物在IKKβ 和NF-κB mRNA 及蛋白表达方面都有明显的下调作用。随着NASH 炎症程度的不断加深,Kupffer 细胞中可能存在着NF-κB 信号通路的激活,NASH 的发生可能是启动NF-κB 信号通路作用的结果,高剂量健脾方和高剂量综合方药物能起到很好的下调NF-κB 信号通路相关基因及蛋白表达的作用,可能是其防治NASH 的重要机制之一。
[1] 熊振芳,邢彩珍,乔桂圆,等. 杞荷制剂对非酒精性脂肪性肝炎大鼠肝组织核因子-κB/IκB 的影响[J]. 中西医结合肝病杂志,2011,21(5):295-297.
[2] 施军平,范建高,陈芝芸,等.非酒精性脂肪性肝炎患者肝组织NF-кB 的表达及其意义[J]. 实用肝脏病杂志,2008,11(4):222-224.
[3] 王晓璐,方玉春,李 静.IKKβ 结构与功能及其抑制剂研究进展[J].中国药理学通报,2012,28(2):158-161.
[4] Drew D,Shimada E,Huynh K,et al.Inhibitor κB kinase β binding by inhibitor κB kinase γ[J].Biochemistry,2007,46(43):12482-12490.
[5] 刘 杰,阚 丹,刘立思. IKK/IκB/NF-κB 信号通路阻断及临床应用[J].实用医学杂志,2008,24(23):4147-4149.
[6] Guan YS,He Q,Wang MQ,et al. Nuclear factor kappa B and hepatitis viruses[J]. Expert Opin Ther Targets,2008,12(3):265-280.
[7] 孟民杰,杨钦河,王 强,等. 不同治法方药对脂肪肝大鼠Kupffer 细胞ERK1/2 蛋白活性的影响[J].中国病理生理杂志,2007,23(8):1551-1555.
[8] 杨钦河,谢 芳,王凤珍,等. 不同治法方药对脂肪肝大鼠肝组织NF-кBp65 及Kupffer 细胞p38MAPK 蛋白表达的影响[J]. 广州中医药大学学报,2009,26(2):141-147,199.
[9] 魏 波,杨钦河,王文晶,等. 疏肝健脾方对NASH 大鼠肝组织IKKβ mRNA 和蛋白表达的影响[J]. 中国病理生理杂志,2012,28(8):1448-1454.
[10]段富津.方剂学[M].第1 版.上海:上海科学技术出版社,1995:114-115,178-179.
[11] Hayden MS,Ghosh S. Signaling to NF-κB[J]. Genes Dev,2004,18(18):2195-2224.
[12]Bakkar N,Guttridge DC. NF-κB signaling:a tale of two pathways in skeletal myogenesis[J]. Physiol Rev,2010,90 (2):495-511.
[13]Oeckinghaus A,Hayden MS,Ghosh S. Crosstalk in NFκB signaling pathways[J]. Nat Immunol,2011,12(8):695-708.
[14]Niederberger E,Geisslinger G. The IKK-NF-κB pathway:a source for novel molecular drug targets in pain therapy?[J]. FASEB J,2008,22(10):3432-3442.
