壳聚糖/液晶复合水凝胶的制备及细胞相容性研究*
2013-12-23司徒方民韩婉清査振刚叶菁芸张嘉晴周长忍
司徒方民, 韩婉清, 屠 美△, 査振刚, 曾 戎, 叶菁芸, 吴 昊, 张嘉晴, 周长忍
(暨南大学1华文学院,2 理工学院材料科学与工程系,3 教育部人工器官及材料工程研究中心,4附属第一医院,5医学院,广东 广州510632)
随着生物材料及组织工程领域取得的进展,已发展出多种构建仿生材料的表面工程技术[1-2]。表面工程化的生物材料已被证明对蛋白吸附、细胞相互作用及宿主反应有重要作用[3-4]。其中仿生化表面是生物材料制备的重要策略,如表面引入生物活性分子(细胞结合位点、生长因子等)[2],或构建软物质细胞模型均是促进细胞附着、增殖、分化及细胞相互作用的有效手段[1]。由于合成材料缺少细胞识别位点,因此天然材料成为用于组织修复及构建三维细胞培养模型仿生设计的理想选择。
壳聚糖(chitosan,CS)是继纤维素后自然界中存在最多的天然多糖,由于其物化性质、生物性能及理想的生物活性[5]而被认为具有极高的生物医用价值。壳聚糖基水凝胶因具有与软组织相近的机械性能,其较低的界面张力使细胞易于跨越组织/植入体界面,同时其亲水性的三维网状结构有利于营养物质、氧气及代谢产物的运输[6]而广泛应用于药物控制释放及细胞培养。但是,纯粹的天然材料仍存有缺陷,无法满足理想仿生设计的苛刻要求。
本研究将选择具有一定流动及取向性的羟丙基纤维素酯类液晶与壳聚糖水凝胶复合,构建仿生壳聚糖/液晶(chitosan/liquid crystal,CS/LC)复合水凝胶作为细胞培养基体以调控细胞与生物材料界面的相互作用。本课题组前期研究结果已显示,羟丙基纤维素酯与聚合物材料复合后,可在聚合物基体中自发形成液晶畴,而后与基质材料构成相分离,此结构形态类似于生物膜的液晶态结构因而呈现出良好的细胞相容性[7]。本文拟构建壳聚糖/羟丙基纤维素酯液晶复合水凝胶,通过探索复合水凝胶的表面形貌及液晶与壳聚糖的相分离结构,探究此仿生结构及液晶相对细胞相容性的影响,研究结果将为此类新型仿生液晶态材料应用于生物医用领域提供科学依据。
材 料 和 方 法
1 材料
CS(分子量350 000)购自Sigma,使用前纯化;所用其它试剂均为分析纯。2 种羟丙基纤维素酯由本实验室合成,即羟丙基纤维素辛酯(octyl hydroxypropyl cellulose ester,OPC;分子量93 700,玻璃化转变温度16.5 ℃,熔融温度132.5 ℃)和羟丙基纤维素丁酯(butyl hydroxypropyl cellulose ester,BPC;分子量92 300,玻璃化转变温度18.49 ℃,熔融温度156.3 ℃)[8]。液晶的化学合成过程如图1所示。
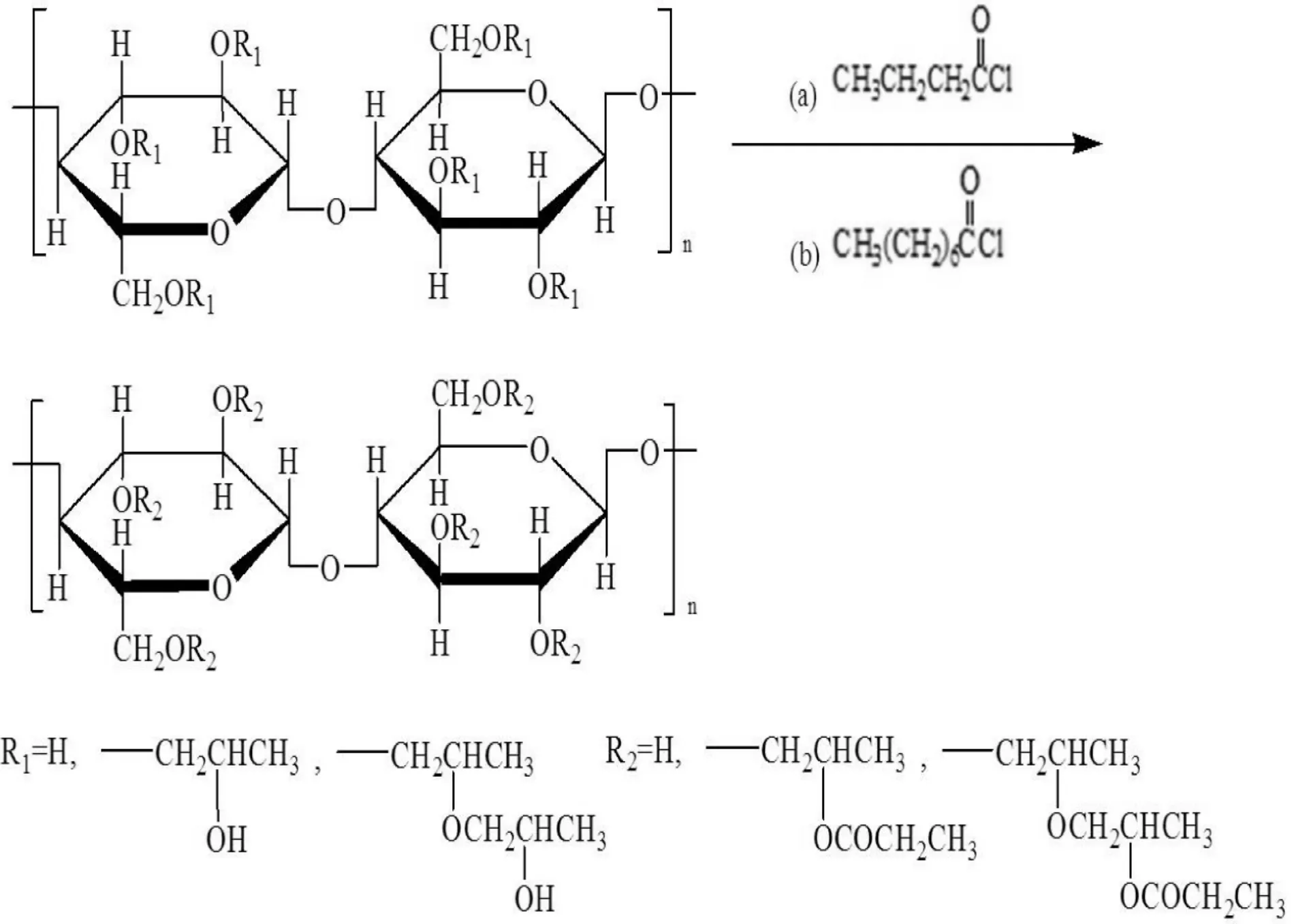
Figure 1. The synthetic route of liquid crystal.图1 液晶的合成途径
壳聚糖脱乙酰度采用线性电位滴定法测量,结果测得脱乙酰度为67.36%。
2 物理交联CS/LC 复合水凝胶的制备
称取适量CS 粉末分散于与其氨基等当量的盐酸中进行氨基质子化作用,经1 d 充分溶解后加入与盐酸等质量的1,2-丙二醇,充分混合1 d 获得混合溶液,此时壳聚糖浓度为1%(m/m)。称取一定质量的BPC/OPC 溶于乙醇,CS∶LC(m/m)分别为1∶1、1∶2和1∶3(标记为LC-1、LC-2 和LC-3),用喷雾法将LC 混合液加入CS 溶液中并快速搅拌,将制得的混合溶液倒入模具中,在50 ℃环境下去除水和有机溶剂,得到壳聚糖/液晶复合醇凝胶。将所制凝胶在1 mol/L NaOH 溶液中浸泡1 d,大量去离子水充分清洗。
3 CS/LC 复合水凝胶的表征
3.1 X 射线衍射( X-ray diffraction,XRD) 分析 取一定质量壳聚糖/液晶复合水凝胶,液氮冷冻后通过冷冻干燥机干燥,样品压片后用D/MAX-1200 型X射线衍射仪(Rigaku)进行测试,以Cu 射线为射线源,扫描速度8°/min,步宽0.02°,扫描角度(2θ)为5~60°,分析样品的结晶行为。
3.2 扫描电镜( scanning electron microscope,SEM)观察 将不同液晶含量的壳聚糖/液晶复合水凝胶膜用液氮冷冻后通过冷冻干燥机干燥,样品喷金处理后用XL-30 ESEM 型扫描电子显微镜(Philips)观察其表面微观形貌特征。
4 细胞相容性研究
4.1 成纤维细胞活性测定 细胞活性测定选用改良的MTT 法。
BPC/OPC 制备成厚度约1 mm 膜,壳聚糖水凝胶以及各比例的壳聚糖/液晶复合水凝胶制成膜,经过[60Co]灭菌后铺于48 孔板底部,每组3 个平行样本,无菌PBS 冲洗后种板。取冻存的3T3 小鼠胚胎成纤维细胞进行复苏,传至第3 代后进入对数生长期。0.25%胰酶消化收集细胞,离心并加入培养基吹打获得均匀的单细胞悬液,倒置显微镜下通过血球计数板计数并调节细胞悬液至1.5 ×107/L,以每孔500 μL 接种于材料上,每隔2 d 换1 次培养基。
细胞培养1 d、3 d、5 d 和7 d 后每孔加入100 μL MTT 并继续在CO2细胞培养箱中培养4 h,再加入500 μL 三联液并继续在CO2细胞培养箱中培养,1 d后依次将混合液移入96 孔板中,在检测波长570 nm、参考波长630 nm 处测量吸光度,所有操作需避光进行。
4.2 细胞形态观察 BPC/OPC 膜,CS 水凝胶以及各比例的壳聚糖/液晶复合水凝胶膜的制备及材料表面3T3 小鼠胚胎成纤维细胞的培养同上。细胞培养3 d 和6 d 后,PBS 冲洗3 次,2.5%戊二醛固定1 h,75 %、85 %、95 %和100 %梯度乙醇脱水后冻干进行喷金处理,用XL-30 ESEM 型扫描电子显微镜观察细胞生长状态。
5 统计学处理
数据以均数±标准差(mean ±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA)和LSD-t 检验,以P <0.05 为差异有统计学意义。
结 果
1 CS/LC 复合水凝胶微观结构观察
图2 为不同比例的CS/LC(BPC 或OPC)复合水凝胶的SEM 照片,结果显示,LC 均匀地分布在CS 基质中聚集成液晶畴,与CS 形成“海-岛”状相分离结构,类似生物膜的“流动镶嵌模型”。随着液晶含量增多,液晶畴密度增大。当CS∶LC 质量比达到1∶1时,液晶畴向外伸展,开始相互连接,但其尺寸保持在4 ~10 μm。
液晶态已被证明广泛存在于生物体系中并通过非共价键相互作用进行自发的有序排列[9]。本研究制备的CS/LC 复合水凝胶中镶嵌的微米尺寸液晶畴,其呈现的有序结构可视为活性位点,可作为组织工程活细胞界面。

Figure 2. SEM micrographs of the surface of CS/LC composite hydrogel. BPC-1(OPC-1),BPC-2(OPC-2)and BPC-3(OPC-3)mean CS∶BPC(OPC)=1∶1,1∶2 and 1∶3 (m/m),respectively.图2 不同比例CS/LC 复合水凝胶表面的SEM 照片
2 CS/LC 复合水凝胶XRD 分析
CS/LC 复合水凝胶的XRD 谱图如图3 所示。结果显示BPC 在2θ =7°和20°有2 个明显的衍射峰,而CS/BPC 复合水凝胶的XRD 谱图与纯CS 水凝胶类似,无明显的衍射峰。当在CS 基质中引入BPC后,由于受到CS 水凝胶三维网状结构的束缚,BPC无法自聚集形成较大的本体结构而形成小而分散的BPC 畴,因此在XRD 谱图中未见明显的衍射峰,表明CS/BPC 复合水凝胶主要呈现非晶态。同样,CS/OPC 复合水凝胶的XRD 谱图也呈现类似的结果。
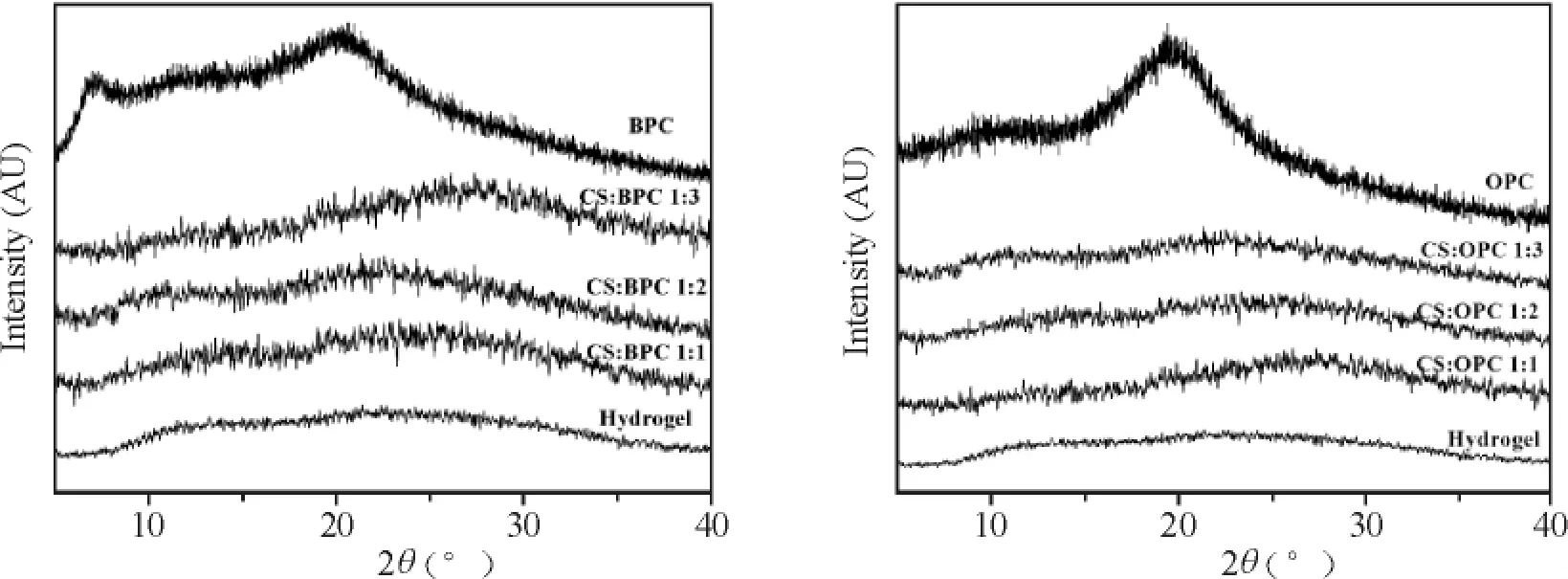
Figure 3. XRD patterns of CS/LC composite hydrogel.图3 不同比例CS/LC 复合水凝胶XRD 谱图
3 CS/LC 复合水凝胶的细胞相容性
3.1 细胞活性测定 图4 显示3T3 成纤维细胞在CS 水凝胶、CS/LC 复合水凝胶及纯LC 膜表面培养不同周期(1、3、5、7 d)的细胞活性,组织培养板(tissue culture polystyrene,TCPS)作为空白对照组。结果显示,3T3 细胞在CS/LC 复合水凝胶及TCPS 表面增殖情况相近,但优于纯LC 膜表面。体外培养1 d后,复合水凝胶表面的细胞增殖速率明显高于TCPS及纯LC 膜表面,这归因于复合水凝胶具有的类软组织黏弹性及液晶畴流动特性促进了细胞的早期黏附。培养3 d 后,CS 水凝胶及CS/LC 复合水凝胶表面的细胞增殖率显著增加,表明水凝胶体系对细胞增殖有很好的促进作用。CS/OPC 复合水凝胶表面细胞的增殖速率明显优于CS/BPC 表面,这是由于OPC 大分子本身结构中含有长而柔的侧链,使CS/OPC 复合水凝胶的黏弹性更接近于软组织[10],这种可调的液晶刚-柔界面[11]可大大促进细胞的增殖。
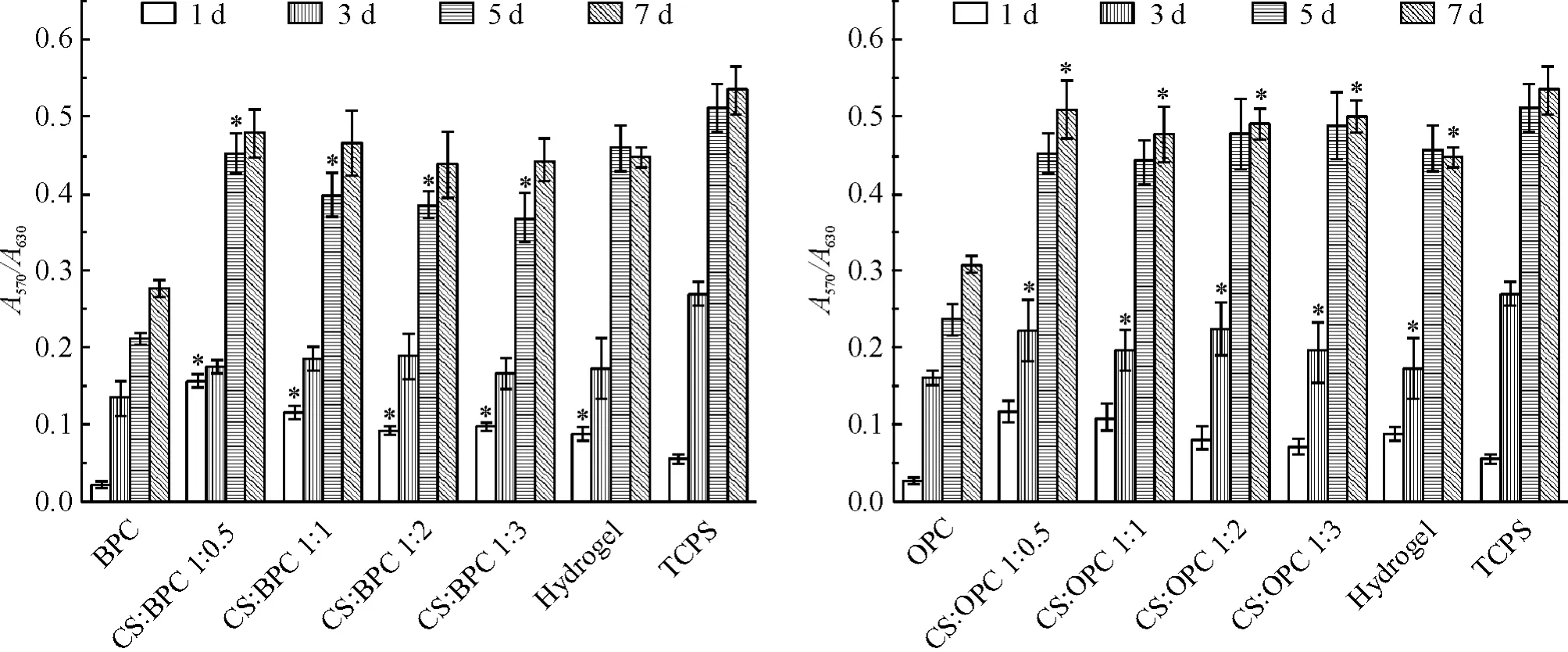
Figure 4. Cell viability tests on different CS/LC(BPC or OPC)composite hydrogels.TCPS:tissue culture polystyrene. Mean±SD.n=3. * P <0.05 vs BPC or OPC group at the same time point.图4 不同比例CS/LC 复合水凝胶的细胞活性测定
3.2 细胞形态观察 图5 显示3T3 成纤维细胞在CS 水凝胶及不同比例CS/LC 复合水凝胶表面培养3 d 的细胞形态。SEM 观察显示细胞呈球形,且分泌出大量细胞外基质(extracellular matrix,ECM),细胞通过ECM 相互连接,表明细胞在材料表面呈现良好的生长状态。图6 显示了细胞在材料表面培养6 d的细胞形态。细胞在纯LC 膜表面只是均匀地伸展,而在复合水凝胶上则彼此连接并覆盖整个表面区域,表明细胞在复合水凝胶基质上大量繁殖。与纯CS 水凝胶相比较,细胞在CS/LC 表面分泌出更多的ECM,由此揭示复合水凝胶体系结构中的CS 与LC之间产生协同作用,从而促进了细胞的铺展和增殖。

Figure 5. SEM photos of 3T3 cells cultured in vitro on composite hydrogels and CS hydrogel for 3 days. BPC-1(OPC-1),BPC-2(OPC-2)and BPC-3(OPC-3)mean CS∶BPC(OPC)=1∶1,1∶2 and 1∶3 (m/m),respectively.图5 3T3 细胞在复合水凝胶以及CS 水凝胶表面体外培养的SEM 照片(3 d)

Figure 6. SEM photos of 3T3 cells cultured in vitro on composite hydrogels and CS hydrogel for 6 days. BPC-1(OPC-1),BPC-2(OPC-2)and BPC-3(OPC-3)mean the CS∶BPC(OPC)=1∶1,1∶2 and 1∶3 (m/m),respectively.图6 3T3 细胞在复合水凝胶以及CS 水凝胶表面体外培养的SEM 照片(6 d)
讨 论
CS 具有与人体黏多糖分子相近的化学结构,而CS 水凝胶具有类似于人体软组织的黏弹性从而能促进细胞的黏附和生长。在CS 基体中引入胆甾型液晶(BPC/OPC)可构成具有相分离结构的CS/LC复合水凝胶,其“海-岛”状表面形态类似于生物膜的“流体镶嵌模型”,这种有序结构可促进细胞的早期黏附,并通过提供大量的活性位点促进细胞的增殖、迁移及ECM 的分泌[12]。由于CS/LC 复合水凝胶结合了水凝胶类软组织黏弹性及液晶有序性和流动性的特征,因而增进了细胞与基质界面之间的相互作用。同时疏水性LC 与亲水性CS 之间通过相分离构成的亲-疏水平衡达到恰好适于细胞黏附和生长的程度[13]。基质的黏弹性对细胞的相互接触与黏附有重要影响,本研究中制备的CS/LC 复合水凝胶所具有的类软组织黏弹性为细胞的生长提供了良好的环境。近年来,液晶在生物体系中的应用得到越来越多的关注,其分子通过非共价键相互作用自发形成的有序排列和周期性结构为生物科学的研究提供了理论基础,亦为组织工程材料设计提供重要的策略。本研究选用具有有序结构的液晶BPC/OPC构建CS/LC 复合水凝胶体系,其中均匀分布于CS 基体中的液晶畴形成流动性的表面,类似于生物膜的特性,从而促进了细胞与材料表面的相互作用。因此,同时具备类软组织黏弹性及液晶有序性和流动性特征的CS/LC 复合水凝胶,有望成为活性生物材料在组织工程中作为活细胞界面。
本研究构建的具有仿生结构的CS/LC 复合水凝胶,当LC 复合到CS 基体中,LC 自发形成液晶畴并均匀分布于具有三维网状结构的水凝胶中,复合水凝胶体系主要呈现非晶态。LC 含量较低时,LC 在CS 基质中形成物理交联点;随着LC 含量的增多,液晶畴逐渐增大且在CS 基质中形成岛状分布,与CS共同构成类生物膜的“流体镶嵌模型”。当CS 与LC比例达到1∶1 时,LC 畴向外伸展彼此相连,但LC 畴尺寸仍保持在4 ~10 μm 范围内。细胞相容性研究表明,3T3 细胞在CS/LC 复合基质表面呈现良好的黏附和增殖。培养3 d 和6 d 后,细胞完全覆盖复合水凝胶表面并分泌大量的ECM,说明CS/LC 复合水凝胶体系中CS 与LC 产生协同效应从而大大促进细胞的生长。
本研究制备的CS/LC 复合水凝胶集类软组织黏弹性及液晶有序性和流动性的特征于一体,有效增进细胞与复合水凝胶界面间的相互作用。此类CS/LC 复合水凝胶仿生材料有望作为活性生物材料在组织工程中得到广泛应用。
[1] Rahmany MB,Van Dyke M. Biomimetic approaches to modulate cellular adhesion in biomaterials:a review[J].Acta Biomater,2013,9(3):5431-5437.
[2] Bott K,Upton Z,Schrobback K,et al. The effect of matrix characteristics on fibroblast proliferation in 3D gels[J]. Biomaterials,2010,31(32):8454-8464.
[3] Fedorovich NE,Alblas J,de Wijn JR,et al. Hydrogels as extracellular matrices for skeletal tissue engineering:stateof-the-art and novel application in organ printing[J]. Tissue Eng,2007,13(8):1905-1925.
[4] Han W,Tu M,Zeng R,et al. Preparation,characterization and cytocompatibility of polyurethane/cellulose based liquid crystal composite membranes [J]. Carbohydr Polym,2012,90(3):1353-1361.
[5] Liu Z,Wang H,Wang Y,et al. The influence of chitosan hydrogel on stem cell engraftment,survival and homing in the ischemic myocardial microenvironment[J]. Biomaterials,2012,33(11):3093-3106.
[6] Zhang L,Li K,Xiao W,et al. Preparation of collagenchondroitin sulfate-hyaluronic acid hybrid hydrogel scaffolds and cell compatibility in vitro [J]. Carbohydr Polym,2011,84(1):118-125.
[7] Tu M,Han W,Zeng R,et al. A study of surface morphology and phase separation of polymer/cellulose liquid crystal composite membranes [J]. Colloids Surfaces A Physicochem Eng Aspects,2012,407(5):126-132.
[8] 龚 磊.羟丙基纤维素酯类液晶的合成及聚合物复合膜的细胞相容性研究[D].广州:暨南大学,2011.
[9] Nagahama K,Ueda Y,Ouchi T,et al. Exhibition of soft and tenacious characteristics based on liquid crystal formation by introduction of cholesterol groups on biodegradable lactide copolymer [J]. Biomacromolecules,2007,8(12):3938-3943.
[10]Zeng X,Li S. Multiscale modeling and simulation of soft adhesion and contact of stem cells[J]. J Mech Behav Biomed Mater,2011,4(2):180-189.
[11] Rey AD. Mechanics of soft-solid-liquid-crystal interfaces[J]. Phys Rev E Stat Nonlin Matter Phys,2005,72(1):011706.
[12]Hwang JJ,Iyer SN,Li LS,et al. Self-assembling biomaterials:Liquid crystal phases of cholesteryl oligo(L-lactic acid)and their interactions with cells [J]. Proc Natl Acad Sci U S A,2002,99(15):9662-9667.
[13]Miyata T. Preparation of smart soft materials using molecular complexes[J]. Polymer J,2010,42(4):277-289.
