Neuregulin-1β 对压力超负荷心肌肥大大鼠治疗作用及机制的研究
2013-12-23刘延峰刘小娟惠起源
刘延峰, 刘小娟, 惠起源△
(1延安大学医学院,2延安市卫生学校,陕西 延安716000)
心肌肥大(myocardial hypertrophy)是心肌细胞对持续负荷增加的一种适应性反应。高血压性心肌肥大是充血性心力衰竭重要的诱因及独立危险因子,初期具有一定的代偿意义,但在体循环高负荷长期存在时,心肌会发生失代偿,最终可导致心力衰竭。神经调节蛋白1β(neuregulin-1β,NRG-1β)是一种调节和保护性生长因子,因其首先在神经科学领域发现而得名。在成年心脏中,NRG-1β 特异性地在心肌内皮细胞中表达,心肌细胞并不表达NRG-1β;而其受体ErbB2 在心肌细胞中却有表达[1-2]。因此,靠近心肌细胞的内皮细胞合成并释放NRG-1β,通过旁分泌作用于心肌细胞中的受体。近年来的研究发现,NRG-1β/ErbBs 信号系统不仅参与心肌细胞和心脏胚胎发育的分化调控,与成体心脏功能、心衰的发生、发展乃致预后等病理过程也密切相关。本研究以腹主动脉缩窄导致压力超负荷心肌肥大大鼠为对象,通过外源性给予NRG-1β,观察NRG-1β 对压力超负荷心肌肥大大鼠心肌AngII 和TNF-α 表达的影响,以及NRG-1β 对bcl-2 和bax 表达水平的影响,探讨在体条件下NRG-1β 对压力超负荷心肌肥大大鼠的治疗作用及相关机制。
材 料 和 方 法
1 动物
雄性Wistar 大鼠48 只,体重220 ~280 g,由西安交通大学医学院实验动物中心提供。
2 材料
NRG-1β 购于以色列的Prospec-Tany Techno-Gene Ltd。ErbB2 受体拮抗剂赫赛汀(herceptin,HERCE)购自武汉日升科技发展有限公司。
3 方法
3.1 压力超负荷大鼠模型的建立 成年健康雄性Wistar 大鼠,体重为220 ~280 g,随机分为4 组,每组12 只。(1)腹主动脉缩窄(model)组:戊巴比妥钠(15 mg/kg)腹腔注射麻醉后,于左肾动脉上方小心分离约3 mm 长的腹主动脉,套以内径为0.8 mm 银夹缩窄腹主动脉,术后常规饲养。(2)假手术(sham)组:除不以银夹缩窄腹主动脉外,其余操作同腹主动脉缩窄组。(3)NRG-1β 干预组:腹主动脉缩窄术后8 周给予NRG-1β 尾静脉注射,10 μg·kg-1·d-1,共7 d。(4)NRG-1β +HERCE 干预组:大鼠除相同方法注射NRG-1β 外,尾静脉注射ErbB2 受体拮抗剂HERCE 10 μg·kg-1·d-1,共7 d。假手术组和腹主动脉缩窄组给予同等剂量的生理盐水,尾静脉注射,共7 d。给药期间常规饲养。给药结束后,测量各组动物体重及血压,并进行相应指标的测定。
3.2 超声心动图( echocardiography) 测定 戊巴比妥钠腹腔内注射麻醉,用HP Sonos 2500 型多功能超声检查仪及7.5 MHz 相控阵探头(美国惠普公司)检测左室收缩末内径(left ventricular end-systolic diameter,LVESD)、舒张末内径(left ventricular end-diastolic diameter,LVEDD)等指标并计算出左室射血分数(left ventricular ejection fraction,LVEF)和短轴缩短率(left ventricular fractional shortening,LVFS)。
3.3 血流动力学检测 麻醉同上,分离右侧颈动脉,将导管插入颈动脉送至主动脉,然后进一步将导管送入左心室。导管通过压力传感器与泰盟BL-420F 多导生理监护仪连接,记录左室收缩末压(left ventricular end-systolic pressure,LVESP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)及左室内压最大上升、下降速率(maximal rate of increase/decrease in left ventricular pressure,± dp/dtmax)等指标。
3.4 心肌肥大指数的测定 各组动物摘取心脏。测量全心重、左心室重(包括左心室游离壁和室间膈),计算心室重与体重比值(V/Bwt,Hermann Wilson’s 公式)作为心肌肥大指数。
3.5 左心室肌组织血管紧张素II(angiotensin II,Ang II)含量测定 取左心室肌组织约500 mg,剪碎,加入3 mL 0.1 mol/L 醋酸置于玻璃匀浆器制备组织匀浆,上述操作均在冰浴中进行。心肌匀浆10 000 ×g 离心20 min,上清液以放射免疫法(放射免疫试剂盒由北京北方生物技术研究所提供)测定Ang II 含量。
3.6 左心室肌组织肿瘤坏死因子α ( tumor necrosis factor α,TNF-α) 含量的测定 取左心室肌组织约500 mg,剪碎,加入3 mL 冰冻生理盐水于玻璃匀浆器制备组织匀浆,13 000 ×g 离心10 min。取上清液以酶联免疫吸附法(酶联免疫试剂盒北京北方生物技术研究所提供)测定TNF-α 含量。
3.7 Masson 胶原特殊染色及胶原容积分数( collagen volume fraction,CVF) 的测定 常规石蜡切片脱蜡,采用Masson 染色,逐级乙醇脱水,中性树脂包埋,镜下观察并摄片。采用图像分析系统测量CVF,CVF=胶原面积/总面积,每张切片均随机取3 个视野测量,计算其均值。
3.8 RT-PCR 法测定bcl-2 和bax mRNA 表达的变化 Trizol 法提取心肌组织中的总RNA,测定总RNA纯度,参照反转录试剂盒(Fermentas)说明书,取2 μg总RNA 样本在10 μL 体系中进行逆转录反应。取cDNA 2.5 μL 参照说明书(大连宝生物工程有限公司)在25 μL 体系中扩增。引物序列为:bcl-2 (NM-016787):上游引物5’-CGGGAGATCGTGATGAAGT-3’,下游引物5’-CCACCGAACTCAAAGAAGG-3’;bax(NM-017059):上游引物5’-GCAGGGAGGATGGCTGGGGAGA-3’,下游引物5’-TCCAGACAAGCAGCCGCTCACG-3’;GAPDH(NM-017008):上游引物5’-GTGCTGAGTATGTCGTGGAG-3’,下游引 物5’-GTCTTCTGAGTGGCAGTGAT-3’。以上引物由北京奥科生物公司提供。反应条件为:95 ℃30 s、55℃30 s、72 ℃1 min,共循环35 次,72 ℃8 min。PCR产物最好于24 h 内进行电泳。1.5%琼脂糖凝胶电泳,电泳后将凝胶置于凝胶成像系统中成像并计算条带中荧光的强度。基因的表达程度由样本中的PCR 产物条带的荧光程度与同一样本中GAPDH 的PCR 产物条带的荧光强度相比较而得出。
4 统计学处理
采用SPSS 13.0 统计软件,计量数据用均数±标准差(mean ± SD)表示,组间比较用单因素方差分析,两两比较用SNK 法。以P <0.05 为差异有统计学意义。
结 果
1 动物模型的建立
各组大鼠实验终点进行血压的测定,sham 组为(116.72 ±6.71)mmHg,model 组为(178.24 ±9.22)mmHg,NRG-1β 组为(133.04 ±12.13)mmHg,NRG-1β+ HERCE 组为(167. 31 ±11. 24)mmHg,其中,model 组血压较sham 组明显升高(P <0.01);V/Bwt的测定中,model 组(2.89 ±0.34)较sham 组(2.04 ±0.07)明显升高(P <0.01),以上结果说明造模成功。NRG-1β 组血压及V/Bwt 较model 组显著下降(P <0.01),而NRG-1β + HERCE 的干预逆转了这种改变,使血压维持在高水平。
2 超声心动图指标的比较
与sham 组相比,model 组的LVEF 和LVFS 明显降低(P <0.01),而LVEDD 和LVESD 明显增大(P <0.01);与model 组相比,NRG-1β 组的LVEF和LVFS 明显升高(P <0.01),LVEDD 和LVESD 明显下降(P <0.01);而NRG-1β + HERCE 组大鼠与sham 组及NRG-1β 组相比,LVEF 和LVFS 降低(P <0.01,P <0.05),LVESD 和LVEDD 增高(P <0.01),与model 组相比无明显变化,见图1。
3 血流动力学指标的比较
与sham 组相比,model 组的±dp/dtmax和LVESP明显降低(P <0.01),LVEDP 明显升高(P <0.01);与model 组相比,NRG-1β 组±dp/dtmax和LVESP 明显升高(P <0.01),LVEDP 明显降低(P <0.05);而NRG-1β+HERCE 组与sham 组及NRG-1β 组相比,±dp/dtmax和LVESP 明显降低(P <0.05,P <0.01),LVEDP 明显升高(P <0.05,P <0.01),与model 组无明显差异,见图2。

Figure 1. The values of LVESD,LVEDD,LVEF and LVFS in the four groups. A:the changes of LVESD and LVEDD;B:the changes of LVEF and LVFS.Mean±SD.n=6. **P <0.01 vs sham;##P <0.01 vs model;△P <0.05,△△P <0.01 vs NRG-1β.图1 各组大鼠LVESD、LVEDD、LVEF 和LVFS 的变化
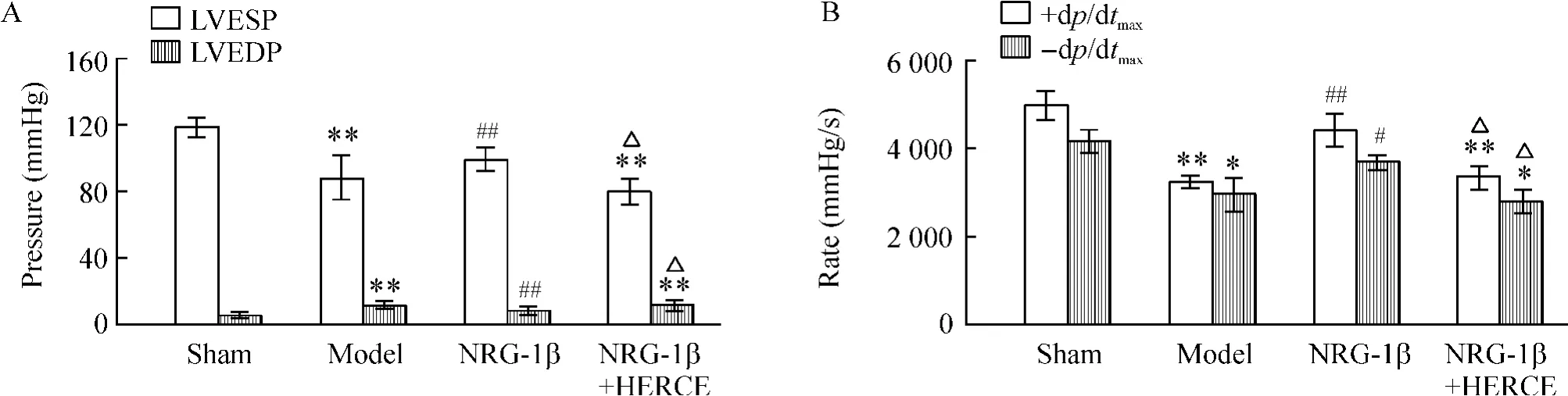
Figure 2. The values of LVESP,LVEDP and ±dp/dtmax in the four groups. A:the changes of LVESP and LVEDP;B:the changes of±dp/dtmax.Mean±SD.n=6. * P <0.05,**P <0.01 vs sham;# P <0.05,##P <0.01 vs model;△P <0.05 vs NRG-1β.图2 各组大鼠LVESP、LVEDP 和±dp/dtmax的变化
4 术后各组心肌Ang II 和TNF-α 的变化
如图3 所示,与sham 组相比,model 组的Ang II和TNF-α 均明显升高(P <0. 01);NRG-1β 组较model 组的Ang II 和TNF-α 均显著降低(P <0.01),而NRG-1β+HERCE 组较sham 组及NRG-1β 组Ang II 和TNF-α 均升高(P <0.01)。
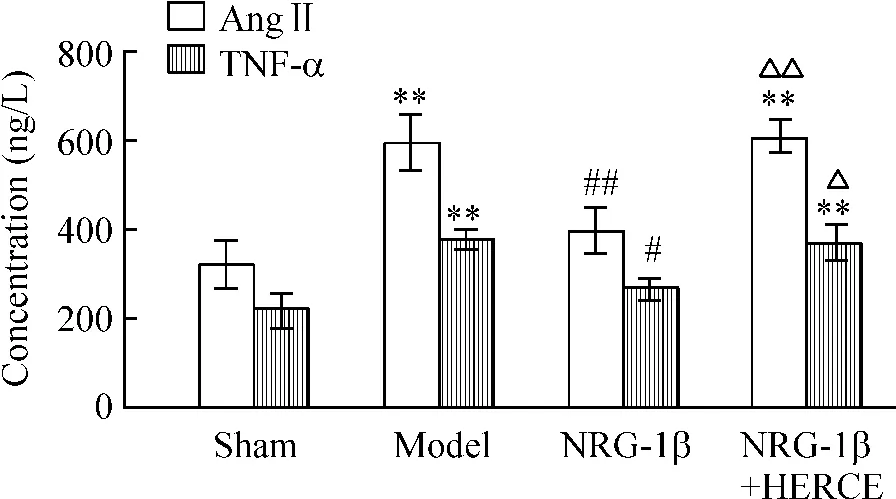
Figure 3. The concentrations of Ang II and TNF-α in myocardium in the four groups. Mean ±SD. n =6. **P <0.01 vs sham;#P <0.05,##P <0.01 vs model;△P <0.05,△△P <0.01 vs NRG-1β.图3 各组大鼠心肌Ang II 和TNF-α 的变化
5 心肌组织胶原含量及心肌胶原容积分数的变化
光镜下胶原纤维呈蓝色,心肌细胞胞质呈红色。正常大鼠心肌血管周围、细胞之间有少量的胶原纤维存在,形似蜂窝。Model 组心肌胶原纤维含量较sham 组明显增加(P <0.01),分布弥散,排列紊乱。NRG-1β 组CVF 较model 组显著下降(P <0.01),而NRG-1β+HERCE 组CVF 较sham 组及NRG-1β 组均升高(P <0.01,P <0.05 ),见图4。
6 各组bcl-2 和bax mRNA 表达的变化
如图5 所示,与sham 组相比,model 组大鼠心肌中bcl-2 mRNA 表达明显下降(P <0.01),而bax mRNA表达增高(P <0.01);NRG-1β 组较model 组的Bcl-2 mRNA 表达显著升高(P <0.01),而Bax mRNA 表达下降(P <0.01);NRG-1β +HERCE 组与sham 组及NRG-1β 组比较,大鼠心肌中Bcl-2 mRNA 表达显著下降(P <0.05),Bax mRNA 表达增高(P <0.01)。
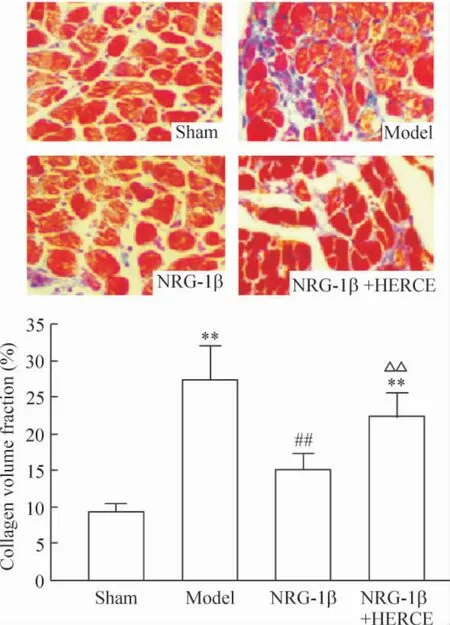
Figure 4. Fibrotic infiltration in myocardium (Masson’s trichrome staining,× 400). Red color shows cardiac myocytes and blue color shows collagen.Mean±SD.n=6. **P <0.01 vs sham;##P <0.01 vs model;△△P<0.01 vs NRG-1β.图4 Masson 染色法测定心肌胶原含量
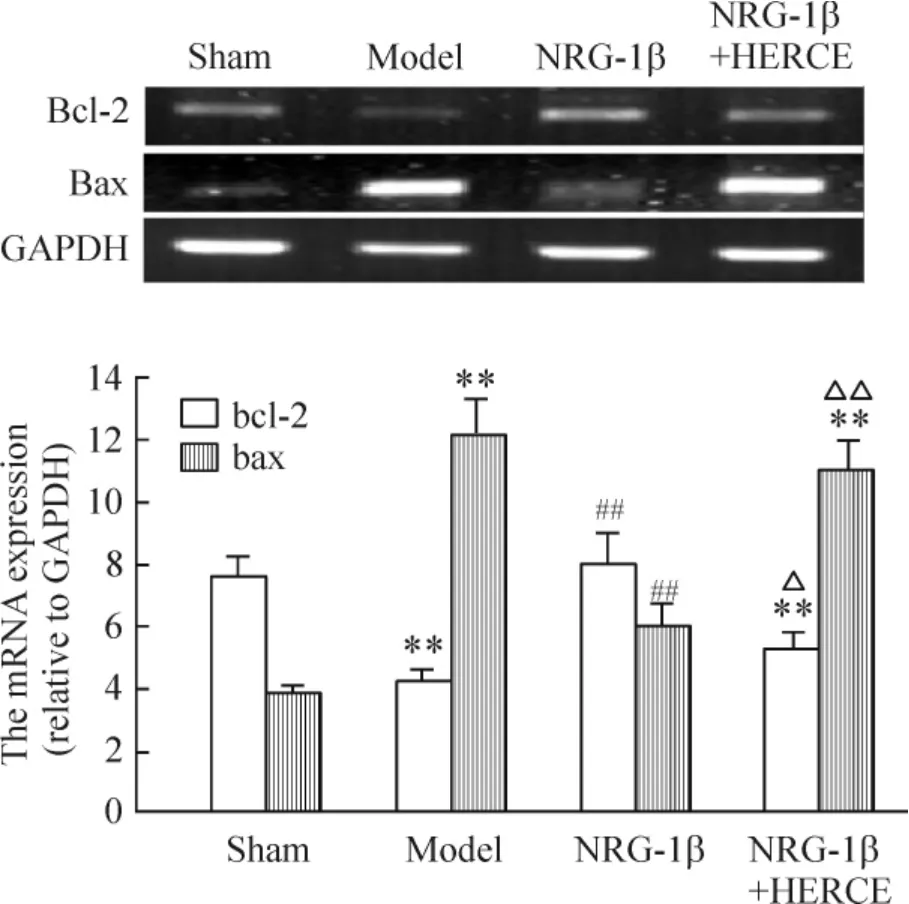
Figure 5. Expression of bal-2 and bax mRNA in myocardium detected by RT-PCR. Mean ±SD. n =6. **P <0.01 vs sham;##P <0.01 vs model;△P <0.05;△△P <0.01 vs NRG-1β.图5 RT-PCR 法检测心肌组织中Bal-2 和Bax mRNA 的表达水平
讨 论
心肌肥大是多种心血管疾病发展到一定阶段的病理过程[4]。心肌肥大的早期因心室壁增厚,心肌收缩功能改善而被视为代偿性过程。但是,在持久病理性应激情况下,心肌肥大伴随着间质纤维化、收缩功能失调以及基因表达、能量代谢和电生理特征的异常,最终导致了失代偿性的心功能衰竭。多种因素可刺激心肌肥大的产生,如容量及压力负荷的加大、氧化应激、机械牵拉及炎症等[3]。本研究通过腹主动脉缩窄术制备大鼠压力超负荷性心肌肥大模型,探讨NRG-1β 对持续压力超负荷所致心肌肥大的治疗作用及机制。
NRG-1 由1 400 kb 的基因编码,其通过几种启动子和选择性剪切能表达出3 种不同的NRG-1 蛋白亚型[5],其中Ⅰ型是心脏中最重要的类型。研究发现[6],在糖尿病心肌病中,NRG-1β 表达显著下调,参与了糖尿病心肌病的发生和发展。另外,NRG-1β 能降低糖尿病大鼠心肌间质纤维化及细胞凋亡,这些作用与其上调Bcl-2、下调Bax 和caspase-3 表达有关[7]。NRG-1 通过ErbB2、ErbB3 和ErbB4 这3 种受体在心脏发育过程中起作用。大量研究表明,NRG-1β/ ErbBs 信号系统在很多方面起着重要的调节作用,如促进培养新生大鼠心肌细胞肌节结构的正常化,通过细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)在心肌肥大中调节肌小节的合成和排列[8]。NRG-1β 基因条件性敲除小鼠表现为扩张型心肌病[9],而ErbB2 基因敲除小鼠也表现为心室壁变薄、心室腔扩张、收缩力下降等扩张型心肌病的病理变化[10]。研究显示[11]用阿霉素诱导培养的成年大鼠心肌细胞,细胞肌丝排列紊乱,用NRG-1(10 μg/L)孵育后,排列紊乱显著减轻,研究证明是由于激活了成年大鼠心肌细胞的ErbB2受体。因此,NRG-1β/ErbBs 信号系统成为心血管疾病的一个重要的潜在治疗靶点。
本实验采用腹主动脉缩窄法制备压力超负荷大鼠心肌肥大模型。与假手术组相比,模型组的血压、LVEDD 和LVESD 明显增大,LVEF 和LVFS 明显降低,提示模型制备成功。外源性给予NRG-1β 治疗后,大鼠的血压、LVEDD 和LVESD 明显减小,LVEF和LVFS 明显升高。 ±dp/dtmax是反映左室收缩、舒张功能的主要指标,本研究中,NRG-1β 组的±dp/dtmax较模型组明显升高,LVEDP 降低,表明NRG-1β静脉注射能改善心脏功能。采用Masson 法观察大鼠心肌胶原的变化,模型组CVF 明显升高,而NRG-1β 的干预逆转了这一变化。以上结果提示,应用NRG-1β 后,血流动力学得到了改善,心肌胶原分泌减少,进而提高了整体心肌肥大大鼠的心功能。作为NRG-1β 受体ErbB2 的阻断剂,HERCE 在本实验中被用于进一步观察NRG-1β 的作用,结果显示,HERCE 干预后,NRG-1β 改善心肌功能的作用消失,以上各指标与模型组相比均无明显变化。提示,NRG-1β 通过它的受体ErbB2 在心肌肥大中发挥着重要作用。
NRG-1β 的合成与表达受许多神经-体液因素影响。对NRG-1β 处理的成年大鼠心室肌细胞的研究发现,NRG-1β 能通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B (protein kinase B,Akt)通路,激活内皮一氧化氮合酶(endothelialnitric oxide synthase,eNOS),增加一氧化氮(nitric oxide,NO)的产生,激活蛋白激酶G(protein kinase G,PKG),促使受磷蛋白磷酸化,提高肌浆网钙泵的活性,增强舒张期肌浆网钙的回摄,从而改善心肌收缩和舒张功能[12]。在糖尿病心肌病中,NRG-1β表达显著下调,同时心脏内皮素-1 的表达、氧化应激及活性氧产物增加[13],这些因素可提高内皮细胞NRG-1 的表达[14]。另外,高糖引起的去甲肾上腺素和Ang II 分泌增多,又可抑制NRG-1β 的表达。在慢性心衰进展的不同阶段,AngII 和肾上腺素的改变也可导致心脏NRG-1β/ErbBs 系统发生不同变化。这些证据表明,NRG-1β 的作用与体内的众多体液因素的调节有关。心肌肥大的具体机制虽未明确,但细胞因子的增多及炎症细胞的浸润在心肌肥大中的作用已确立,其中Ang II 及其相关的多条信号通路发挥着关键作用。研究显示,心肌内源性TNF-α 在慢性压力超负荷性心肌肥大的发生发展中起着重要的调控作用,而肾素-血管紧张素系统激活是心肌中TNF-α 表达上调的重要调控因素。本实验结果显示,与假手术组相比,模型组的Ang II 及TNF-α 明显增高,NRG-1β 抑制了这一反应,而HERCE 的使用逆转了NRG-1β 的抑制作用,提示NRG-1β 与其受体相互作用,可降低压力超负荷大鼠心肌中Ang II 及TNF-α 的过表达,进而减轻由Ang II 及TNF-α 诱导的心肌间质重构,从而在心肌肥大过程中发挥改善心肌功能的作用。
NRG-1 可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/ERK、PI3K/Akt、Src/黏着斑激酶(focal adhesion kinase,FAK)、NO 合酶(NO synthase)等多种信号通路发挥作用,参与细胞分化、增殖与凋亡调节[15-16]。于水等[8]用硫化氢处理缺血/再灌注离体心脏,能明显减轻心肌收缩和舒张功能障碍,而PI3K/Akt 信号通路参与了硫化氢处理的心肌保护。有报道提出,Akt 诱导的Bcl-2 家族表达变化可能参与NRG-1β 的心肌保护机制。本研究证实,NRG-1β 可增加心肌肥大组Bcl-2 的表达,而Bax 的表达降低。Bcl-2 位于线粒体膜,可促进细胞生存,抑制细胞凋亡。进而改善肥大心肌的心功能。
综上所述,本研究结果提示,NRG-1β/ErbBs 信号系统在压力超负荷型心肌肥大中发挥着重要作用,外源性给予NRG-1β 能降低压力超负荷心肌肥大大鼠心肌中Ang II 及TNF-α 的过表达,进而减轻了由Ang II 及TNF-α 介导的心肌重构;NRG-1β 诱导肥大心肌bcl-2 mRNA 的表达增加,bax mRNA 的表达减少,从而抑制心肌细胞凋亡,减轻纤维化,改善心肌功能。这为心肌肥大的治疗提供了新的思路。
[1] Cote GM,Miller TA,LeBrasseur NK,et al. Neuregulin-1α and β isoform expression in cardiac microvascular endothelial cells and function in cardiac myocytes in vitro[J].Exp Cell Res,2005,311(1):135-146.
[2] Lemmens K,Segers VF,Demolder M,et al.Role of neuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk[J]. J Biol Chem,2006,281(28):19469-19477.
[3] 姜志胜. 心肌肥大过程中的信号转导[J]. 中国动脉硬化杂志,2005,13(2):125-128.
[4] 周四桂,王 平,路 遥,等.短链酰基辅酶A 脱氢酶在大鼠生理性和病理性心肌肥大中的作用[J]. 中国病理生理杂志,2012,28(11):1921-1927.
[5] Falls DL. Neuregulins:functions,forms,and signaling strategies[J]. Exp Cell Res,2003,284(1):14-30.
[6] 龙启成,桂 春,朱立光,等. Neuregulin-1 在糖尿病大鼠心肌组织中的表达变化[J]. 中国病理生理杂志,2012,28(1):1-5.
[7] 黄 鑫,李宾公,郑泽琪,等.神经调节蛋白-1 对糖尿病心肌病大鼠心肌重构的影响[J]. 中国药理学通报,2011,27(11):1548-1552.
[8] 于 水,杨海扣,米 琰,等.信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J]. 中国药理学通报,2010,26(6):759-764.
[9] Liu FF,Stone JR,Schuldt AJ,et al.Heterozygous knockout of neuregulin-1 gene in mice exacerbates doxorubicininduced heart failure[J]. Am J Physiol Heart Circ Physiol,2005,289(2):H660-H666.
[10] Negro A,Brar BK,Lee KF. Essential roles of Her2/erbB2 in cardiac development and function[J]. Recent Prog Horm Res,2004,59(1):1-12.
[11]Sawyer DB,Zuppinger C,Miller TA,et al.Modulation of anthracycline-induced myofibrillar disarray in rat ventricular myocytes by neuregulin-1 β and anti-erbB2:potential mechanism for trastuzumab-induced cardiotoxicity [J].Circulation,2002,105(13):1551-1554.
[12]Brero A,Ramella R,Fitou A,et al.Neuregulin-1β1 rapidly modulates nitric oxide synthesis and calcium handling in rat cardiomyocytes [J]. Cardiovasc Res,2010,88(3):443-452.
[13] Widyantoro B,Emoto N,Nakayama K,et al. Endothelial cell-derived endothelin-1 promotes cardiac fibrosis in diabetic hearts through stimulation of endothelial-to-mesenchymal transition[J]. Circulation,2010,121(22):2407-2418.
[14]Kuramochi Y,Cote GM,Guo X,et al. Cardiac endothelial cells regulate reactive oxygen species-induced cardiomyocyte apoptosis through neuregulin-1β/erbB4 signaling[J]. J Biol Chem,2004,279(49):51141-51147.
[15] Kuvamochi YK,Guo XX,Sawyer DB. Neuregulin activates erbB2-dependent Src/FAK signaling and cytoskeletal remodeling in isolated adult rat cardiac myocytes[J]. J Mol Cell Cardiol,2006,41(2):228-235.
[16]Calvo M,Zhu N,Grist J,et al. Following nerve injury neuregulin-1 drives microglial proliferation and neuropathic pain via the MEK/ERK pathway[J]. Glia,2011,59(4):554-568.
