干扰素诱导蛋白16 对人脑血管外膜成纤维细胞增殖与迁移的影响及其机制*
2013-12-23龙向淑
黄 晶, 宋 方, 龙向淑, 吴 强
(贵州省人民医院心内科,贵州 贵阳550002)
血管重构是冠状动脉介入治疗术后再狭窄和高血压等血管增殖性疾病的主要病理生理机制。既往认为血管外膜成纤维细胞(vascular adventitial fibroblasts,VAFs)在血管重构过程中作为“旁观者”,仅仅起着支持与营养的作用。但近年来,越来越多的研究证明VAFs 的增殖、迁移与分泌细胞外基质等在血管重构过程中起着重要的作用[1]。将VAFs 作为治疗靶点,有效地抑制其增殖、迁移对防治血管增殖性疾病有重要意义。干扰素诱导蛋白16(interferon-inducible protein 16,IFI16)是干扰素(interferon,IFN)诱导蛋白p200 家族的人源蛋白成员之一,具有抑制细胞增殖与促进细胞凋亡的作用[2]。有研究[3]发现,IFI16 蛋白可通过p53/p21 通路抑制脐静脉内皮细胞增殖,但IFI16 对VAF 增殖、迁移等生物学功能的影响尚未见报道。本研究旨在诱导VAFs 上IFI16过表达和沉默其表达,观察IFI16 对VAFs 增殖与迁移的影响,并探讨其可能机制,为将IFI16 运用于治疗血管增殖性疾病提供更多的理论依据。
材 料 和 方 法
1 材料
人脑血管外膜成纤维细胞(human brain vascular adventitial fibroblasts,HBVAFs)细胞株购自Scien-Cell;DMEM 高糖培养基和胎牛血清购自HyClone;p53 抗体和p21 抗体购自Epitomics;IFI16 抗体、βactin 抗体、IFI16 siRNA(h)、control siRNA-A、control siRNA(FITC-conjugated)-A、siRNA transfection medium 和siRNA transfection reagent 购自Santa Cruz;IFNα 购自北京三元基因工程有限公司;细胞周期与凋亡检测试剂盒和SDS-PAGE 凝胶试剂盒购自碧云天公司;逆转录试剂盒购自Fermentas;real-time PCR 荧光染料试剂盒购自TakaRa;Transwell 小室购自Corning;PCR 扩增引物购自上海生工生物工程公司,见表1。

表1 引物序列Table 1. The sequences of primers
2 方法
2.1 HBVAFs 的培养 从液氮罐中取出细胞冻存管复苏细胞。取复苏后第3 ~4 代生长状态良好的细胞用于实验。
2.2 实验分组 实验分为6 组,即空白组、control siRNA 组和IFI16 siRNA 组,用2 ×106U/L IFN-α 分别处理各组24 h 后,即获IFN-α +空白组、IFN-α +control siRNA 组和IFN-α+ IFI16 siRNA 组。
2.3 Real-time PCR 检测mRNA 表达 取对数生长期细胞,按Trizol 法提取总RNA,按照RT-PCR 试剂盒说明书操作,逆转录条件:42 ℃60 min,70 ℃5 min。然后再按照荧光PCR 试剂盒说明书进行PCR 扩增。Real-time PCR 采用StepOnePlusTM系统(ABI),反应条件:95 ℃30 s 预变性,95 ℃5 s,60 ℃34 s,重复循环40 次,熔解曲线分析95 ℃15 s,60 ℃1 min,95 ℃15 s。以β-actin 为内参照,2-ΔΔCt法计算各组IFI16、p53和p21 mRNA 的相对表达量。
2.4 Western blotting 检测蛋白表达 按细胞裂解液(RIPA)说明书提取细胞蛋白。用BCA 蛋白定量试剂盒进行蛋白定量。加入SDS-PAGE 蛋白上样缓冲液,置沸水煮5 min 变性蛋白质;电泳(IFI16 使用10%分离胶,p53 和p21 使用12%分离胶),电压80 V,进入浓缩胶后改为120 V。湿电转膜,电流200 mA,转膜时间1 h;5%脱脂奶粉室温封闭1 h;TBST洗膜3 次,每次10 min;Ⅰ抗4 ℃(IFI16 抗体、p53 抗体、p21 抗体和β-actin 抗体稀释度分别为:1 ∶500、1∶1 000、1∶1 000 和1∶5 000)过夜孵育;TBST 洗膜3次,每次10 min ;37 ℃孵育Ⅱ抗1 h;TBST 洗膜3次,每次10 min;加入ECL 反应,印迹。用扫描仪扫描曝光胶片,BandScan 4. 3 软件进行总灰度分析。以β-actin 为内参照,分析各组IFI16、p53 和p21 蛋白的相对含量。
2.5 流式细胞仪检测细胞周期 按细胞周期与凋亡检测试剂盒说明书操作进行细胞收集、染色后通过流式细胞仪进行DNA 含量分析。
2.6 细胞划线法观察细胞迁移 在12 孔板背后均匀画出3 条横穿过孔的线条,待孔内空白组、control siRNA 组和IFI16 siRNA 组细胞汇合度达90%以上后用划线工具垂直于孔背面横线划痕。弃去孔内液体,并用PBS 液清洗2 遍。在另外上述3 组各孔内加入含2 ×106U/L IFN-α 的5%血清DMEM 培养基1 mL。显微镜下拍照后放入37 ℃、5% CO2培养箱。24 h 后取样,拍照。计算迁移距离,迁移距离=划痕0 h 后划痕宽度- 划痕24 h 后划痕宽度,以像素(pixel)作为长度单位。
2.7 Transwell 小室定量迁移细胞 取空白组、control siRNA 组和IFI16 siRNA 组对数生长期的细胞,消化细胞计数后,用含0.1 %胎牛血清DMEM 培养基重悬细胞至1 ×108/L。每个小室(上室)中加入100 μL 上述细胞悬液,在24 孔板内(下室)加入含10 %胎牛血清的DMEM 培养基800 μL,在另外的上述3 组上、下室内加入IFN-α,使之终浓度分别为2 ×106U/L。将24 孔板置于37 ℃、5% CO2培养箱内培养24 h 后,弃孔内培养液,上室用PBS 液洗涤3 遍后,将小室置于4%多聚甲醛中固定20 min,后将其置于超净台中自然晾干。将小室置于0.1%结晶紫中染色20 min,再用PBS 液洗涤3 遍。晾干后,显微镜下随机选取4 个视野,观察细胞,并计数。
3 统计学处理
数据用均数±标准差(mean ±SD)表示,结果用SPSS 11.5 统计软件进行单因素方差分析。以P <0.05 为差异有统计学意义。
结 果
1 各组IFI16、p53 和p21 表达的变化
IFI16 siRNA 组中IFI16、p53 和p21 蛋白及mRNA 水平低于空白组(P <0. 05),空白组与control siRNA 组间差异无统计学意义。在IFN-α 处理后,IFN-α+空白组、IFN-α +control siRNA 组和IFN-α +IFI16 siRNA 组中IFI16、p53 和p21 蛋白及mRNA 水平均高于空白组(P <0.05)。IFN-α +IFI16 siRNA组中IFI16、p53、p21 蛋白及mRNA 水平低于IFN-α+空白组(P <0.05),IFN-α+空白组与IFN-α +control siRNA 组间IFI16、p53 和p21 差异无统计学意义,见图1、表2。

Figure 1. Effects of IFI16 siRNA and IFN-α on the expression of IFI16,p53 and p21 proteins in HBVAFs.图1 干预后IFI16、p53 及p21 蛋白在HBVAFs 中的表达情况

表2 干预后HBVAFs 中IFI16、p53 及p21 mRNA 表达情况Table 2. Effects of IFI16 siRNA and IFN-α on the expression of IFI16,p53 and p21 mRNA in HBVAFs (mean±SD.n=3)
2 各组细胞周期情况比较
IFI16 siRNA 组G0/G1期细胞低于空白组(P <0.05),S 期细胞则高于后者(P <0.05),空白组与control siRNA 组间差异无统计学意义。在IFN-α 处理后,IFN-α + 空白组、IFN-α + control siRNA 组和IFN-α+IFI16 siRNA 组中G0/G1期细胞高于空白组(P <0.05),S 期细胞则低于后者(P <0.05)。IFN-α+ IFI16 siRNA 组中G0/G1期细胞低于IFN-α +空白组(P <0.05),S 期细胞则高于后者(P <0.05),IFN-α+空白组与IFN-α+control siRNA 组间差异无统计学意义,见图2、表3。
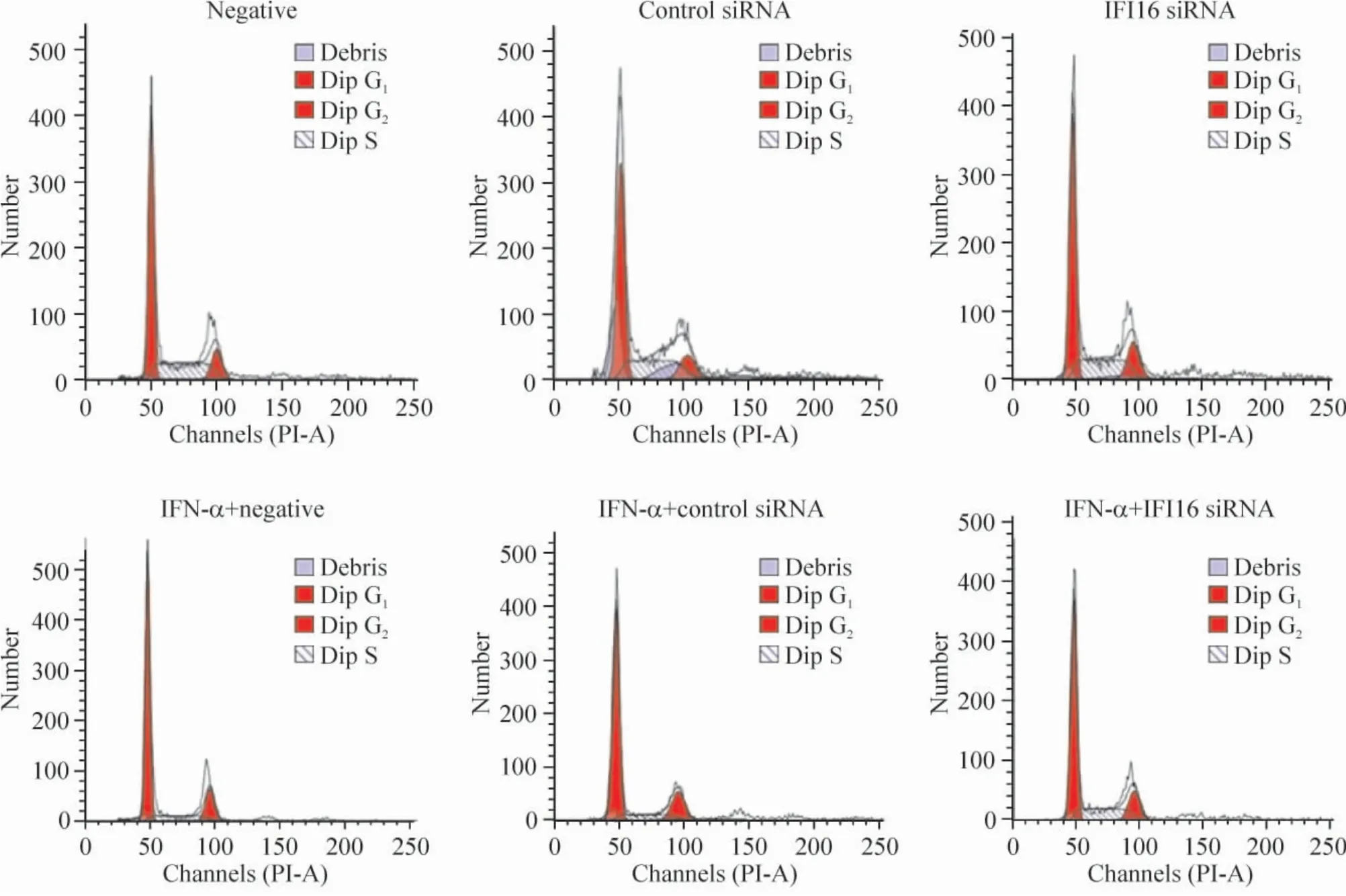
Figure 2. Effects of IFI16 siRNA and IFN-α on cell cycle of HBVAFs.图2 IFI16 siRNA 和IFN-α 对HBVAFs 细胞周期的影响
3 各组细胞迁移情况比较
IFI16 siRNA 组、空白组与control siRNA 组之间在细胞迁移数量与迁移范围上差异无统计学意义。在IFN-α 处理后,IFN-α + 空白组、IFN-α + control siRNA 组和IFN-α+IFI16 siRNA 组细胞迁移数量与范围均低于空白组(P <0.05)。IFN-α + IFI16 siRNA 组细胞迁移数量与范围高于IFN-α +空白组(P<0.05),IFN-α + 空白组与IFN-α + control siRNA组间差异无统计学意义,见图3、4、表3。

Figure 3. Effect of IFI16 siRNA on migration capability of HBVAFs.图3 转染IFI16 siRNA 后对HBVAFs 迁移的影响
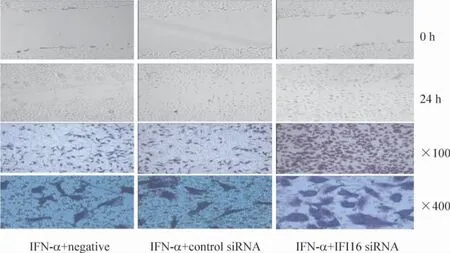
Figure 4. Effects of IFN-α and IFI16 siRNA on migration capability of HBVAFs.图4 转染IFI16 siRNA 并加用IFN-α 处理对HBVAFs 迁移的影响
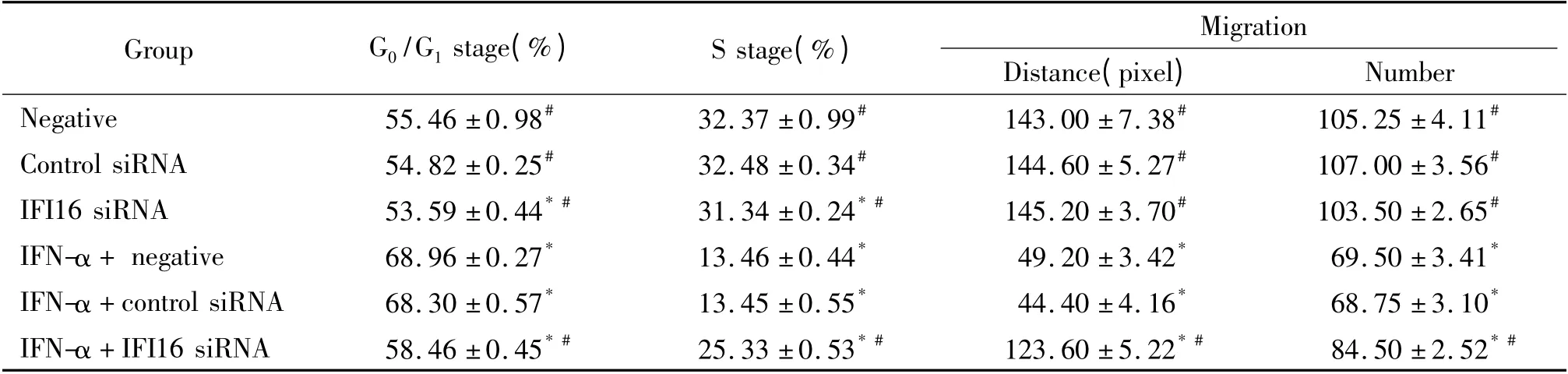
表3 IFI16 siRNA 和IFN-α 对HBVAFs 细胞周期与迁移的影响Table 3. Effects of IFI16 siRNA and IFN-α on cell cycle and migration of HBVAFs(mean±SD. n=3)
讨 论
在血管重构过程中,VAFs 被激活,其增殖、分泌细胞因子及合成细胞外基质能力明显增加;并表达α-平滑肌肌动蛋白,转化为肌成纤维细胞,其中部分肌成纤维细胞迁移至内膜分泌细胞外基质,导致了晚期胶原纤维化,从而引起管腔狭窄[1]。由于VAFs在血管重构过程中起着至关重要的作用已经被视为血管增殖性疾病防治研究的重点之一。
IFN 是一组具有抗病毒、抗增殖、调节免疫应答等多种生物学效应的活性细胞因子家族[4-5]。研究[6-7]表明,局部转染IFN-β 基因和肠外给予IFN-γ能抑制动脉球囊损伤后血管平滑肌细胞增殖和血管新生内膜形成,提示将IFN 应用于血管增殖性疾病的治疗是可行的。然而IFN 的多种生物学效应与一系列被称为干扰素诱导蛋白的蛋白有密切关系[4-5]。
IFI16 属于IFN 诱导蛋白p200 家族的人源蛋白成员,其编码基因位于人染色体1q21 ~23[8]。IFI16蛋白在人体多种器官组织如肝、子宫、泌尿生殖道、乳腺导管、皮肤的上皮细胞、淋巴细胞、单核细胞、中性粒细胞等有表达[9-10]。本研究发现,IFI16 在HBVAFs 也存在基础表达,并能被IFN-α 诱导表达。前人通过体外实验[2-3]发现增加IFI16 的表达能抑制细胞的增殖与迁移。而且将稳定转染IFI16 基因的HNO163 头颈部鳞状细胞癌细胞与不表达IFI16 的HNO163 细胞分别注射于出生7 周的裸鼠,发现HNO163-IFI16 组形成的肿瘤明显小于对照组,肿瘤内新生血管的合成也减少了[2]。本研究也发现单纯下调IFI16 的表达虽然对HBVAF 迁移无明显影响但能促进细胞G1/S 期转换。而当IFN-α 诱导IFI16 表达增加后,VAF 的增殖指数下降,更多的细胞停滞在G0/G1期,在细胞周期进程受限的同时细胞迁移能力也随之下降;但在成功瞬时转染了IFI16 siRNA 的HBVAFs 中IFN-α 这一作用受到明显限制,推测IFI16 可能是参与IFN-α 抑制VAF 增殖与迁移的机制之一,也进一步证实IFI16 表达具有抑制VAF 增殖与迁移的作用。
抑癌基因p53,能够通过下游基因p21 抑制细胞周期进程,促进细胞凋亡与老化[4,11],研究发现IFI16可通过p53/p21 与Rb/E2F1(同样具有调控细胞周期功能)途径抑制细胞增殖,但当抑制了p53 及Rb的表达及活性后,IFI16 抑制增殖的作用无法实现[3]。并且在前列腺癌细胞LNCaP(具有p53 与Rb功能)与PC-3(具有Rb 功能但无p53 功能)中分别过表达IFI16 蛋白后,细胞增殖抑制率也表现出明显差异:LNCaP(>90%)>PC-3(50%)[8]。亦有实验证实,在IFI16 蛋白氨基端上200A 结构域中MFHATVATIF 基序与p53 羧基端结合后,活化后者bax启动子从而激活p53 表达,增加其下游目的基因p21表达[9],另一个结构域200B 也能与p53 DNA-binding 的核心区域结合,从而起到稳定p53-DNA 复合体的作用[12]。前人的研究表明IFI16 在抑制细胞增殖过程中与p53 和p21 有密切关系。本研究结果显示IFN-α 在诱导IFI16 表达增加的同时p53 与p21 的表达也上调了。而在沉默IFI16 基因后不但可下调HBVAFs 中p53 和p21 基线表达而且也抑制了IFNα 诱导的表达。在VAFs 中IFI16 与p53 和p21 一致的变化趋势表明IFI16 抑制VAFs 增殖与迁移可能与促进p53 和p21 的表达有关。
综上所述,在HBVAFs 中存在IFI16 的表达,后者具有抑制VAFs 增殖和迁移的作用;p53/p21 途径可能参与该生物学效应的下游调控。
[1] Chiang HY,Korshunov VA,Serour A,et al. Fibronectin is an important regulator of flow-induced vascular remodeling[J]. Arterioscler Thromb Vasc Biol,2009,29(7):1074-1079.
[2] Mazibrada J,De Andrea M,Rittà M,et al. In vivo growth inhibition of head and neck squamous cell carcinoma by the interferon-inducible gene IFI16[J]. Cancer Lett,2010,287(1):33-43.
[3] Raffaella R,Gioia D,De Andrea M,et al. The interferon-inducible IFI16 gene inhibits tube morphogenesis and proliferation of primary,but not HPV16 E6/E7-immortalized human endothelial cells[J]. Exp Cell Res,2004,293(2):331-345.
[4] 龙向淑,吴 强,宋 方. 干扰素诱导蛋白p204 表达变化对大鼠血管平滑肌细胞增殖及p21 表达的影响[J].中国病理生理杂志,2012,28(2):249-252.
[5] 龙向淑,吴 强,宋 方. 干扰素诱导蛋白p204 对大鼠血管平滑肌细胞增殖的影响及其机制[J]. 中国病理生理杂志,2012,28(6):1018-1022.
[6] Castronuovo JJ Jr,Guss SB,Mysh D,et al. Cytokine therapy for arterial restenosis:inhibition of neointimal hyperplasia by gamma-interferon[J]. Cardiovasc Surg,1995,3(5):463-468.
[7] Stephan D,San H,Yang ZY,et al.Inhibition of vascular smooth muscle cell proliferation and intimal hyperplasia by gene transfer of β-interferon[J]. Mol Med,1997,3(9):593-599.
[8] Briggs RC,Briggs JA,Ozer J,et al. The human myeloid cell nuclear differentiation antigen gene is one of at least two related interferon-inducible genes located on chromosome 1q that are expressed specifically in hematopoietic cells[J]. Blood,1994,83(8):2153-2162.
[9] Xin H,Curry J,Johnstone RW,et al. Role of IFI 16,a member of the interferon-inducible p200-protein family,in prostate epithelial cellular senescence[J]. Oncogene,2003,22(31):4831-4840.
[10] Fujiuchi N,Aglipay JA ,Ohtsuka T,et al. Requirement of IFI16 for the maximal activation of p53 induced by ionizing radiation[J]. J Biol Chem,2004,279(19):20339-20344.
[11]Vousden KH,Prives C.Blinded by the light:the growing complexity of p53[J].Cell,2009,137(3):413-431.
[12] Liao JC,Lam R,Brazda V,et al. Interferon-inducible protein 16:insight into the interaction with tumor suppressor p53[J].Structure,2011,19(3):418-429.
