麦冬抑制大鼠心肌成纤维细胞胶原合成的作用及其机制*
2013-12-23王国钦李瑞满宋国良裴兆辉
王国钦, 李瑞满, 金 伟, 宋国良, 陈 勤, 裴兆辉△
(南昌市第三医院1中医科,3心内科,江西 南昌330009;2暨南大学附属第一医院妇产科,广东 广州510632)
心肌纤维化过程中,心肌成纤维细胞(cardiac fibroblasts,CFs)异常聚集在心肌间质和血管周围。心肌纤维化可引起心肌结构紊乱,僵硬度增加,心脏顺应性降低,心律失常以及顽固性心衰的发生率增高,它是心血管疾病共同病理生理过程,是心肌缺血、心律失常以致心源性猝死的独立危险因子[1-2]。麦冬(Ophiopogon japonicus)是百合科植物,具有养明清热、润肺止咳的功效。现代医学认为麦冬具有强心、利尿、抗菌等作用。目前麦冬抗肺纤维化作用报道较多,但麦冬抗心肌纤维化的报道较少。本课题观察中药麦冬在大鼠心肌成纤维细胞的影响,并探讨其机制,为心肌纤维化的防治提供理论指导及实验支持。
材 料 和 方 法
1 材料
1.1 动物 出生1 ~3 d 的SD 大鼠,由中山大学中山医学院实验动物中心提供。
1.2 试剂 兔抗大鼠转化生长因子β1(transforming growth factor beta 1,TGF-β1)、p-Smad2/3 和Smad2/3抗体购于Cell Signaling。中药麦冬购于广州中医药大学第一附属医院。
2 方法
2.1 麦冬水提液制备 将麦冬若干株,先用自来水洗净植株地上部分的灰尘及根部的泥土,再用蒸馏水冲洗若干次,在室内自然晾干。将麦冬地上部分和地下部分分别剪成5 cm 左右的小段,各取新鲜植物200 g 加蒸馏水2 000 g,充分摇匀后放置于密封容器内浸泡48 h,双层纱布过滤2 次后即得麦冬地上部分和地下部分水提原液(0.1 kg/L),在4 ℃冰箱中保存备用[3]。
2.2 大鼠CFs 的培养与鉴定
2.2.1 大鼠CFs 的培养 无菌条件下取出新生SD大鼠心脏,去除心房和大血管。PBS 漂洗后,将心室部分剪至0.5 ~1.0 mm3小块,0.125 g/L 胰蛋白酶37 ℃消化30 ~40 min,每10 min 收集1 次细胞,收集3 ~4 次,筛网过滤后1 000 r/min 离心5 min,将所得细胞分散悬浮于含10%胎牛血清的DMEM 培养液中,37 ℃、5% CO2孵箱中静置贴壁60 ~90 min,倾去上层未贴壁细胞,更换培养液。心肌成纤维细胞较心肌细胞贴壁速度快,培养瓶中贴壁细胞基本为成纤维细胞。继续培养3 d,细胞生长至近汇合状态时按1∶3 传代。实验采用3 ~4 代细胞。若细胞贴壁并已伸展但未汇合,用台盼蓝拒染法检查活细胞数>95%,则换成无血清培养基培养。
2.2.2 大鼠CFs 的鉴定 倒置显微镜下可见CFs呈梭形、多角形,细胞质透明,细胞核较大,呈椭圆形,见图1。台盼蓝染色活细胞大于95%。

Figure 1. Cultured rat CFs under reverse microscope (×250).图1 倒置显微镜下培养的鼠CFs
2.3 细胞活力分析 将刺激后的细胞置于37 ℃饱和湿度、95%空气、5% CO2孵箱中继续培养2 h,消化1 mL 细胞悬液后置于Vi-CELL AUTO 100/240 细胞活力分析仪中进行分析。
2.4 实验分组及检测指标 实验分4 组:对照组:只加无血清DMEM 培养液;麦冬干预组:麦冬加入无血清DMEM 培养液中。检测[3H]-脯氨酸掺入率、TGF-β1、p-Smad2/3 和Smad2/3 的表达。
2.5 [3H]-脯氨酸掺入实验测定细胞胶原合成能力
取对数生长期的细胞以5 ×103cells/well 接种在96 孔板中。饥饿期结束后,加入无血清DMEM 培养液、不同浓度糜酶或糜酶抑制剂作用24 h;或给予各干预药物预处理1 h,再分别与30 g/L 糜酶共同作用24 h。每孔加入[3H]脯氨酸(购自中国原子能研究院同位素研究所)111GBq 和维生素C 50 mg/L 继续孵育4 h。用25% 胰蛋白酶消化细胞呈细胞悬液,多头细胞收集器收集细胞至玻璃纤维滤纸上,烤干。将玻璃纤维滤纸置于闪烁计数管中,每管加入闪烁液5 mL,液态闪烁计数仪测定放射性强度。
2.6 Western blotting 检测细胞TGF-β1、p-Smad2/3和Smad 的蛋白表达 将细胞以5 ×104cells/well 接种在6 孔板中。加入无血清DMEM 培养液或40 g/L麦冬作用24 h。收获细胞,加入细胞裂解液,冰上裂解30 min;离心10 min,上清部分保存于-80 ℃,用于测定胞浆TGF-β1和Smad2/3 蛋白表达。上清液中的蛋白浓度以BCA 法测定。取等量蛋白与加样缓冲液混合,煮沸5 min,上样,行SDS-PAGE 凝胶电泳。电转移至PVDF 膜,室温封闭1 h,分别加入兔抗大鼠TGF-β1、Smad2/3、p-Smad2/3 和β-actinⅠ抗,过夜,洗膜,再加入HRP 标记的Ⅱ抗室温孵育2 h,暗室中用ECL 覆盖膜5 min,X 光胶片曝光,显影、定影,凝胶成像系统进行吸光度扫描分析。
3 统计学处理
数据以均数±标准差(mean ±SD)表示,用SPSS 11.0 软件进行分析,组间差异采用单因素方差分析,两两比较采用LSD 检验。对细胞活力仪所得数据进行析因方差分析。以P <0.05 为差异有统计学意义。
结 果
1 CFs 细胞活力分析
实验组和对照组细胞活力比较,差异有统计学意义(P <0.01)。低浓度麦冬处理组和高浓度麦冬处理组比较,组间细胞活力随着浓度升高,不同浓度组之间的差异均有统计学意义(P <0.01),见表1。

表1 不同浓度麦冬对心脏成纤维细胞活力的影响Table 1. The effects of Ophiopogon japonicus on the vitality of cardiac fibroblasts (mean±SD.n=10)
2 麦冬对CFs 的[3H]-脯氨酸掺入率的影响
[3H]-脯氨酸掺入实验结果显示,10、20 和30 μg/L 麦冬作用24 h,心脏成纤维细胞 的[3H]-脯氨酸掺入率呈递减趋势。10 μg/L 麦冬组[3H]-脯氨酸掺入率显著低于对照组(P <0.01);20 μg/L 麦冬组[3H]-脯氨酸掺入率显著低于10 μg/L 麦冬组(P<0.01);30 μg/L 麦冬组[3H]-脯氨酸掺入率显著低于20 μg/L 麦冬组(P <0.01),见图2。
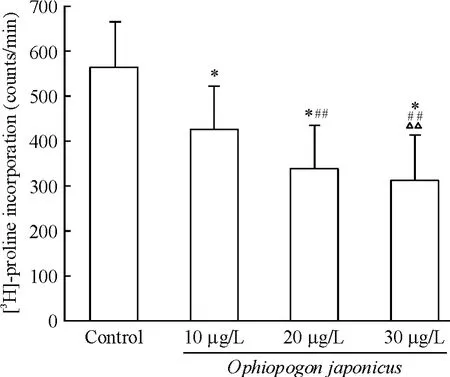
Figure 2. The effects of Ophiopogon japonicus on[3H]-proline incorporation in cardiac fibroblasts. Mean ± SD. n =10. * P <0.05 vs control;## P <0.01 vs 10 μg/L Ophiopogon japonicus;△△P <0.01 vs 20 μg/L Ophiopogon japonicus.图2 不同浓度麦冬对心脏成纤维细胞[3H]-脯氨酸掺入率的影响
3 麦冬对CFs 的TGF-β1蛋白表达的影响
Western blotting 结果显示,在30 μg/L 麦冬作用下,TGF-β1蛋白表达呈浓度依赖性改变。10 μg/L麦冬组TGF-β1蛋白表达显著低于对照组(P <0.01);20 μg/L 麦冬组TGF-β1蛋白表达显著低于10 μg/L 麦冬组(P <0.01);30 μg/L 麦冬组TGF-β1蛋白表达显著低于20 μg/L 麦冬组(P <0.01),见图3。
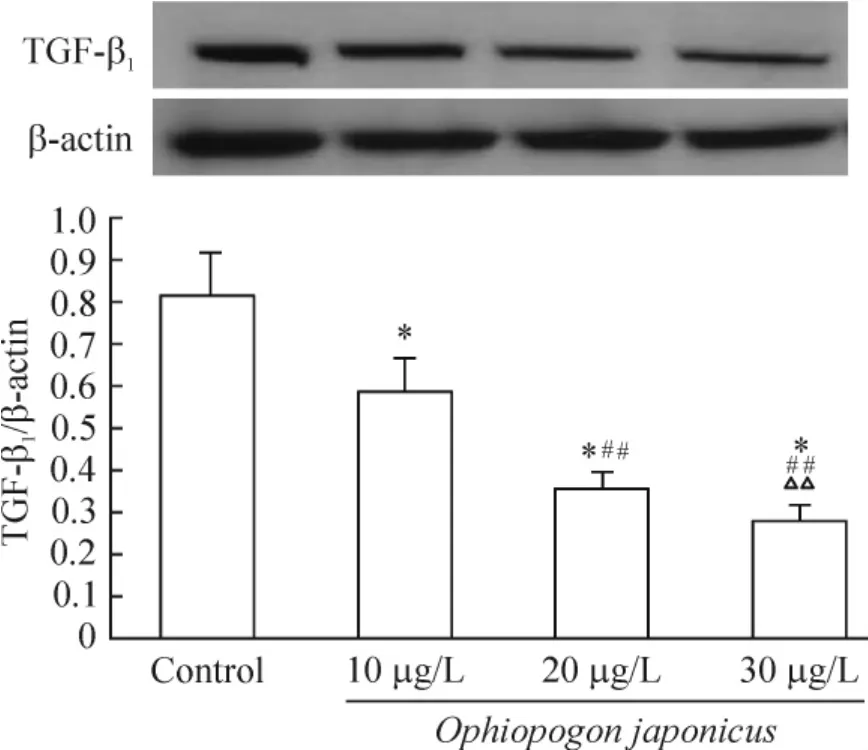
Figure 3. The effects of Ophiopogon japonicus on TGF-β1 protein expression in cardiac fibroblasts.Mean±SD.n=10.* P <0.05 vs control;##P <0.01 vs 10 μg/L Ophiopogon japonicus;△△P <0.01 vs 20 μg/L Ophiopogon japonicus.图3 麦冬作用不同时间对大鼠心脏成纤维细胞TGF-β1 蛋白表达的影响
4 麦冬对CFs 的Smad 蛋白表达的影响
Western blotting 结果显示,在30 μg/L 麦冬作用下,p-Smad2/3 及Smad2/3 蛋白表达呈时间依赖性改变。10 μg/L 麦冬组p-Smad2/3 及Smad2/3 蛋白表达显著低于对照组(P <0.01);20 μg/L 麦冬组p-Smad2/3 及Smad2/3 蛋白表达显著低于10 μg/L麦冬组(P <0.01);30 μg/L 麦冬组p-Smad2/3 及Smad2/3 蛋白表达显著低于20 μg/L 麦冬组(P <0.01),见图4。
讨 论
心肌纤维化近年来日益受到国内外心血管专家的重视,目前现代医学对其确切发病机制尚未完全阐明[4-5]。虽然目前血管紧张素转化酶抑制剂类药物已广泛用于临床,但其它的药物目前尚无明显的证据显示可以改善心肌纤维化。中药麦冬近年来被发现具有抗心肌纤维化的作用,但该药物能否有效改善心肌纤维化还有待进一步证实,其作用机制也需要进一步阐明。
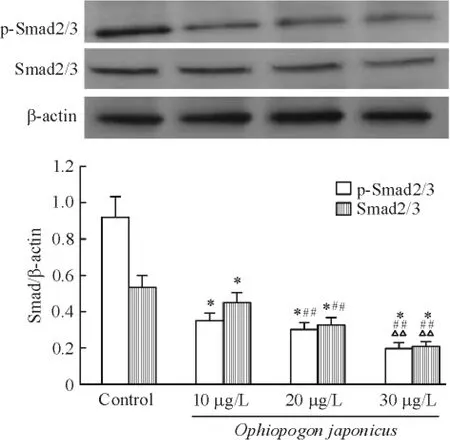
Figure 4. The effects of Ophiopogon japonicus on Smad protein expression in cardiac fibroblasts. Mean ± SD. n =10.* P <0.05 vs control;##P <0.01 vs 10 μg/L Ophiopogon japonicus;△△P <0.01 vs 20 μg/L Ophiopogon japonicus.图4 麦冬对大鼠心脏成纤维细胞Smad 蛋白表达的影响
脯氨酸是心肌胶原合成的重要底物,测定[3H]-脯氨酸掺入率可准确反映心肌成纤维细胞胶原合成的能力[3]。本研究结果表明,中药麦冬能够抑制心肌成纤维细胞活力和[3H]-脯氨酸掺入率,表明中药麦冬可抑制心肌成纤维细胞活力和胶原合成,从而抑制心肌纤维化。实验结果显示,与正常对照组比较,麦冬预处理组细胞活力和[3H]-脯氨酸掺入率明显降低,而且麦冬的抑制作用与其浓度明显相关。在体外培养中,TGF-β1以无活性的形式被释放,激活后促进心肌成纤维细胞分化增生,上调胶原合成并抑制胶原酶释放。在成纤维细胞内,TGF-β1能增强脯氨酸羟化,使产生的原胶原分子更为稳定而难以降解[6]。目前关于中药麦冬抑制心肌成纤维细胞胶原合成的细胞内信号转导机制尚不清楚。TGF-β1是众多因素导致组织纤维化的最后共同通路之一[7]。本研究结果显示,麦冬以浓度依赖方式抑制TGF-β1蛋白表达,表明TGF-β1参与麦冬抑制心肌成纤维细胞胶原合成的作用。TGF-β1是成纤维细胞的强趋化因子,诱导其分化为心肌成纤维细胞,刺激胶原蛋白、纤维连接蛋白及蛋白多糖等细胞间质成分的合成,促进细胞间质的沉积。
Smad 蛋白是TGF-β1下游的信号转导和调节分子[8]。根据结构和功能的不同,Smad 蛋白可分为3个亚家族:受体激活型Smads(R-Smads)、共同介质型Smads(Co-Smads)和抑制型Smads(I-Smads)[7]。介导TGF-β1信号的R-Smads 主要是Smad2 和Smad3,可被TGF-β1的受体磷酸化而激活,形成p-Smad2 和p-Smad3。后者进一步与Co-Smads 结合成为转录复合物,移入细胞核内,激活特定的靶基因,完成细胞内信号转导过程。p-Smad2/3 是由Smad2/3 磷酸化而来,是Smad2/3 的活化形式[9-11]。在本实验中,Western blotting 结果显示,与对照组比较,在麦冬作用下,p-Smad2/3 及Smad2/3 蛋白表达呈浓度依赖性改变,中药麦冬可以抑制p-Smad2/3 及Smad2/3 蛋白表达,表明Smad 信号通路的活化参与麦冬调控心肌纤维化过程。
[1] 高淑卿,朱鹏立.心肌纤维化的研究进展[J]. 医学综述,2009,15(2):1627-1629.
[2] 何立峰,马礼坤. 阿托伐他汀对实验性大鼠心肌纤维化的干预作用及可能机制[J]. 中国病理生理杂志,2010,26(2):227-232.
[3] 徐莹梅,田胜尼.麦冬水提液对莴苣等3 种植物化感作用的初步研究[J]. 安徽林业科技,2011,37(4):14-17.
[4] Yu J,Fei J,Azad J,et al. Myocardial protection by Salvia miltiorrhiza injection in streptozotocin-induced diabetic rats through attenuation of expression of thrombospondin-1 and transforming growth factor-β1[J]. J Int Med Res,2012,40(3):1016-1024.
[5] 洪华山,林 岚,王一波. 胰岛素促进心肌成纤维细胞增殖和心肌细胞肥大的作用[J]. 中国病理生理杂志,2002,18(5):505-509.
[6] Glazer NL,Macy EM,Lumley T,et al. Transforming growth factor beta-1 and incidence of heart failure in older adults:the Cardiovascular Health Study[J]. Cytokine,2012,60(2):341-345.
[7] Pan Z,Sun X,Shan H,et al. MicroRNA-101 inhibited postinfarct cardiac fibrosis and improved left ventricular compliance via the FBJ osteosarcoma oncogene/transforming growth factor-β1pathway[J]. Circulation,2012,126(7):840-850.
[8] Lei B,Hitomi H,Mori T,et al. Effect of efonidipine on TGF-β1-induced cardiac fibrosis through Smad2-dependent pathway in rat cardiac fibroblasts[J]. J Pharmacol Sci,2011,117(2):98-105.
[9] Voloshenyuk TG,Hart AD,Khoutorova E,et al. TNF-α increases cardiac fibroblast lysyl oxidase expression through TGF-β and PI3Kinase signaling pathways[J].Biochem Biophys Res Commun,2011,413(2):370-375.
[10]赵晓燕,赵连友,郑强荪,等. 转化生长因子β1/Smad通路调控糜酶诱导心脏成纤维细胞胶原合成[J]. 中华高血压杂志,2009,17(8):743-746.
[11]Ma F,Li Y,Jia L,et al. Macrophage-stimulated cardiac fibroblast production of IL-6 is essential for TGF β/Smad activation and cardiac fibrosis induced by angiotensin II[J]. PLoS One,2012,7(5):e35144.
