RNA 结合蛋白HuR 对NF-κB 抑制因子α转录后调控机制的初步研究*
2013-12-23于文燕马小娟孙宏卫买买提祖农买苏尔马瑞斌刘玉新
于文燕, 马小娟, 孙宏卫, 买买提祖农·买苏尔, 马瑞斌, 柯 颖, 刘玉新, 马 琪
(新疆医科大学1病理生理学教研室,6机能中心,新疆 乌鲁木齐830000;2南方医科大学病理生理学教研室,广东 广州510515;武警新疆总队医院3普外科,4神经外科,新疆 乌鲁木齐830000;5宁波大学医学院组织学教研室,浙江 宁波315000)
RNA 结合蛋白(RNA-binding proteins,RBPs)是近年来发现的具有多种生物学作用的分子家族,其中HuR 属于胚胎致死异常视觉家族的RBPs,在体内表达广泛。最初发现HuR 与神经分化相关,通过与靶mRNA 3'UTR 的ARE 结合,在转录后水平调控RNA 的稳定性和蛋白表达。近年发现,HuR 与细胞增殖、炎症等密切相关[1-3]。IκB 是核因子κB(nuclear factor kappa B,NF-κB)的抑制因子,是细胞浆中存在的另一类蛋白质家族。IκB 的 主 要 作 用可以概括 如下[4]:阻止NF-κB 核易位、阻止NF-κB 与DNA 结合、促进NF-κB 与DNA 的κB 序列解离。可见IκB 对于NF-κB 发挥其正常生物学功能至关重要。本研究主要是从转录后水平研究HuR 对IκB-α在体内的调控,为进一步研究IκB-α 在NF-κB 通路调控中的作用打下基础。
材 料 和 方 法
1 细胞系
NIH 3T3 细胞购自美国典型培养物种库(American Type Culture Collection,ATCC)。
2 主要试剂
培养基(DMEM)、胎牛血清(fetal bovine serum,FBS)、无血清培养基(Opti-MEM)购自Gibco-BRL;质粒小量抽提试剂盒、DNA 纯化回收试剂盒、100 bp DNA marker、1 kb DNA marker 和预染蛋白ladder 均购自New England Biolabs(NEB);琼脂糖粉购自Biowest;LipofectamineTM2000 转 染 试 剂、Platinum ®SYBR® Green Real-time PCR 试剂盒和TRIzol RNA提取试剂购自Invitrogen;ReverTra Ace® qPCR RT Kit 逆转录试剂盒和RNA 纯化试剂盒购自Toyobo;限制性内切酶、KOD plus 聚合酶及配套PCR 试剂、T4 DNA 连接酶及配套试剂购自TaKaRa;MAXIscript Kit 购 自Ambion;Streptavidin Agarose Resin 购 自Thermo;酵母RNA 购自Sigma;anti-HA、anti-HuR 和anti-IκB-α 抗体购自Santa Cruz;HRP-linked Antibody购自Cell Signaling Technology;放线菌素D 和Dual-Luciferase Reporter Gene Assay Kit 购自Promega。
3 质粒、引物合成及siRNA 合成
萤火虫萤光素酶报告基因质粒pGL3-control、海肾(Renilla)萤光素酶报告基因质粒pRL-TK、表达pcDNA3-HA-HuR 融合蛋白的真核细胞表达质粒pcDNA3-HA-HuR 和pcDNA3 空载体由宁波大学刘玉新博士惠赠;引物由上海英骏生物技术有限公司合成;siRNA 由上海吉玛制药技术有限公司合成。
4 主要方法
4.1 IκB-α mRNA 3'UTR 报告基因真核表达质粒构建 使用细胞总RNA 提取试剂TRIzol 提取NIH 3T3 细胞总RNA,以此总RNA 为模板进行RT-PCR反应,获得的产物即为NIH 3T3 细胞cDNA 文库。从GenBank 获得小鼠IκB-α mRNA 3'UTR 的编码序列,并设计引物。上游引物5'-ATC GCC GTG TAA TGG AAA GTG GCA AAA AGA ATG-3',下游引物5'-GCT CTA GAG CTG TCT GTA AAA ATC TGT TTA AT-3'(下划线部分为Xba I 酶切位点)。以NIH 3T3 细胞的cDNA 文库为模板,使用KOD plus 聚合酶进行PCR 反应,扩增IκB-α mRNA 3'UTR 片段。同时从pGL3-control 质粒扩增luciferase 片段使用的上游引物5'-GGT AAA GCC ACC ATG GAA GAC G-3'(下划线部分为 Nco I 的酶切位点),下游引物5'-CACTTTCCA TTA CAC GGC GAT CTT TCC G-3'。将2 次PCR 扩增的片段混合后为模板,扩增luciferase-IκB-α mRNA 3'UTR 片 段,5'-GGT AAA GCC ACC ATG GAA GAC G-3'(下划线部分为Nco I 的酶切位点),下游引物5'-GCT CTA GAG CTG TCT GTA AAA ATC TGT TTA AT-3'(下划线部分为Xba I 酶切位点)。将luciferase-UTR 的PCR 产物1%琼脂糖凝胶电泳,切取目的条带后用DNA 纯化回收试剂盒回收。将pGL3-control 质粒以及回收的luciferase-UTR片段分别行Xba I 和Nco I 双酶切,将luciferase-IκBα mRNA 3'UTR 通过Xba I 和Nco I 酶切位点插入pGL3-control 以取代质粒中原有的萤火虫萤光素酶基因;酶切产物行1%琼脂糖凝胶电泳,切取目的条带后用DNA 纯化回收试剂盒回收。回收的酶切后载体与目的片段按摩尔比1∶4 混合,用T4 DNA 连接酶于16 ℃连接16 h,转化DH5α 感受态细胞,铺Amp+琼脂板,12 h 后挑取单克隆,置于5 mL 的Amp+LB 培养液中摇菌12 h,使用质粒微提试剂盒提取质粒。对所提取的质粒分别进行PCR、Xba I 和Nco I 双酶切鉴定及测序鉴定,所构建的质粒命名为pGL3-UTR。
4.2 脂质体LipofectamineTM2000 转染质粒 转染前一天接种3T3 细胞于6 cm 皿,次日融合度约60%左右。每1 μg 质粒按照3 μL 脂质体计算,分别用无血清培养基Opti-MEM 50 μL 稀释质粒及脂质体,室温孵育5 min。将稀释后的脂质体转染试剂加入质粒中,混匀离心,室温孵育15 min。细胞换液,加入无血清DMEM 900 μL。将质粒和脂质体混合物加入细胞中,37 ℃培养3 h。3 h 后补液至4 mL 并补充10%血清。
4.3 过表达HuR 对IκB-α mRNA 稳定性及蛋白表达影响 3.5 cm 皿NIH 3T3 细胞转染pcDNA3-HAHuR 1 μg,对照组转染pcDNA3 1 μg 24 h 后,给予放线菌素D 5 mg/L 处理1 h。放线菌素D 可以抑制RNA 的合成,从而检测RNA 的稳定性。提取mRNA检测IκB-α mRNA 变化;6 cm 皿NIH 3T3 细胞转染pcDNA3-HA-HuR 1 μg,对照组转染pcDNA3 1 μg 24 h 后,收集细胞提取细胞总蛋白,Western blotting 检测IκB-α 蛋白表达变化。
4.4 报告基因检测 双萤光素酶报告基因系统,即结合萤火虫萤光素酶底物和海肾萤光素酶底物共报告基因测试技术,在用萤火虫萤光素酶(pGL3)定量基因表达时,通常采用海肾萤光素酶(pRL-TK)底物共报告基因作为内参照,来减少内在的变化因素所带来的的实验的误差,如排除培养细胞的数目和活力的差别,以及细胞转染和裂解效率的差别等。按照Dual-Luciferase Reporter Gene Assay Kit 说明书操作,将试剂盒中的专用细胞裂解液(5 ×passive lysis)用PBS 稀释为1 ×passive lysis。转染后的24 孔板3T3 细胞,每孔加入150 μL 1 ×passive lysis,室温摇床裂解15 min。吸取裂解产物于新离心管,冻存于-80 ℃冰箱30 min。将上清恢复至室温后混匀,吸5 μL 上清,按照Dual-Luciferase Reporter Gene Assay Kit 说明进行报告基因活性检测。
4.5 制备biotin 标记的IκB-α 与GAPDH mRNA 3'UTR 探针 对照组以GAPDH 3'UTR 为模版,实验组以质粒pGL3-UTR 为模板扩增带有T7 promoter 的单链DNA 序列,以作为下一步进行体外转录的模板DNA,用DNA 回收试剂盒回收PCR 产物。以上述单链3'UTR 序列为模板按照MAXIscript Kit 说明书进行体外转录实验,得到biotin 标记的IκB-α mRNA 3'UTR 的探针。体外转录反应结束后,于反应液中加入RNase-free DNase 10 U,混匀后置于37 ℃水浴反应10 min,使模板DNA 充分降解。使用RNeasy®Kit 对体外转录得到的RNA biotin-3'UTR 探针进行纯化。纯化得到的RNA 探针进行浓度测定,冻于-80 ℃备用。
4.6 Streptavidin-biotin RNA-pull down 待3T3 细胞的融合度达到90%时,用细胞刮刀刮下6 cm 皿内的细胞,用1 mL 预冷PBS 冲洗细胞刮刀和6 cm 皿,收集悬液置于EP 管内,以上操作均在冰上完成。12 000 ×g 4 ℃离心30 s 得到细胞沉淀,弃上清,加入300 μL 细胞裂解液(1. 5 g/L 肝素、2 mmol/L DTT、蛋白酶抑制剂、磷酸酶抑制剂)于4 ℃裂解细胞1 h。细胞裂解液以12 000 ×g 4 ℃离心10 min,收集裂解上清于DEPC 处理过无RNase 酶的EP 管内。裂解上清中加入biotin 标记的3'UTR 探针(约400 ng)、酵母RNA(100 μg/L,1.5 μL)、RNase inhibitor(1 ×105U/L,3 μL)、肝素(1.5 g/L),4 ℃共孵育3 h。取20 μL 链亲和素标记的beads 置于无RNase 的EP 管内,用细胞裂解液500 μL 洗涤streptavidin beads,500 ×g 4 ℃离心5 min,弃上清,备用。探针与裂解液共孵育3 h 后,12 000 ×g 4 ℃离心5 s 后,转移至预先洗涤过的beads 中,4 ℃共孵育3 h。上述共孵育3 h 后混合溶液用750 μL 细胞裂解液洗涤,以洗掉beads 上结合的非特异蛋白。500 ×g 4 ℃离心5 min,弃上清。重复清洗beads 4 次。洗涤beads 4 次后,加入2 × Loading Buffer 20 μL 95 ℃变性5 min,12 000 r/min 离心3 min,用于Western blotting检测。
4.7 脂质体LipofectamineTM2000 转染干扰片段siRNA 转染前1 d 接种3T3 细胞于3.5 cm 皿,次日融合度约30%左右。将公司合成的3 对干扰HuR 的siRNA(序列见表1)按照浓度1∶1∶1 混合,混匀后按照siNC、siHuR 25 nmol/L 及3 μL 脂质体计算,分别用无血清培养基Opti-MEM 50 μL 稀释siRNA 及脂质体,室温孵育5 min。将稀释后的脂质体转染试剂加入siRNA 中,混匀离心,室温孵育15 min。细胞换液,加入无血清DMEM 600 μL 将质粒和脂质体混合物加入细胞中,37 ℃培养6 h。6 h 后补液至4 mL 并补充10%血清。

表1 HuR siRNA 的序列Table 1. Sequences of HuR siRNA
4.8 干扰HuR 表达对IκB-α mRNA 及蛋白表达影响 3.5 cm 皿NIH 3T3 细胞转染HuR siRNA 24 h后,将其传代,平分为2 皿,1 皿用于检测HuR 及IκB-α mRNA 表达,另1 皿给予放线菌素D 处理1 h,提取mRNA 检测IκB-α mRNA 稳定性改变。6 cm 皿NIH 3T3 细胞转染HuR siRNA 48 h 后,裂解细胞,Western blotting 检测HuR 及IκB-α 蛋白表达。
4.9 实时定量PCR 检测mRNA 稳定性 过表达或干扰HuR 表达处理后的3T3 细胞给予放线菌素D 5 mg/L 处理1 h,TRIzol 法提取细胞总RNA,RNA 反转录按照ReverTra Ace® qPCR RT Kit 逆转录试剂盒说明书进行操作。实时定量PCR 反应体系按照Platinum® SYBR® Green Real-time PCR 试剂盒说明书进行配制及操作,以β-actin 作为内参照。引物序列见表2。

表2 qPCR 的引物序列Table 2. Primer sequences for qPCR
5 灰度分析
使用ImageJ 灰度分析软件进行蛋白质免疫印迹图像灰度分析,分别测定出各个时点蛋白表达量的灰度值及相对应actin 蛋白表达量的灰度值,二者的比值代表各时点蛋白的相对表达量,并以相对表达量进行统计学分析。
6 统计学处理
使用统计软件为SPSS 13.0,首先采用Levene 进行方差齐性检验,文中样本方差均齐,则采用单因素方差分析(One-way ANOVA),以P <0.05 为差异有统计学意义,绘图软件为OriginPro 8.0。
结 果
1 IκB-α mRNA 3'UTR 报告基因真核表达质粒构建
将提取的质粒pGL3-UTR 分别用Nco I 和Xba I进行双酶切鉴定。电泳结果表明,经双酶切后可得到约3.6 kb 和2.2 kb 的片段,符合预期大小,见图1。DNA 测序结果同时证实质粒构建成功。
2 IκB-α mRNA 3'UTR 驱动的报告基因的表达
阴性对照组:转染质粒pGL3-control 1 μg 和pRL-TK 0.1 μg;实验组:转染质粒pGL3-UTR 1 μg和pRL-TK 0.1 μg。实验组与对照组分别在转染报告基因质粒24 h 后检测报告基因萤光素酶活性,与对照组相比,过表达pGL3-UTR 后,报告基因萤光素酶活性明显增高,见图2。
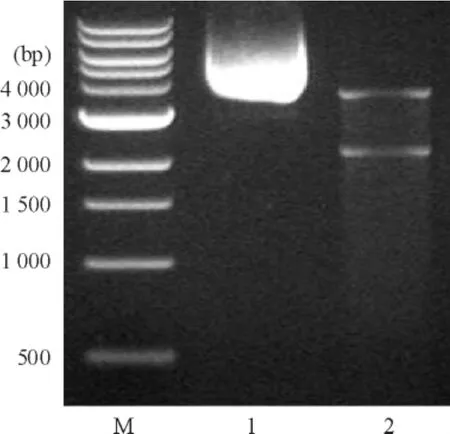
Figure 1. Identification of vector pGL3-UTR with restrictive endonuclease digestion.M:1 kb DNA marker;1:pGL3-UTR;2:pGL3-UTR digested by Nco I and Xba I.图1 pGL3-UTR 萤光素酶报告基因重组质粒的鉴定
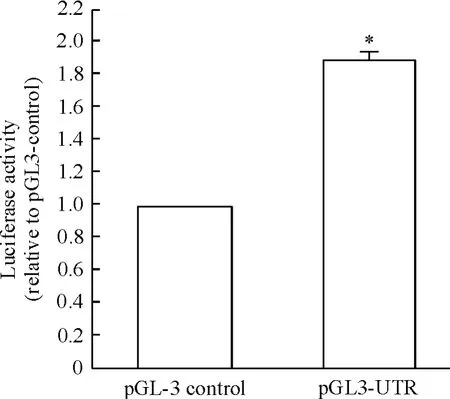
Figure 2. The influence of overexpressing pGL3-UTR on the luciferase activity of IκB-α mRNA 3'UTR reporter gene.Mean±SD.n=3. * P <0.05 vs pGL3-control.图2 过表达pGL3-UTR 对IκB-α mRNA 3'UTR 报告基因萤光素酶活性的影响
3 HuR 蛋白对IκB-α mRNA 3'UTR 驱动的报告基因萤光素酶活性的影响
阴性对照:转染质粒pGL3-UTR 1 μg、pRL-TK 0.1 μg 和pcDNA3 1 μg;实验组:转染质粒pGL3-UTR 1 μg、pRL-TK 0. 1 μg 和pcDNA3-HA-HuR 1 μg。实验组与对照组分别转染报告基因质粒24 h后检测,与对照组相比,过表达pcDNA3-HA-HuR 后,报告基因萤光素酶活性明显增高,见图3。
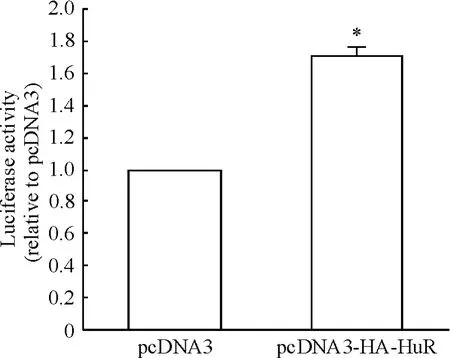
Figure 3. The influence of overexpressing pcDNA3-HA-HuR on the IκB-α mRNA 3'UTR reporter gene. Mean ±SD. n=3. * P <0.05 vs pcDNA3.图3 过表达pcDNA3-HA-HuR 对IκB-α mRNA 3'UTR 报告基因萤光素酶活性的影响
4 Streptavidin-biotin RNA-pull down 技术证明HuR 蛋白可与IκB-α mRNA 3'UTR 特异性结合
Streptavidin-biotin RNA-pull down 后,biotin-IκBα 3'UTR RNA 探针组可以检测到HuR 蛋白,而biotin-GADPH 3'UTR RNA 探针组为阴性,表明HuR 蛋白可以特异性地与IκB-α 3'UTR RNA 结合,见图4。
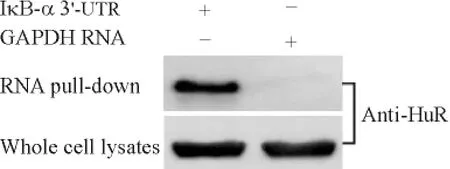
Figure 4. The result of RNA pull-down assay.图4 RNA pull-down 结果
5 过表达HuR 对IκB-α mRNA 稳定性及蛋白表达的影响
与对照相比,过表达pcDNA3-HA-HuR 后,IκB-α mRNA 稳定性无明显变化,见图5,IκB-α 蛋白表达明显上调,见图6。

Figure 5. The influence on IκB-α mRNA stability by overexpressing pcDNA3-HA-HuR. Mean±SD.n=3.图5 过表达pcDNA3-HA-HuR 对IκB-α mRNA 稳定性的影响

Figure 6. The influence on IκB-α protein by overexpressing pcDNA3-HA-HuR.Mean±SD. n =3. * P <0.05 vs pcDNA3.图6 过表达pcDNA3-HA-HuR 对IκB-α 蛋白表达的影响
6 干扰HuR 表达后观察其对IκB-α mRNA 稳定性及蛋白表达的影响
qPCR 检测HuR mRNA 表达干扰效率约80%,干扰HuR mRNA 后对IκB-α mRNA 稳定性无明显影响,见图7。HuR 蛋白表达明显被干扰后,IκB-α 蛋白表达明显下调,见图8。
讨 论
核因子κB 抑制蛋白是核因子κB 的抑制因子。IκB 蛋白家族与Rel/NF-κ 蛋白家族一样,也是一个大家族,它们都来源于相同祖先NF-κB/IκB 超家族的Rel 同源区- 锚蛋白重复序列区(Rel homology domain-ankyrin repeat domain,RHD-ARD)结 构[5]。IκB 蛋白家族的成员主要包括:IκBα、IκBβ、IκBε、Bcl-3、IκBγ、IκBδ、p100 和p105 等。
在一般的生理情况下,非活化状态的NF-κB 以与IκBα 聚合的三聚体形式或与前体蛋白聚合的二聚体形式存在于胞浆中,此时NF-κ B 的Rel 同源区均被IκB 占据,遮盖了NF-κB 的核定位序列(nuclear localization signal,NLS),因而NF-κB 不能转位入核,不能调控基因的转录翻译表达,处于无活性状态。当细胞受到合适的胞外信号前炎症细胞因子如IL-1、TNF-α 以及低氧、氧化剂、脂多糖、细菌、病毒、紫外线、某些变应原等多种因素的刺激时,引起一系列连锁的酶促反应。当IκB 被蛋白酶体降解后,IκB 与NF-κB 的RHD 区分离,NF-κB 的NLS 暴露出来,转位到细胞核内,与靶基因上的κB 位点发生特异性结合,调控相关基因的转录和翻译[6]。
由此可见IκBα 对于核转录因子NF-κB 发挥其正常功能具有重大意义,本研究从转录后水平探讨体内调控IκBα 生物学功能的机制,从而为进一步研究其在NF-κB 通路中的作用机制打下良好基础。
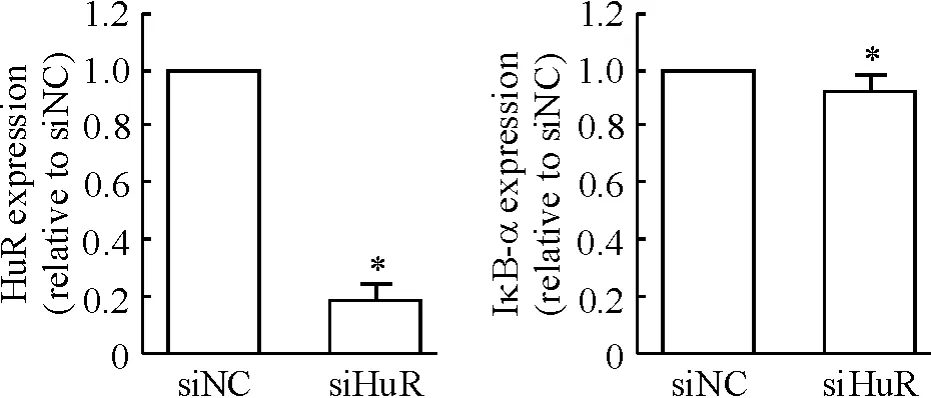
Figure 7. The influence on the IκB-α mRNA stability by interfering HuR.Mean±SD.n=3. * P <0.05 vs siNC.图7 HuR 干扰效率检测及对IκB-α mRNA 稳定性的影响
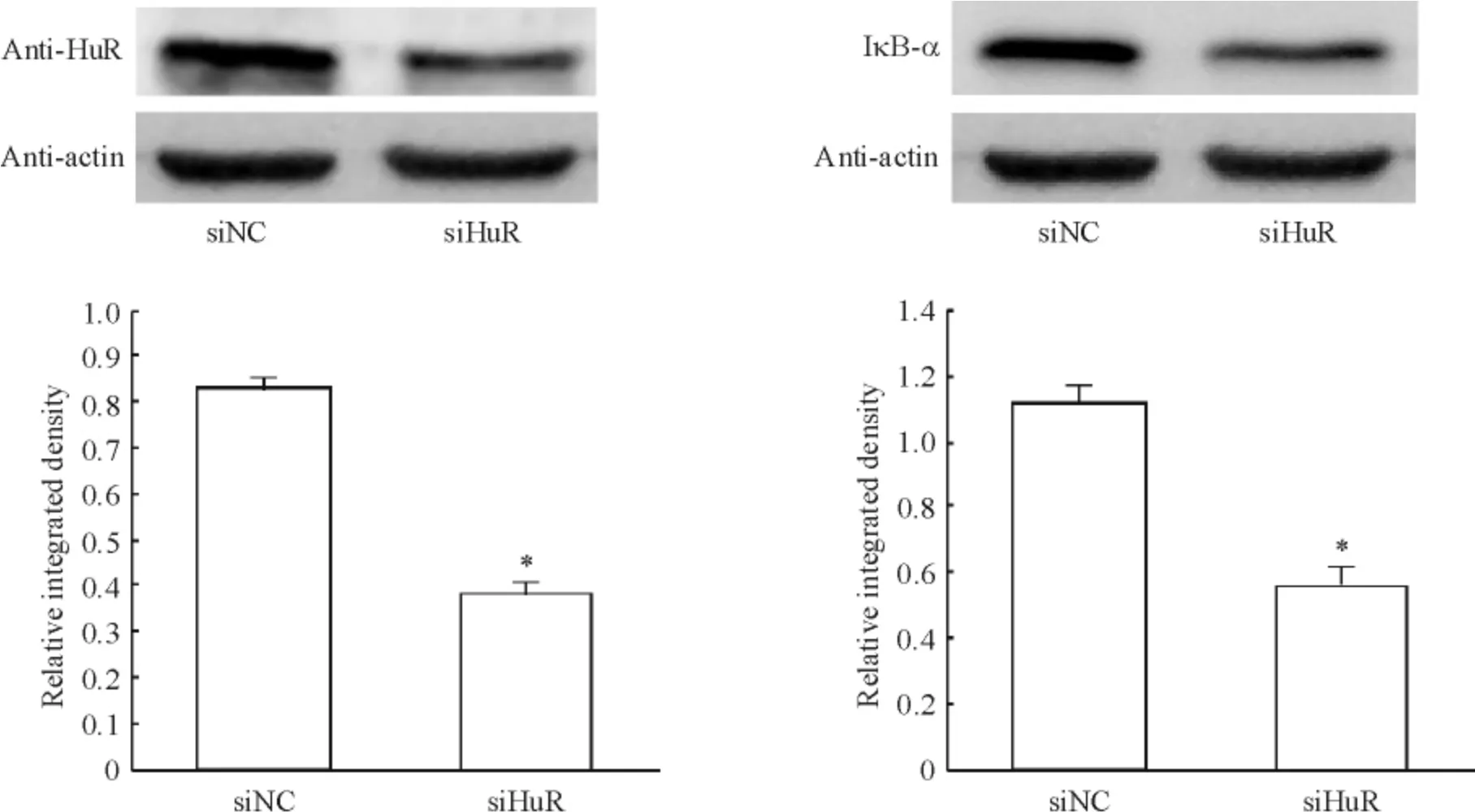
Figure 8. The influence on the IκB-α protein by interfering HuR.Mean±SD.n=3. * P <0.05 vs siNC.图8 HuR 干扰效率检测及对IκB-α 蛋白表达的影响
基因表达调控是在多级水平上进行的:基因活化、转录、转录后加工、翻译、翻译后加工等[7]。基因转录起始的调控是大多数基因的主要调控形式,但是其它的调控能够在从DNA 到蛋白质途径发挥作用,来调节所产生的基因产物数量。基因表达的转录后调控一般指在RNA 聚合酶结合到基因启动子后,对转录产物进行的一系列修饰,主要包括:转录的提前终止、剪接、mRNA 通过核孔和胞质内定位、RNA 编辑、翻译起始和翻译效率,mRNA 的稳定性等多个环节。
转录后调控机制比其它调节形式更快捷和经济[8],可以根据机体内外环境的变化迅速调节相关蛋白的表达水平,对于机体维持内环境的稳定至关重要。在基因表达转录后调控中,mRNA 稳定性及翻译的调控具有重要的作用[9-12],通过这两种形式的调控,细胞可以对内外源性刺激作出迅速的反应。研究发现转录本中调控mRNA 稳定性等的元件存在于3'非翻译区(3'UTR)[13],大部分转录后调控机制的靶向部位都位于转录本mRNA 的3'UTR 区。现已发现约5% ~8%的人类基因编码的mRNA 其3'UTR区含有ARE 序列。ARE 序列是一段长度约为50 ~150 nt、富含腺嘌呤和尿嘧啶的序列,与mRNA 的稳定性有密切关系。ARE 序列能够招募许多ARE 结合蛋白(ARE-binding proteins,ARE-BP),这些AREBP 相互协作或竞争地与mRNA 的ARE 结构域结合,共同调节mRNA 的稳定性和翻译水平。
Hu 家族蛋白是一种mRNA 结合蛋白[14],因与果蝇体内的胚胎致死异常视觉蛋白同源,所以Hu 家族又被称为类胚胎致死异常视觉(ELAVL)家族。Hu 家族有4 个成员:HuB(Hel-N1)、HuC、HuD 和HuR(ELAVLl),前3 个成员主要在终端分化的神经组织表达并与神经发育有关,而HuR 在其它组织中也广泛表达。在HuR 蛋白上有3 个RNA 识别模序(RNA recognition motif,RRMs),可以与ARE(AUrich element)特定位点结合。
近年来研究发现HuR 在P13K/Akt/NF-κB、p38 MAPK、Wnt 等细胞信号转导通路中或应激、低氧条件启动下穿过细胞核到达细胞浆,在胞浆中稳定mRNA 减少其降解,延缓mRNA 半衰期,而加强靶因子的翻译表达[15]。
本实验中构建了IκB-α mRNA 3'UTR 报告基因真核表达质粒,并转染细胞检测报告基因,与对照组相比,其报告基因数值明显增高,表明IκB-α mRNA的3'UTR 区在其发挥生物学功能中具有重要作用;将RNA 结合蛋白HuR 的真核表达质粒与IκB-α mRNA 3'UTR 报告基因真核表达质粒共转染细胞后检测,其报告基因与对照组相比数值明显增高,表明HuR 可以对IκB-α mRNA 3'UTR 的生物学功能进行调控。体外标记IκB-α mRNA 3'UTR 生物素探针及RNA pull-down 实验,进一步证实HuR 可以与IκB-α mRNA 3'UTR 特异性结合而发挥其调节作用。
为进一步研究HuR 对IκB-α 的转录后调控机制,在细胞中分别过表达及干扰HuR,以观察其对IκB-α mRNA 稳定性及蛋白表达的影响。结果显示分别过表达及干扰HuR 后,对IκB-α mRNA 稳定性影响不大,但IκB-α 蛋白表达分别出现上调及下调现象,说明HuR 对IκB-α 的转录后调控作用,主要是通过加强其翻译作用而实现的。
综上所述,本研究中证实RNA 结合蛋白HuR 可以与IκB-α mRNA 3'UTR 特异性结合,并通过加强IκB-α 的翻译来调节其生物学功能,为进一步研究其在NF-κ 通路中发挥的重要作用提供了理论依据。
[1] Pascale A,Govoni S. The complex world of post-transcriptional mechanisms:is their deregulati on a common link for diseases?Focus on ELAV-like RNA-binding proteins[J]. Cell Mol Life Sci,2012,69(4):501-517.
[2] Lebedeva S,Jens M,Theil K,et al. Transcriptome-wide analysis of regulatory interactions of the RNA-binding protein HuR[J]. Mol Cell,2011,43(3):340-352.
[3] Mukherjee N,Corcoran DL,Nusbaum JD,et al. Integrative regulatory mapping indicates that the RNA-binding protein HuR couples pre-mRNA processing and mRNA stability[J].Mol Cell,2011,43(3):327-339.
[4] 杨建营,徐翔峰,向珍蛹.NF-κB 的研究进展[J].淮海医药,2011,29(1):93-96.
[5] Li C,Chen S,Yue P,et al. Proteasome inhibitor PS-341(bortezomib)induces calpain-dependent IκBα degradation[J]. J Biol Chem,2010,285(21):16096-16104.
[6] Lin A,Karin M. NF-κB in cancer:a marked target[J].Cancer Biol,2003,13(2):107-114.
[7] 夏小慧,胡 扬,张腾国,等. SLC2A4 基因启动子区rs5418 位点变异对基因表达的影响[J].中国病理生理杂志,2012,28(10):1791-1795.
[8] 陈淑华. 真核生物mRNA 3'非翻译区的调控功能[J].国外医学:生理、病理科学与临床分册,2003,6(6):611-614.
[9] Anderson P. Post-transcriptional control of cytokine production[J]. Nat Immunol,2008,9(4):353-359.
[10]Kuersten S,Goodwin EB.The power of the 3' UTR:translational control and development[J]. Nat Rev Genet,2003,4(8):626-637.
[11] Sonenberg N,Dever TE. Eukaryotic translation initiation factors and regulators[J]. Curr Opin Struct Biol,2003,13(1):56-63.
[12]Mendez R,Richter JD. Translational control by CPEB:a means to the end[J]. Nat Rev Mol Cell Biol,2001,18(7):521-529.
[13]江元清,凌 毅,赵武玲.真核mRNA 的3'非翻译区转录后水平调控作用研究进展[J].植物学通报,2001,18(1):3-10.
[14]王 俊.RNA 结合蛋白HuR 在肿瘤中的作用[J].中国肿瘤生物治疗杂志,2011,18(1):97-100.
[15]张 梅,李 瑞,郭瑞鲜,等.热休克蛋白参与PI3K/Akt介导H2O2预处理的抗凋亡作用[J].中国病理生理杂志,2011,27(8):1557-1562.
