MicroRNA-24 对心肌梗死后心肌细胞凋亡的调控作用*
2013-12-23黄伟聪郑亮承孙成超
王 珏, 黄伟聪, 郑亮承, 孙成超, 郑 哲
(1温州医学院附属第一医院心胸外科,浙江 温州325000;2阜外心血管病医院外科,北京100037)
心肌梗死是危害人类健康、造成心源性死亡的主要因素之一,心肌梗死过程中心肌细胞缺血缺氧会造成细胞不可逆转的死亡或凋亡,进而引起心功能不全[1]。心肌细胞凋亡在心梗后心脏重塑及心力衰竭的病理生理过程中扮演了重要角色,减少心肌细胞凋亡能改善心梗后心功能,改善心脏重塑过程[2]。MicroRNA(miRNA)在机体内主要通过抑制mRNA 转录或促mRNA 降解来行使负向调控基因表达的功能,参与机体各种疾病的发生发展过程[3]。研究发现在心脏中miRNA 能够调控各种心脏疾病的病理生理过程[4]。MicroRNA-24(miR-24)是一种心脏富集的miRNA,有报道显示抑制miR-24 能够诱导视网膜细胞的凋亡水平[5],然而相关于miR-24 在心梗后的变化及其作用机制国内外鲜有报道。本研究旨在观察miR-24 对于缺血缺氧条件下心肌细胞凋亡水平的调节,探讨miR-24 对心肌梗死后心功能及心肌细胞凋亡水平的影响。
材 料 和 方 法
1 材料
1.1 动物 本实验所使用的实验动物为12 周龄,25 ~30 g 的C57BL/6 雄性小鼠用于心肌梗死模型的制作;出生后1 ~3 d SPF 级Sprague-Dawley(SD)大鼠乳鼠用于获得原代心肌细胞。实验动物均购自北京大学医学部实验动物中心。所有动物实验均得到北京协和医学院阜外心血管病医院动物委员会的批准,所有操作均按照《北京实验动物管理条理(1996)》的相关规定进行。
1.2 主要试剂和仪器 细胞转染的miRNA 前体Pre-miRTMmiR-24 Precursor 或抑制剂Anti-miRTMmiR-24 Inhibitors,及转染试剂脂质体siPORT NeoFX Transfection Agent 均由ABI 合成;组织转染miRNA慢病毒由上海吉凯生物有限公司合成;qRT-PCR 试剂Power SYBR green PCR master mix、TaqMan Universal PCR Mix、TaqMan microRNA Assay 均购自ABI;MMLV 逆转录酶、Caspase-Glo® 3/7 Assay 购自Promega,TUNEL 染色试剂盒(Roche),Genbox 厌氧产气包(Biomerieux),DAPI 细胞核染液(碧云天生物技术研究所);小动物超声心动图仪(Visualsonics),12 MHz 频率超声探头(Philips);小动物呼吸机(Harvard Apparatus);倒置相差/荧光显微镜(Olympus);ABI-7300 荧光实时定量PCR 仪(ABI);CO2恒温细胞培养箱(Napco 5410-220)。
2 方法
2. 1 小鼠心肌梗死模型的制备及转染 雄性C57BL/6 小鼠25 ~30 g 用2%水合氯醛(100 mg/kg)腹腔注射麻醉。直视下气管切开,小动物呼吸机辅助呼吸,潮气量7 ~8 mL,呼吸频率每分钟120 次,呼吸比1∶2。左第4 肋间入胸,识别前降支走行范围,7/0 滑线结扎前降支,当左心室前壁部分颜色转为苍白且出现心电图示波为心肌梗死表现时确认本模型制作成功。转染用慢病毒由上海吉凯生物有限公司合成,慢病毒构建方法参见参考文献[6],小鼠心梗模型随机分为假手术组、空载体组(携带GFP 的慢病毒空载体以4 ×107TU 的病毒数进行心肌组织局部注射转染,n=53)、miR-24 转染组(携带miR-24 的慢病毒,以4 ×107TU 的病毒数进行心肌组织局部注射,n=35)及单纯心肌梗死组(n=21)。
2.2 小动物心脏超声心动图检测 心梗后2 周,异氟醚吸入麻醉动物,取仰卧位。使用Vevo 770 High-Resolution Imaging System 超声仪,探头频率为RMV 704(40 MHz )。取左室乳头肌水平二维左室短轴切面,记录左室收缩期末径及左室舒张期末径,由超声心动图电脑自动计算左室射血分数(left ventricular ejection fraction,LVEF)和左室短轴缩短率(left ventricular fractional shortening,LVFS),取连续3 个心动周期的平均值。
2.3 乳鼠心肌细胞的转染及缺血缺氧模型 取新生1 ~3 d SD 大鼠乳鼠,无菌条件下剔出心脏,去除心房、大血管等结缔组织,加入配置的胰酶心肌细胞消化液进行消化;收集组织消化悬液离心,弃上清,用含10%FBS 的DMEM 培养液重悬细胞,进行心肌细胞培养,详细方法参见参考文献[7]。按5 ×104/cm2的密度接种至细胞培养瓶或培养板。用siPORT转染miRNA 到心肌细胞,转染后12 h 进行缺血缺氧处理[7],转染方法按照ABI 公司实验操作流程进行,转染终浓度为30 μmol/L。心肌细胞缺血缺氧方法,将心肌细胞培养液置换为无血清DMEM 培养基,并将培养皿放于缺氧罐内,在缺氧罐中放置Genbox 厌氧产气包,制造缺血缺氧模型,最后将缺氧罐放置于37 ℃5% CO2培养箱中进行培养,缺血缺氧后48 h收集细胞进行下一步的实验。miRNA 转染心脏心肌细胞功能研究实验分组:正常未处理组(培养条件同处理组)、miRNA 转染对照组(30 μmol/L)和miR-24前体或抑制剂转染组(30 μmol/L)。
3 实验指标的检测
3.1 心肌组织Masson 染色病理学检测 石蜡切片常规脱蜡入水,双蒸水洗。蒸馏水冲洗干净入Ⅰ液染2 min;再次蒸馏水流水冲洗干净,入II 液染15 min;液染5 min(苯胺蓝2.5 g,冰乙酸2 mL,蒸馏水100 mL)。1%冰乙酸溶液浸洗5 min。梯度乙醇脱水,入二甲苯,中性树脂封片。
3.2 心肌细胞caspase-3/7 活性测定 培养的心肌细胞约为4 ×107/L,96 孔板,待测各孔添加100 μL细胞悬液。将caspase-Glo 试剂按照1∶1 原则加入各孔中。300 ~500 r/min 的转速轻柔混匀30 秒,室温(18 ~22 ℃)孵育2 h。孵育后的样品板放入VeritasTM发光检测仪中,检测每个样品的荧光值,进行数据分析。
3.3 TUNEL 染色石蜡包埋组织切片检测 常规脱蜡处理组织切片,梯度乙醇浸洗,滴加蛋白酶K 溶液,室温孵育。滴加100 μL 1 ×TdT 平衡缓冲液,室温孵育10 ~30 min。在每个样本上滴加60 μL TdT标记反应混合物。封口膜覆盖样本。于37 ℃孵育60 ~90 min。465 ~495 nm 波长绿色荧光激发并对被标记的凋亡细胞进行分析。
3.4 实时定量PCR miRNA 检测 以心肌梗死边带为标志,区分心梗区、心梗周边区及远心梗区[8],抽提组织RNA 后,利用TaqMan MicroRNA Assay Kit 中的特异性茎环逆转录引物和TaqMan MicroRNA Reverse Transcript Kit 对单种类型的miRNA 进行特异性的逆转录反应,合成相应的miRNA-茎环引物cDNA。利用TaqMan MicroRNA Assay Kit 中的TaqMan探针和miRNA 特异引物进行实时荧光定量PCR 反应(TaqMan qPCR),检测miRNA 表达水平。以U6 snRNA 为内参,反应体系为20 μL,2-ΔΔCt方法计算目标miRNA 的相对表达水平。定量反应条件为95 ℃10 min,扩增1 个循环,95 ℃15 s,扩增40 个循环,62℃1 min 扩增40 个循环,在每个循环的62 ℃时测定荧光。
3.5 表达谱芯片检测 心肌细胞转染miR-24 后表达谱芯片检测由北京博奥生物有限公司完成,使用Affymetrix 生物芯片检测技术,分别对miR-24 过表达转染组及对照组进行检测,每组进行2 次实验,具体方法按照CapitalBio 公司实验操作流程进行。差异表达基因符合以下标准:(1)符合表达基因的判定标准;(2)两组间基因点信号比值>1.5 或<0.5。获得表达谱芯片结果后,删除荧光信号弱的基因及没有基因名称的基因,以1.5 倍标准筛选基因,以TargetScan 6.2 网络数据库为参照进行生物信息学分析(http://www. targetscan. org/),获得miR-24 的可能作用靶点。
4 统计学处理
用SPSS 13.0 统计软件进行分析。数据以均数±标准差(mean ±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著差异法(LSD 法),以P <0.05 为差异有统计学意义。
结 果
1 心梗组织中miR-24 表达水平的变化
qRT-PCR 检测发现,相对于假手术组,心肌梗死区及心肌梗死周边区的miR-24 表达量明显下调,这种下调在1 周左右达高峰(P <0.01),在2 周时与假手术组比较仍有显著差异(P <0.01),在4 周左右恢复到假手术组水平,见图1。

Figure 1. miR-24 was down-regulated in different areas of the hearts after MI. miRNAs were isolated in different areas of the infracted heart and sham-operated hearts 1,2,and 4 weeks after MI. qRT-PCR was performed to determine the level of miR-24. IA:infarct area;BA:border area. Mean ± SD. n =3. **P <0.01 vs sham group.图1 小鼠心梗后局部组织miR-24 表达水平降低
2 miR-24 转染改善心梗后心功能
构建miR-24 慢病毒,心肌内局部注射过表达miR-24,转染慢病毒后3 d,用qRT-PCR 方法检测转染局部miR-24 表达水平,结果发现转染miR-24 慢病毒后局部miR-24 表达水平较对照组升高(3. 98 ±0.50)倍(P <0.01),见图2。超声心动图显示,转染miR-24 能显著改善心梗后2 周小鼠心功能,心梗模型各组心功能较正常假手术组有明显减低(P <0.01);miR-24 转染组(LV-miR-24)与空白慢病毒转染组(LV-GFP)比较,LVEF 和LVFS 明显升高(P <0.05),miR-24 转染组左室收缩末内径较空白慢病毒转染组下降(P <0.05),而miR-24 转染组左室舒张末内径与空白慢病毒转染组间无明显差异(P >0.05),见表1。
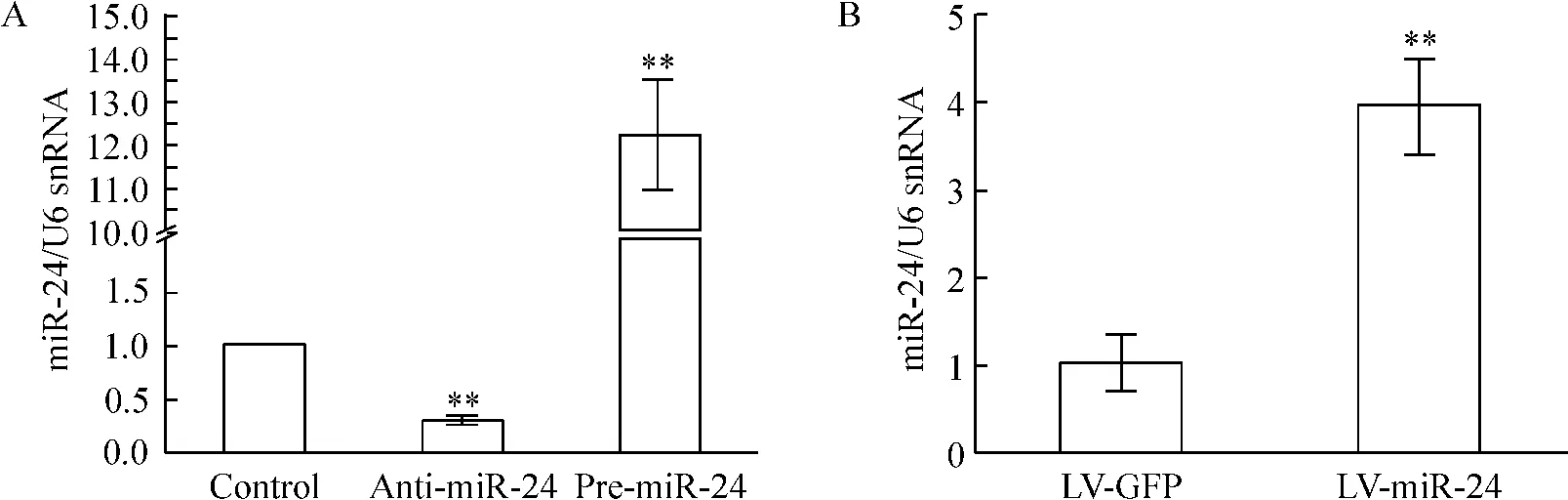
Figure 2. Expression of miR-24 in vivo and in vitro detected by qRT-PCR. A:cardiomyocytes (in vitro);B:border area (in vivo).Mean±SD. n=3. **P <0.01 vs control or LV-GFP.图2 组织及细胞水平转染miR-24 的表达情况
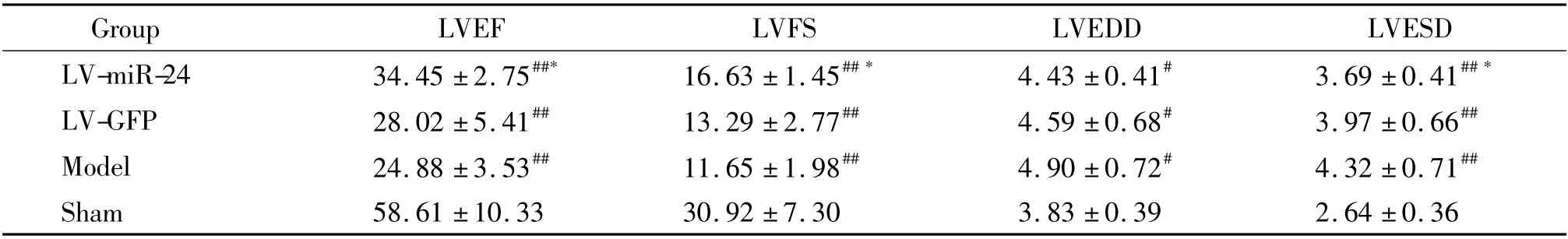
表1 miR-24 改善心梗后心功能Table 1. miR-24 improved heart functions after MI (mean±SD.n=9)
3 miR-24 转染减少心梗面积
以上述携带miR-24 慢病毒转染后的心梗模型,用Masson 染色方法检测miR-24 转染组及对照组心梗面积,结果发现miR-24 转染能减少心梗2 周后心梗面积36.9%(P <0.01),并且转染miR-24 后小鼠心梗区域的瘢痕组织明显增厚,局部膨出减少,见图3。
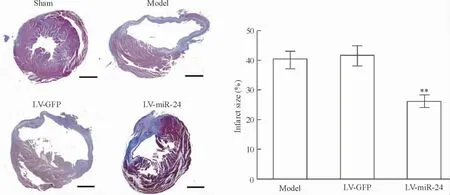
Figure 3. Lentiviral-mediated miR-24 transfection in vivo results in reduced scar formation after MI (Masson's trichrome staining,scale bar=1 mm). LV-GFP:lentiviral-GFP;LV-miR-24:lentiviral-miR-24.Mean±SD.n=6. **P <0.01 vs model.图3 miR-24 转染减少心梗后心梗面积
4 miR-24 转染减少心梗区域细胞凋亡
心梗模型组织局部转染miR-24,于心梗后1 周,使用TUNEL 组织染色检测细胞凋亡情况,结果提示局部转染miR-24 能明显减少TUNEL 染色阳性细胞,抑制局部组织细胞凋亡,见图4。

Figure 4. miR-24 decreased cell apoptosis in MI model (TUNEL staining). Upper figures:bar =100 μm;green indicates TUNEL positive cells,white arrows denote TUNEL positive areas. Lower figures:bar =50 μm;brown indicates TUNEL positive cells.图4 miR-24 转染减少心梗区域凋亡细胞数量
5 心肌细胞转染miR-24 减少缺血缺氧造成的心肌细胞凋亡
对乳鼠心肌细胞应用脂质体转染pre-miR-24 前体或anti-miR-24 抑制剂,qRT-PCR 检测心肌细胞转染效率,结果提示miR-24 前体能将心肌细胞miR-24表达水平升高到(12.2 ±1.3)倍(P <0.01),而miR-24 抑制剂则能将心肌细胞miR-24 表达水平降低到(29 ±4)%(P <0.01),见图2。将转染miR-24 后心肌细胞进行缺血缺氧处理,结果提示在心肌细胞过表达miR-24 能减少缺血缺氧诱导的心肌细胞凋亡,较对照组有显著差异(P <0.01),而转染miR-24 抑制剂则轻度增加心肌细胞在缺血缺氧条件下的凋亡(P <0.05),见图5。
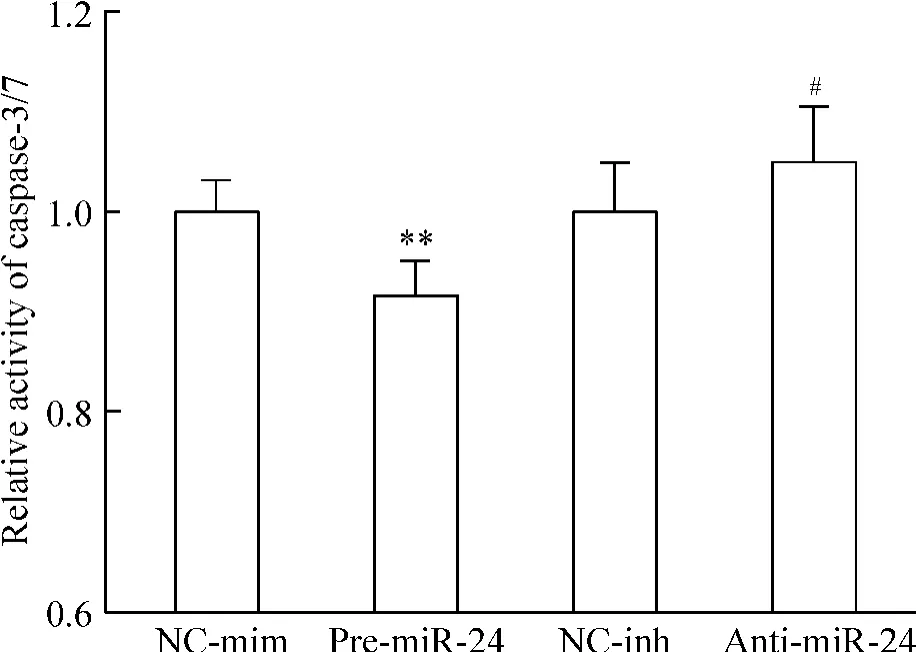
Figure 5. miR-24 inhibited cardiomyocyte apoptosis induced by hypoxia and serum deprivation. Cardiomyocytes transfected with pre-miR-24 mimic or anti-miR-24 inhibitor were treated with hypoxia and serum deprivation for 48 h. Caspase-3 and-7 activity was assayed by Caspase-Glo luminescence assay.NC-mim:negative mimic control;NC-inh:negative inhibitor control. Mean ±SD.n=9. **P <0.01 vs NC-min;#P <0.05 vs NC-inh.图5 miR-24 抑制缺血缺氧造成的心肌细胞凋亡
6 表达谱芯片检测miR-24 作用靶点
为明确miR-24 调控心肌细胞凋亡的具体作用靶位点,通过表达谱芯片检测miR-24 转染组及对照组心肌细胞mRNA 表达水平的差异。结果提示miR-24 转染组相对对照组有49 个基因的表达水平达到1.5 倍以上升高,216 个基因表达水平0.5 倍以上降低。通过对miRNA 靶点数据库TargetScan 的生物信息学分析,发现miR-24 的作用靶点中凋亡相关基因BCL2L11、ANK3 和SGPL1 的表达水平均下降,并且这3 个基因具有与miR-24 的保守结合位点,见图6。
讨 论
心肌细胞缺血缺氧造成的心肌细胞凋亡是心肌梗死后心功能不全,心衰的关键作用因素,如何减少心肌细胞在缺血缺氧条件下的凋亡成为现今心肌梗死研究的关键。本实验以小鼠心肌梗死模型为体内研究对象,以乳鼠心肌细胞缺血缺氧模型为体外研究对象,来研究miR-24 对心肌细胞缺血缺氧后凋亡水平的调控作用,并对其可能作用靶位点进行检测和分析。现今多种细胞被使用来进行心肌细胞凋亡水平的研究,包括大鼠H9c2 细胞系、大鼠乳鼠原代细胞及小鼠心肌细胞,而大鼠乳鼠心肌细胞又以其收集培养技术的成熟稳定被广泛采用,而国内外相关心肌组织及细胞实验也大都采用小鼠心脏模型加大鼠乳鼠心肌细胞原代模型进行检测[9]。
近年来的研究发现,miRNAs 作为一种转录后调控因子,能够同时靶向作用于多个不同通路中相关蛋白质的信使RNA,从转录水平或转录后水平调节基因表达[10],进而从整体水平实现对细胞内多种因子的表达乃至多条信号通路的“网状”调控[11]。在心脏中miRNA 也被发现能调节心肌各种病理生理过程,包括心脏重塑、心脏发育、心肌纤维化、血管再生及心肌细胞凋亡[4,12]。现今已发现miR-499 能通过P53 通路作用于心肌细胞缺血再灌注损伤导致的凋亡,miR-21 通过抑制过氧化氢来调控心肌细胞死亡和凋亡[13]。本研究发现miR-24 能通过减少心肌细胞在缺血缺氧条件下的凋亡水平来改善心肌梗死后心脏重塑。miR-24 是一种在心肌组织中高表达的miRNA,在肿瘤细胞中,研究表明miR-24 能够作用于DND1 蛋白,进而减少肿瘤细胞凋亡水平[14]。本实验发现miR-24 在心肌梗死组织中表达量降低,心梗组织中转染过表达miR-24 能够减少心梗面积,改善心功能,并且在心肌细胞缺血缺氧模型中过表达miR-24 同样能抑制心肌细胞凋亡水平。

Figure 6. Possible targets of miR-24. A:hierarchical clustering of 265 mRNAs expressed in pre-miR-24 and control groups. The gene expression levels are represented by using a green-red color scheme,with the green corresponding to lower than median expression levels,the black corresponding to equal to median,and the red corresponding to higher than median expression levels. The scale indicates log10 ratio values. B:predicting putative miR-24 binding sites to apoptosis-regulating genes (potential complementary residues shown in red)by TargetScan.图6 miR-24 作用于心肌细胞凋亡的可能靶位点
本实验采用慢病毒心肌内局部注射的方式进行转染。许多方法都被使用转染miRNA,比如微环,腺病毒、寡核苷酸、antagomir 和慢病毒。脂质体转染起效快,但相对维持时间较短,而慢病毒能稳定持续地表达miRNA,并能较长时间维持表型变化,近期文献报道慢病毒心肌内直接注射介导基因转染,产生的炎症和免疫反应较低,具有很好的组织相容性,动物模型的死亡率没有变化[15]。本实验也发现慢病毒载体能有效转染miRNA,并引起的毒副作用较小。
表达谱芯片由于其高灵敏度、高通量等优点被广泛使用检测基因表达水平的变化,本研究通过对miR-24 作用靶点的表达谱芯片检测及生物信息学分析,发现miR-24 可引起心肌细胞大量基因表达的变化,而相关凋亡调控,其可能作用于3 个凋亡相关基因BCL2L11、ANK3 和SGPL1。其中bcl-2 基因已被证明与细胞凋亡水平相关[16]。由于miRNA 作用靶点的多样性,miR-24 可能通过一个或多个靶点基因作用于心肌细胞凋亡过程。
miRNA 不同于普通的蛋白受体阻滞剂,它能在整体上调控疾病进程,能成为良好的治疗作用靶点,现已有部分临床及临床前实验开展,取得了一定的成效。本研究发现miR-24 能作用于心肌细胞缺血缺氧条件下的凋亡过程,进而改善心梗后心功能,为临床心梗治疗提供了新的治疗靶点,也为miRNA 的功能提供了新的作用机制。
[1] Qiu H,Liu JY,Wei D,et al. Cardiac-generated prostanoids mediate cardiac myocyte apoptosis after myocardial ischaemia[J]. Cardiovasc Res,2012,95(3):336-345.
[2] Abbate A,Narula J. Role of apoptosis in adverse ventricular remodeling[J]. Heart Fail Clin,2012,8(1):79-86.
[3] 莫 倩,李 丹,凌文华,等. miR-18a 对人主动脉内皮细胞血管生成能力的影响[J]. 中国病理生理杂志,2012,28(7):1187-1191.
[4] Latronico MV,Condorelli G. MicroRNAs and cardiac pathology[J]. Nat Rev Cardiol,2009,6(6):419-429.
[5] Qin W,Shi Y,Zhao B,et al. miR-24 regulates apoptosis by targeting the open reading frame (ORF)region of FAF1 in cancer cells[J]. PLoS One,2010,5(2):e9429.
[6] 晏 浩,徐建军,李文林,等.MicroRNA-30a 调控Beclin-1 对缺氧复氧乳鼠心肌细胞的保护效应[J].中国病理生理杂志,2012,28(4):583-588.
[7] 夏文静,黄艺仪,何建桂,等.急性心肌缺氧对乳鼠心肌细胞脑钠尿肽表达的影响及其作用机制[J].中国病理生理杂志,2012,28(5):852-857.
[8] van Rooij E,Sutherland LB,Thatcher JE. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J]. Proc Natl Acad Sci U S A,2008,105(35):13027-13032.
[9] Wang JX,Jiao JQ,Li Q,et al. miR-499 regulates mitochondrial dynamics by targeting calcineurin and dynaminrelated protein-1[J]. Nat Med,2011,17(1):71-78.
[10] 张 帅,李有杰,张 超,等. miRNA 在去甲斑蝥素致K562 细胞凋亡中的作用研究[J].中国病理生理杂志,2011,27(3):499-503.
[11] Gladka MM,da Costa Martins PA,De Windt LJ. Small changes can make a big difference-microRNA regulation of cardiac hypertrophy[J]. J Mol Cell Cardiol,2012,52(1):74-82.
[12]魏 聪,胡 兵,申 锷,等.MicroRNAs 在心脏发育和疾病中的作用[J]. 中国病理生理杂志,2011,27(3):611-615.
[13] Zhu H,Fan GC. Role of microRNAs in the reperfused myocardium towards post-infarct remodelling[J]. Cardiovasc Res,2012,94(2):284-292.
[14]Liu X,Wang A,Heidbreder CE,et al. MicroRNA-24 targeting RNA-binding protein DND1 in tongue squamous cell carcinoma[J]. FEBS Lett,2010,584(18):4115-4120.
[15]Yoshimitsu M,Higuchi K,Dawood F,et al. Correction of cardiac abnormalities in fabry mice by direct intraventricular injection of a recombinant lentiviral vector that engineers expression of α-galactosidase A[J]. Circ J,2006,70(11):1503-1508.
[16] Singh R,Saini N. Downregulation of BCL2 by miRNAs augments drug-induced apoptosis:a combined computational and experimental approach[J]. J Cell Sci,2012,125(Pt 6):1568-1578.
