姜黄素衍生物T83 对同源不同辐射抗性鼻咽癌细胞凋亡的作用*
2013-12-23王梦瑶王苏美左应林王杜娟王春华卜宪章杨惠玲
王梦瑶, 王苏美, 左应林, 王杜娟, 刘 琴, 王春华, 卜宪章, 杨惠玲△
(1中山大学中山医学院病理生理学教研室,广东 广州510080;2中山大学药学院,广东 广州510275)
鼻咽癌(nasopharyngeal carcinoma,NPC)高发于中国南方地区,具有明显的地区性和家族聚集性[1]。放疗为鼻咽癌的首选疗法,但由于放疗耐受等导致30% ~40%病人发生局部复发和远处转移,严重影响放疗病人的预后[2],因此寻找可抑制鼻咽癌细胞活性且逆转辐射抗拒的小分子化合物,是提高鼻咽癌病人5 年生存率的关键。本课题组卜宪章等合成的4-芳甲叉类等姜黄素衍生物,初筛结果显示其具有广谱抗癌活性,其中包括对CNE-2 细胞生长的抑制作用[3],而4-芳甲叉类姜黄素衍生物T83 是否具有逆转辐射抗拒的作用尚未见报道。本实验拟采用MTT 法、Hoechst 33342 染色法结合荧光显微镜、流式细胞术、Western blotting 和qRT-PCR 方法检测和比较T83 对本实验室构建的同源不同辐射抗拒的鼻咽癌细胞CNE-2R[4]和CNE-2 细胞活力、细胞凋亡及线粒体膜电位、线粒体凋亡通路相关凋亡蛋白和细胞PTEN/Akt/p27 mRNA 水平等的影响,以阐明T83 抑制鼻咽癌细胞活性且逆转辐射抗拒的作用及信号转导通路,为逆转鼻咽癌辐射抗拒的治疗提供新靶点和潜在抗癌制剂。
材 料 和 方 法
1 材料
1.1 细胞 低分化鼻咽癌细胞株CNE-2 购自中山大学实验动物中心;鼻咽癌辐射抗拒细胞株CNE-2R为本实验室构建。
1.2 药物及实验试剂 T83 由中山大学药学院卜宪章实验室合成。RPMI-1640 培养基购自Gibco;新生牛血清购自杭州四季青生物工程材料有限公司;四甲基偶氮唑盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide,MTT]、二甲基亚砜(dimethyl sulfoxide,DMSO)和罗丹明123(rhodamine 123,Rh123)均购自Sigma;Hoechst 33342 购自Life Technologies;膜连蛋白V(Annexin Ⅴ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒购自罗氏公司;procaspase-3、细胞色素C(cytochrome C,Cyt-C)鼠抗人单克隆抗体和HRP 标记的羊抗鼠IgG 均购自Cell Signaling Technologies;procaspase-9 鼠抗人单克隆抗体购自Santa Cruz Biotechnology;β-actin 鼠抗人单克隆抗体购自Sigma;Trizol reagent 购自Invitrogen。
1.3 实验仪器 SUNRISE 全自动酶标仪购自Tecan;IX71 倒置荧光显微镜购自Olympus;流式细胞仪购自Becton Dickinson;分光光度计购自Thermo。
2 方法
2.1 细胞培养 CNE-2R 和CNE-2 细胞用含10%新生牛血清、青-链霉素的RPMI-1640 细胞培养基,置于37 ℃、5%CO2、饱和湿度条件下培养。取对数生长期细胞进行实验。
2.2 MTT 法检测鼻咽癌细胞的活性 用胰酶(2.5 g/L)消化对数生长期细胞,接种于96 孔板(密度为3 ×103cells/well),每孔200 μL。贴壁12 h,实验组各孔分别加入药物200 μL,T83 终浓度为0.05、0.15、0.3、0.5 和0.7 μmol/L,对照组加入含0.2%DMSO 的培养基200 μL/well,空白组加入培养基200 μL/well,每组设8 孔,重复3 次。药物作用24、48 和72 h 后,加入20 μL MTT(5 g/L)溶液,在37 ℃、5%CO2条件下孵育3.5 h。吸出各孔中液体,加入150 μL DMSO,振荡5 ~10 min 使结晶物充分溶解。在酶联免疫检测仪波长为570 nm 处测量各孔的吸光度(A)值。细胞生存率(%)=A处理组/(A处理组-A空白组)×100%。
2.3 Hoechst 33342 染色结合荧光显微镜观测鼻咽癌细胞凋亡的形态 接种细胞于6 孔板(密度为2 ×105cells/well),0.3 和0.6 μmol/L T83 作用48 h 后,PBS 洗2 遍,用甲醇固定20 min 后Hoechst 33342 染色15 min,倒置荧光显微镜下观察并拍照。
2.4 Annexin Ⅴ/碘化丙啶( propidium iodide,PI) 双染色结合流式细胞仪检测鼻咽癌细胞的凋亡 接种细胞于6 孔板(密度为2 ×105cells/well),0.1、0.2 和0.4 μmol/L T83 作用48 h 后,用无EDTA 胰酶消化收集细胞,PBS 洗2 遍离心弃上清,用Annexin Ⅴ/PI双染色标记法检测细胞凋亡百分率。
2.5 Rh123 染色结合流式细胞术检测鼻咽癌细胞的线粒体膜电位 接种细胞于6 孔板(密度为2 ×105cells/well),0.4 和0.8 μmol/LT83 作用36 h 后,用无EDTA 胰酶消化收集细胞,PBS 洗2 遍离心弃上清,将细胞重悬于0.2 mL 的5 g/L Rh123 染液中,37℃避光染色30 min,用流式细胞术检测细胞线粒体膜电位。
2.6 Western blotting 法检测鼻咽癌细胞procaspase-3/procaspase-9/Cyt-C 的蛋白表达水平 0.2、0.4 和0.8 μmol/L T83 作用48 h 后,收集全蛋白细胞蛋白标本,常规BCA 方法蛋白定量。制备15%聚丙烯酰胺凝胶,进行SDS-PAGE 电泳(1. 5 ~2 h),转移到PVDF 膜(60 min),室温5%BSA 封闭1 h,加Ⅰ抗孵育PVDF 膜4 ℃过夜,TBST 洗膜3 次,加Ⅱ抗孵育60 min,TBST 洗膜3 次,ECL 发光液显色曝光,Quantity One 软件分析结果,以β-actin 为内参照。
2.7 qRT-PCR 检测鼻咽癌细胞PTEN/Akt/p27 的mRNA 水平 0.2 和0.4 μmol/L T83 作用24 h 后,用Trizol 提取总RNA 并用分光光度计检测其RNA的纯度和浓度。按照Invitrogen 公司的qRT-PCR 试剂盒说明书,进行RNA 反转录和扩增,2-ΔΔCt方法进行实时定量检测分析,以β-actin 为内参照。PTEN 的引物:正义链5'-TGGATTCGACTTAGACTTGACCT-3',反义链5'-TTTGGCGGTGTCATAATGTCTT-3';Akt 的引物:正义链5'-TCTTTGCCGGTATCGTGT-3',反义链5'-TGTCATCTTGGTCAGGTGGT-3';P27 的引物:正义链5'-CGAGATCTGATGTCAAACGTGCGAGT-3',反义链5'-CTGAATTCTTGACGTCTTCTGAGGCC-3'。
3 统计学处理
采用SPSS 16.0 进行统计处理,数据以均数±标准差(mean ±SD)或均数±标准误(mean ±SEM)表示,连续型数据的组间比较采用单因素方差分析(One-way ANOVA),离散型数据的组间比较采用χ2检验,以P <0.05 为差异有统计学意义。
结 果
1 T83 对NPC 细胞活性的影响
T83 作用24、48 和72 h 后,NPC 细胞的存活率见表1。采用IC50软件统计得到T83 作用于CNE-2R 细胞的IC50分别为0.90、0.40 和0.20 μmol/L,作用于CNE-2 细胞的IC50分别为1.80、0.50 和0.40 μmol/L,T83 对CNE-2R 细胞活性抑制作用明显于CNE-2 细胞,且对2 种细胞均呈剂量时间依赖性。
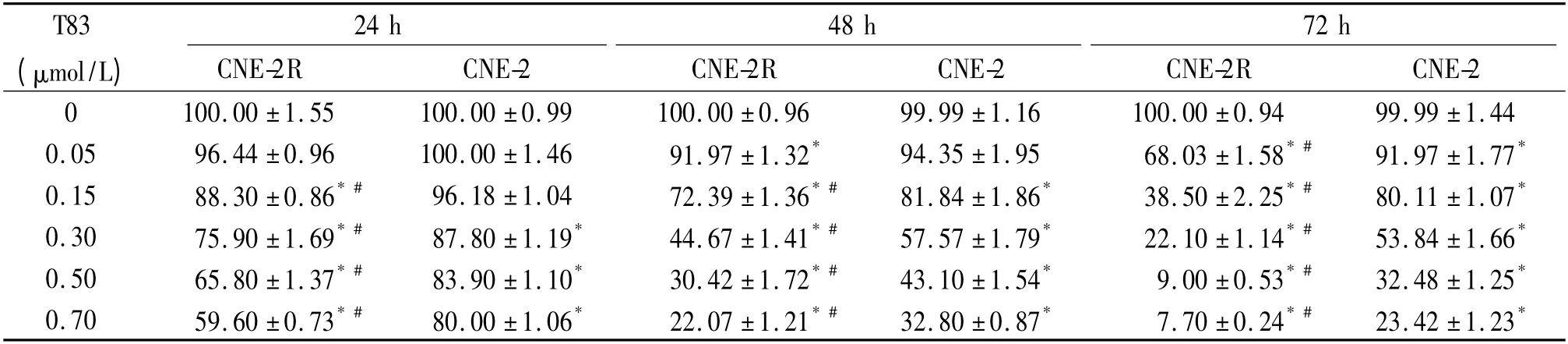
表1 T83 对CNE-2R 和CNE-2 细胞活性的影响Table 1. Effect of T83 on the viability of CNE-2R and CNE-2 cells (%.Mean±SEM. n=3)
2 T83 对NPC 细胞凋亡形态的影响
Hoechst 33342 染色结果显示,T83 作用48 h 后可使NPC 细胞出现凋亡形态学改变。随着药物浓度的升高细胞核体积明显减小,核形态发生变化,如染色质浓缩、边集和染色质分割成块状;对照组细胞核形态完整,见图1。
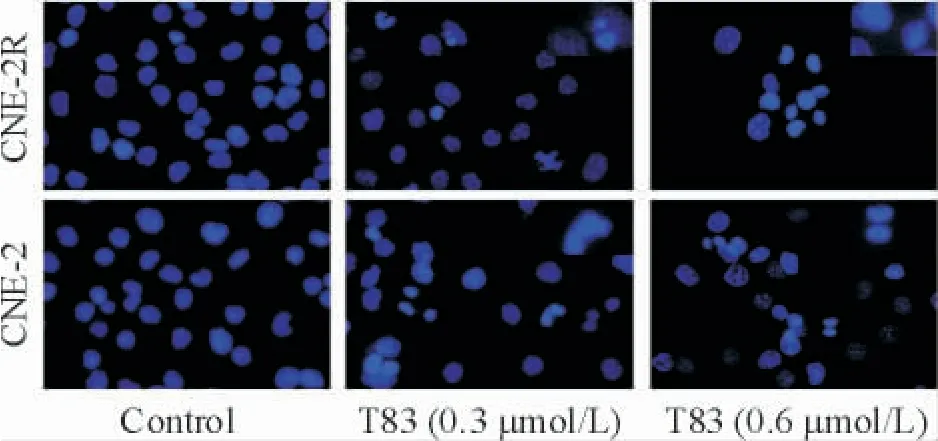
Figure 1. Effects of T83 on the apoptotic morphology of CNE-2R and CNE-2 cells (Hoechst 33342 staining,× 200;magnification in the upper right images,×400).图1 T83 对CNE-2 和CNE-2R 细胞凋亡形态的影响
3 T83 对NPC 细胞凋亡的影响
流式细胞术检测结果见图2、3,T83 作用48 h 对CNE-2R 和CNE-2 细胞具有剂量依赖性地诱导凋亡的作用,并以晚期凋亡为主。高剂量组中,CNE-2R细胞的晚期凋亡率为27.26%,明显高于CNE-2 细胞的8.15%,差异显著,说明T83 可较特异地加速CNE-2R 细胞凋亡。
4 T83 对NPC 细胞线粒体膜电位的影响
流式细胞术检测结果见图4,T83 作用36 h 可诱导CNE-2R 和CNE-2 细胞线粒体膜电位下降且呈剂量依赖性。0.4 和0.8 μmol/L T83 使CNE-2R 细胞线粒体膜电位下降率分别为56. 08% 和87. 71%,CNE-2 细胞分别为20.48%和50.47%;2 株细胞处理组和对照组比差异显著;在相同药物浓度下2 株细胞的线粒体膜电位降低率差异显著。
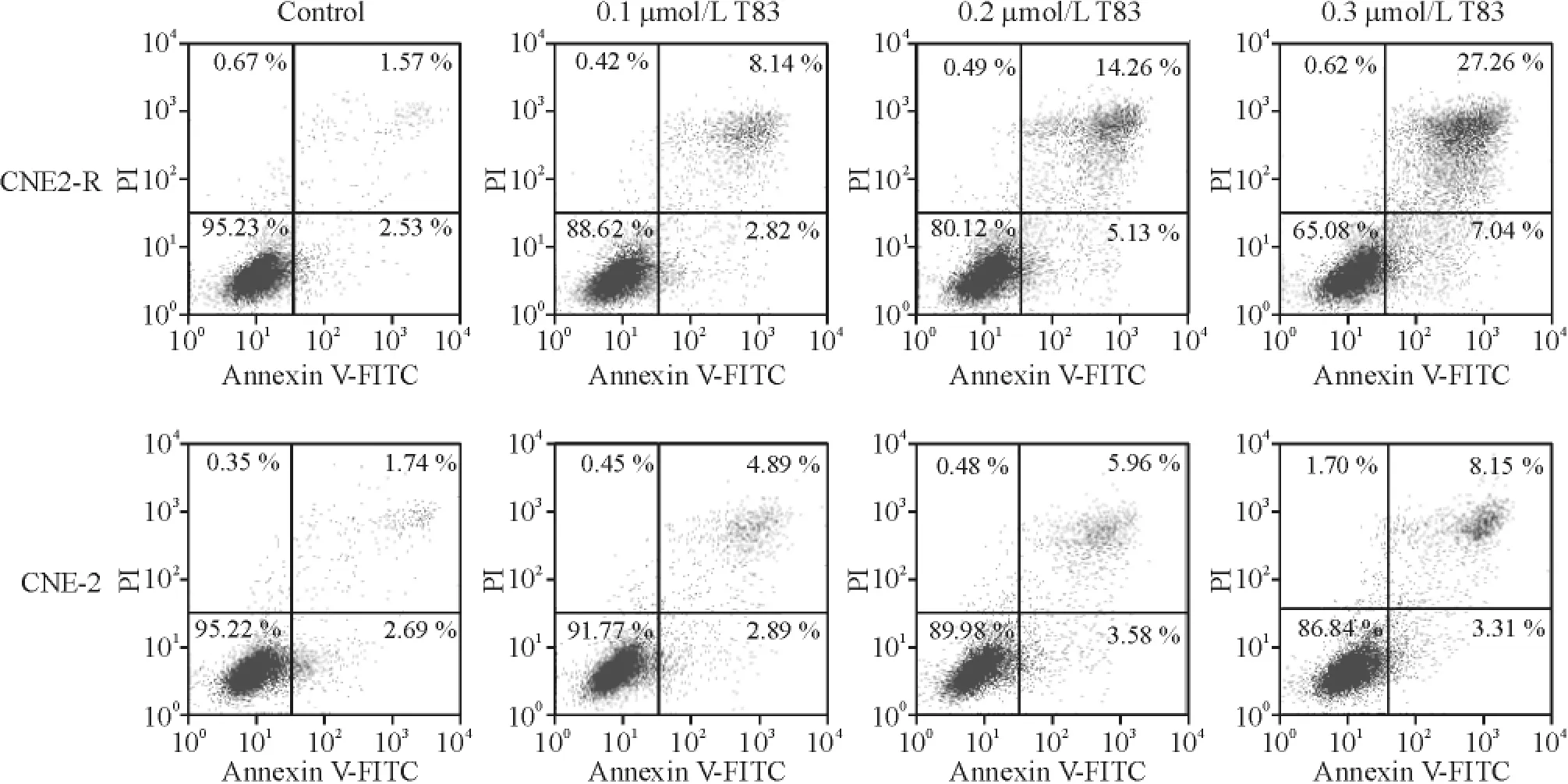
Figure 2. Effects of T83 on the apoptosis of CNE-2R and CNE-2 cells.Upper right:late apoptosis;lower right:early apoptosis;lower left:viable cell.图2 T83 对CNE-2R 和CNE-2 细胞凋亡的影响
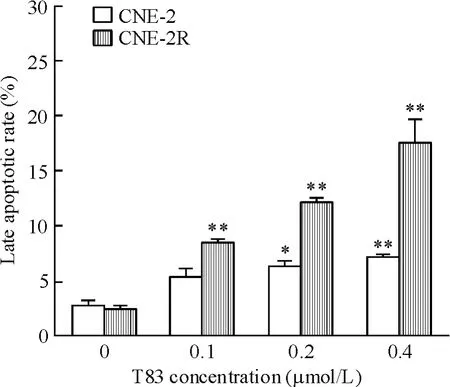
Figure 3. Effects of T83 on the late apoptotic rates of CNE-2R and CNE-2 cells. Mean ± SD. n = 3. * P <0. 05,**P <0.01 vs 0 μmol/L.图3 T83 对CNE-2R 和CNE-2 细胞晚期凋亡的影响
5 T83 对NPC 细胞procaspase-3/procaspase-9/Cyt-C 蛋白表达的影响
Western blotting 检测结果见图5,T83 作用48 h后,CNE-2R 和CNE-2 细胞中procaspase-3 和procaspase-9 蛋白表达水平呈剂量依赖性降低,且在CNE-2R 细胞中更加显著;Cyt-C 蛋白表达水平呈剂量依赖性升高,且低剂量组中,CNE-2R 细胞的Cyt-C蛋白表达已有明显升高。
6 T83 对NPC 细胞PTEN/Akt/p27mRNA 的影响
qRT-PCR 检测结果见图6 ~8,T83 作用24 h 后,CNE-2R 和CNE-2 细胞中PTEN 和p27 mRNA 水平呈剂量依赖性升高,且在CNE-2R 细胞中T83 浓度为0.4 μmol/L 时两者的mRNA 水平显著升高;在2 株细胞中Akt mRNA 水平呈剂量依赖性降低,处理组与对照组相比差异显著。
讨 论
大量研究证明姜黄素衍生物利用度低和代谢速度快等缺点限制其在抗癌治疗中的应用[5],近年来结构稳定且抗癌活性更加显著的姜黄素衍生物对肿瘤细胞作用的研究已成为研究者关注的焦点[5-6],但各类衍生物的抗癌活性和作用机制不相同[7]。我们已合成一系列姜黄素衍生物,同时研究结果显示4-芳甲叉类姜黄素衍生物具有广谱抗癌活性,通过抑制NF-κB 和Akt 通路活性而抑制肺癌细胞的生长[3],但姜黄素衍生物是否具有逆转辐射抗拒的作用尚未见报道。我们的研究结果首次揭示T83 可较特异抑制辐射抗拒鼻咽癌细胞的活性,且具有时间剂量依赖性。虽然本研究结果与本实验室报道的单羰基姜黄素衍生物B50 和B67[5,8]的作用相似,但与B50 和B67 作用CNE-2R 和CNE-2 细胞24、48 和72 h 后的IC50(B50:8.06、2.49 和1.42 μmol/L,8.18、3.00 和1.75 μmol/L;B67:3.96、2.59 和0.89 μmol/L,8.84、3.55 和1.10 μmol/L)比,T83 的IC50明显降低(0.90、0.40 和0.20 μmol/L,1.80、0.50 和0.40 μmol/L),这表明T83 较其它类姜黄素衍生物具有更强的抗癌活性和更好的逆转辐射抗拒的作用,提示T83 是一种更具有逆转鼻咽癌辐射抗拒的潜在抗癌制剂。
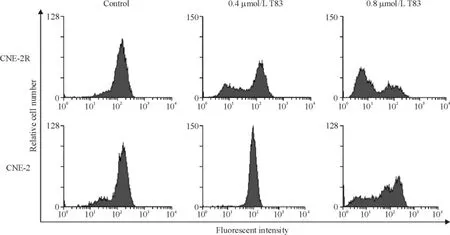
Figure 4. Effects of T83 on mitochondrial membrane potential of CNE-2R and CNE-2 cells.图4 T83 对CNE-2R 和CNE-2 细胞线粒体膜电位的影响
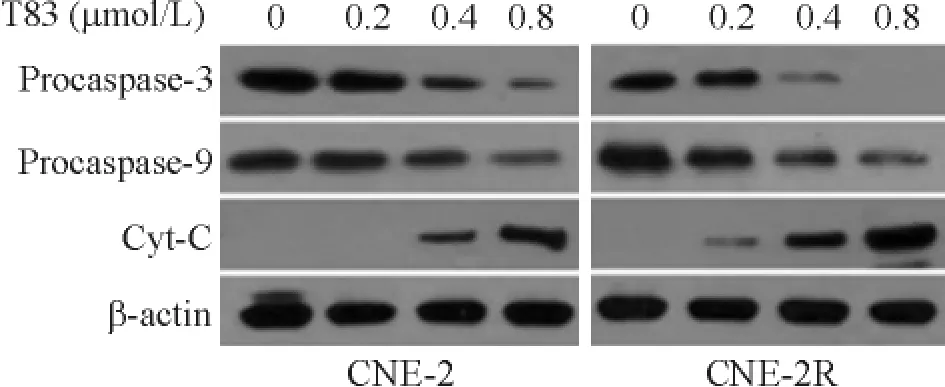
Figure 5. Effects of T83 on procaspase-3,procaspase-9 and Cyt-C protein expression in CNE-2R and CNE-2 cells.图5 T83 对CNE-2R 和CNE-2 细胞procaspase-3,procaspase-9,Cyt-C 蛋白表达的影响
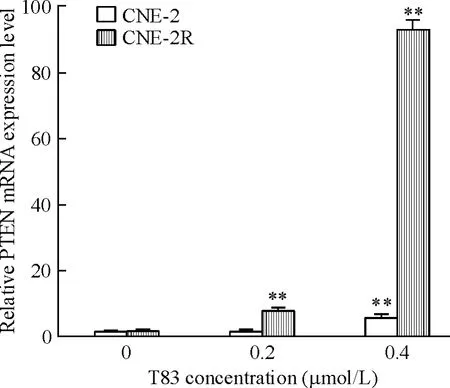
Figure 6. Effect of T83 on PTEN mRNA expression in CNE-2R and CNE-2 cells. Mean ± SD. n =3. **P < 0. 01 vs 0 μmol/L.图6 T83 对CNE-2R 和CNE-2 细胞PTEN mRNA 的影响

Figure 7. Effect of T83 on Akt mRNA expression in CNE-2R and CNE-2 cells.Mean±SD.n=3.**P <0.01 vs 0 μmol/L.图7 T83 对CNE-R2 和CNE-2 细胞Akt mRNA 的影响
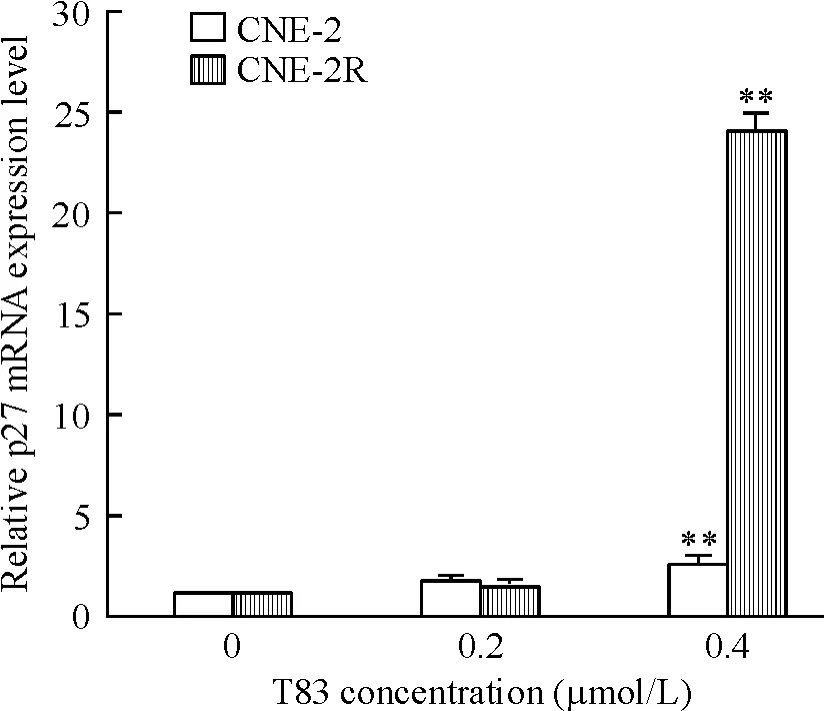
Figure 8. Effect of T83 on p27 mRNA expression in CNE-2R and CNE-2 cells. Mean ± SD. n =3. **P < 0. 01 vs 0 μmol/L.图8 T83 对CNE-2R 和CNE-2 细胞p27 mRNA 的影响
为阐明T83 对鼻咽癌细胞作用的细胞机制,我们通过荧光显微镜和流式细胞术观察鼻咽癌细胞形态学变化和检测细胞凋亡率,结果发现T83 作用48 h 后CNE-2R 和CNE-2 细胞出现明显染色质浓集、边集和染色质分割成块状等凋亡形态学改变;T83 作用48 h 后CNE-2R 和CNE-2 细胞凋亡率明显升高,以晚期凋亡为主,且以CNE-2R 细胞更为显著。同时我们通过流式细胞术检测T83 作用后2 株细胞的线粒体膜电位,结果发现CNE-2R 和CNE-2 细胞的线粒体膜电位显著下降,呈剂量依赖性,且以前者更为显著。进一步我们通过Western blotting 检测T83 作用后2 株细胞内线粒体凋亡途径相关蛋白表达的变化,结果发现CNE-2R 和CNE-2 细胞中procaspase-3和procaspase-9 蛋白水平降低,且在CNE-2R 细胞中更加显著;低剂量T83 即可诱导CNR-2R 细胞线粒体释放Cyt-C,引起Cyt-C 表达水平升高。这些结果与Wang 等[9]和Ren 等[10]的报道相似,我们认为T83 作用于CNE-2R 和CNE-2 细胞36 h 后,首先引起线粒体膜电位的下降,T83 作用48 h 时才出现明显的细胞凋亡形态和百分率的升高,因此说明线粒体膜电位的下降是凋亡的早期表现,一旦线粒体膜电位损耗,通过释放Cyt-C 等促凋亡蛋白,引起procaspase-9 的活化,进而激活其下游的procaspase-3 导致细胞进入不可逆的凋亡过程;同时说明T83 通过较特异地启动线粒体凋亡途径而诱导辐射抗拒鼻咽癌细胞凋亡。
大量研究报道了多种肿瘤的发生发展涉及PTEN/Akt/p27 信号转导通路的激活[11-12]。为进一步探讨T83 作用的分子机制,我们利用qRT-PCR 法检测PTEN/Akt/p27 mRNA 表达量,结果显示T83 作用24h 后,CNE-2R 和CNE-2 细胞中PTEN 和p27 mRNA 的表达明显增加,而Akt mRNA 的表达明显降低,呈剂量依赖性,且以前者更加显著。这提示T83加速鼻咽癌细胞凋亡可能通过抑制PTEN/Akt/p27信号转导通路mRNA 水平,至于T83 是否影响该通路的蛋白水平有待进一步探讨。
综上所述,T83 通过较特异地调控PTEN/Akt/p27 信号转导通路,通过启动线粒体凋亡途径加速凋亡而较特异地抑制辐射抗拒鼻咽癌细胞的活性,为逆转鼻咽癌辐射抗拒的治疗提供新靶点和潜在抗癌制剂。
[1] Shi D,Guo W,Chen W,et al. Nicotine promotes proliferation of human nasopharyngeal carcinoma cells by regulating α7AChR,ERK,HIF-1α and VEGF/PEDF signaling[J]. PLoS One,2012,7(8):e43898.
[2] Harris S,Chan MD,Lovato JF,et al. Gamma knife stereotactic radio-surgery as salvage therapy after failure of whole-brain radiotherapy in patients with small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys,2012,83(1):e53-e59.
[3] Zuo Y,Huang J,Zhou B,et al. Synthesis,cytotoxicity of new 4-arylidene curcumin analogues and their multi-functions in inhibition of both NF-κB and Akt signalling[J].Eur J Med Chem,2012,55:346-357.
[4] 王旭丹,杨惠玲,郭禹标,等,不同辐射抗拒鼻咽癌细胞微小RNA 差异表达的研究[J]. 中国病理生理杂志,2007,23(6):1045-1048.
[5] 原玉芬,王杜娟,潘运宝,等,姜黄素类似物B67 诱导细胞凋亡和G2/M 期阻滞增强对鼻咽癌辐射抗拒细胞的抑制作用[J]. 中国病理生理杂志,2011,27(3):504-508.
[6] Subramaniam D,May R,Sureban SM,et al. Diphenyldifluoroketone:a curcumin derivative with potent in vivo anticancer activity[J]. Cancer Res,2008,68(6):1962-1969.
[7] Agrawal DK,Mishra PK. Curcumin and its analogues:potential anticancer agents[J]. Med Res Rev,2010,30(5):818-860.
[8] 刘嘉伟,张剑威,杨广鑫,等,姜黄素衍生物B50 对不同辐射抗拒的同源鼻咽癌细胞增殖及凋亡的作用[J].中国病理生理杂志,2011,27(6):1077-1083.
[9] Wang M,Ruan Y,Chen Q,et al. Curcumin induced HepG2 cell apoptosis-associated mitochondrial membrane potential and intracellular free Ca2+concentration[J]. Eur J Pharmacol,2011,650(1):41-47.
[10]Ren J,Cheng H,Xin WQ,et al. Induction of apoptosis by 7-piperazinethylchrysin in HCT-116 human colon cancer cells[J]. Oncol Rep,2012,28(5):1719-1726.
[11]Pu X,Hildebrandt MA,Lu C,et al. PI3K/PTEN/AKT/mTOR pathway genetic variation predicts toxicity and distant progression in lung cancer patients receiving platinumbased chemotherapy[J]. Lung Cancer,2011,71(1):82-88.
[12]Steelman LS,Chappell WH,Abrams SL,et al. Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J]. Aging (Albany NY),2011,3(3):192-222.
