巨大芽孢杆菌酯酶的克隆、表达及催化性质研究
2013-12-20谢丽萍应向贤王一芳郑建永
谢丽萍,应向贤,王一芳,郑建永
(浙江工业大学 生物与环境工程学院,浙江 杭州 310014)
0 引 言
酯酶(Esterase,EC3.1.1.1,羧基酯水解酶)是普遍存在于自然界的水解酶,被广泛应用于医药、食品、洗涤剂化学合成及油脂等工业,具有广泛的用途[1]。酯酶具有选择性专一、催化效率高、副反应少的特点,在手性药物制备等方面具有广阔的应用前景[2,3]。Nakagawa等[4]从菌株 Rhizobium sp.DS-S-51中克隆和表达了一个酯酶,该酶用于选择性拆分4-氯-3-羟基丁酸酯,拆分后4-氯-3-羟基丁酸酯对映体的e.e.值大于99%。源自Enterobacter sp.DS-S-75的重组酯酶能耐受15%(w/v)的4-氯-3-羟基丁酸甲酯,选择性拆分后R-4-氯-3-羟基丁酸甲酯的e.e.值大于99%[5,6]。作为生物催化剂,酯酶的催化性能往往不能满足实际应用的要求,而商品酶的价格往往较高,阻碍了它的进一步应用。研究发现新型的酯酶,采用DNA重组技术构建酯酶的基因工程菌,对酯酶基因进行重组表达,可大大降低酯酶生产成本,从而使之得到广泛应用。
本研究对一个巨大芽孢杆菌酯酶基因进行了克隆与表达,利用亲和层析实现了酯酶的分离纯化,研究了该重组酯酶的酶学性质,如pH、温度、金属离子、有机溶剂的影响等,为其在生物催化与转化中的应用奠定了一定的基础。
1 材料与方法
1.1 材料
1.1.1 菌种及质粒载体
实验室筛选的Bacillus megaterium strain WZ009(已委托武汉微生物菌种保藏中心保藏菌种,CCTCC M 2011336),表达载体 pET-30a,大肠杆菌 Escherichia coli DH5α 与 E.coli BL21(DE3)均为本实验室保藏。
1.1.2 试剂
rTaq酶购自上海申能博彩生物科技有限公司。T4连接酶、限制性内切酶、DNA marker、质粒提取试剂盒、胶回收试剂盒、琼脂糖电泳试剂均购自大连TaKaRa公司。Ni-NTA Sefinose Kit购自Bio Basic INC公司。其他试剂均为国产分析纯。
1.1.3 培养基及培养条件
种子培养基:1%胰蛋白胨,0.5%NaCI,0.5%酵母浸出粉,pH 7.5。配制固体培养基时需加入1.5%的琼脂粉。
发酵培养基:0.72%葡萄糖,0.7%酵母膏,0.125%CaCl2,0.1%四氯三羟基丁酸,pH 6.5。
大肠杆菌E.coli DH5α与E.coli BL21(DE3)采用种子培养基,37℃过夜培养。WZ009菌株采用发酵培养基,30℃培养24 h。重组克隆菌株用含卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-Gal)的种子培养基进行蓝白斑筛选,重组表达菌用含100 μg/mL卡那霉素的种子培养基培养,并用终浓度为0.2 mmol/L IPTG诱导培养。
1.1.4 引物
根据已知基因组序列的B.megaterium DSM319的酯酶基因 (GeneBank Accession No.CP001982) 设计引物,F(5’-ATGCCGTTAGATCCGCA-3’) 和 R(5’-CTAAATAGAATCAAATACTTGACG-3’)。引物由上海泽衡生物技术有限公司合成。
1.2 方法
1.2.1 基因bme的PCR扩增及表达载体pET30abme的构建
挑取B.megaterium WZ009单菌落,接种于发酵培养基,30℃培养至菌液OD600约为0.8,参照TaKaRa基因组DNA抽提试剂盒说明书提取基因组DNA。以基因组DNA为模板,寡聚核苷酸F和R为引物进行PCR扩增。该PCR扩增反应体系总体积为50 μL,模板和引物添加量分别为100 ng和300 ng。扩增反应条件为:94℃预变性3 min;94变性 35 s,57 ℃复性 30 s,72℃延伸 50 s,35个循环;72℃后延伸10 min。
电泳检测PCR扩增产物并回收纯化,用相应的内切酶Kpn I和Xho I进行双酶切,割胶回收,微量核酸蛋白测量仪检测浓度,控制DNA片段摩尔数在载体的摩尔数的3~10倍,将目的片段与同样酶切处理过的载体pET-30a混合,16℃下T4连接酶连接过夜,并转化入DH5α感受态细胞中,通过卡那霉素抗性筛选和蓝白斑筛选[7],挑取阳性克隆子提取质粒,用Kpn I和Xho I对质粒进行酶切鉴定。取阳性克隆子送至上海生工生物工程有限公司测序,然后用Blast软件将所得基因序列与GenBank中的基因序列进行比对分析。
1.2.2 基因bme的表达
从阳性克隆子DH5α中提取重组质粒pET30a-bme,并转化入 E.coli BL21(DE3)中,在含卡那霉素的种子培养基中37℃、200 r/min摇瓶培养12h,作为种子液。然后按1%的比例接种扩大培养,37℃振荡培养至OD600为0.6~0.8时,加入24 mg/L的IPTG至终浓度为0.2 mmol,28℃,200 r/min诱导培养16 h。
1.2.3 重组酶的纯化
4℃下收集菌体,用50 mmol的Tris-HCl缓冲液(pH 8.0)重悬,经超声破碎后4℃,10 000 r/min离心15min得上清粗酶液。按照Ni-NTA Sefinose试剂盒使用指南,取粗酶液上样至预平衡的Ni2+柱中,依次用不同梯度的洗脱液洗脱目的蛋白。收集洗脱液,经SDS-PAGE检测样品的蛋白质纯度。蛋白质浓度测定采用Bradford法[8],以牛血清蛋白为标准样。
1.2.4 重组酶酶活测定
取两个试管 (分别是对照管和样品管),各加0.1 mL溶液A和2.89 mL溶液B慢慢混合。50℃水浴中预热5 min,然后在对照管里加入已灭活的酶液0.01 mL,样品管里加入酶液0.01 mL,立即混匀计时。在水浴中准确反应2 min,并马上测定410 nm下酶水解产生对硝基苯酚的吸光度值 (OD410 nm值)。溶液A:150 mg底物酯溶于50 mL异丙醇;溶液B:500 mL pH7.5 0.02 mol/L磷酸缓冲液。底物为对硝基苯酚乙酸酯和对硝基苯酚棕榈酸酯。
酶活定义:在pH7.5,50℃条件下,每分钟水解释放1μmol对硝基苯酚所需的酶量为1个酯酶活力单位(U)。
1.2.5 重组酶酶学性质
(1)酯酶的最适反应温度
标准反应体系下,分别在25~90℃温度范围内测定酶反应,410 nm波长下测定各管吸光值并计算酶活力,以酶活最高者作为100%。
(2)酯酶的最适反应pH
标准反应体系中,变化不同pH值的磷酸盐缓冲液,410 nm波长下测定各管吸光值并计算酶活力,以酶活最高者作为100%。
(3)金属离子对酯酶活力的影响
在标准反应体系中分别添加不同金属离子或EDTA,测定酶活力。确定金属离子与EDTA对酶活的影响。以不加金属离子时的酶活力作为100%,计算相对酶活力。
(4)有机溶剂耐受性
标准体系中按体积比分别为10%-80%加入甲醇作为助溶剂,检测重组酶在有机溶剂存在条件下的酶活力。以未加甲醇时的酶活作为100%,计算相对酶活。
1.2.6 5 L发酵罐的扩大培养
将种子液按1%的接种量接入5 L发酵罐(BioStat C,德国 B.Branun)中,装液量为 3 L,在37℃,200 r/min和通气1.1 vvm的条件下培养至OD600为0.6~0.8时,加入终浓度为0.2 mmol/L的IPTG,28℃进行诱导培养发酵。每隔一小时取样,用分光光度计检测光密度(OD600)并记录pH、溶氧值。
1.2.7 酶不对称水解4-氯-3-羟基丁酸乙酯
在50 ml反应瓶中先后加入20 mL 0.2mol/L磷酸缓冲液 (pH7.0)、0.2 mL 4-氯-3-羟基丁酸乙酯 (CHBE)、1 mL工程菌液,200 r/min,30℃下开始反应,10 h后取样分析。水解反应液用等体积乙酸乙酯萃取,有机相无水硫酸钠干燥、过滤后直接进行气相色谱分析。气相色谱分析条件:进样口温度250℃,分流比 20:1,载气N2,载气流量 1 ml/min;柱温100℃保持2 min,2℃/min程序升温至160℃,保持2 min;FID检测器:检测器温度250℃。
2 结果与讨论
2.1 重组酶的表达与SDS-PAGE验证
通过Kpn I和Xho I双切点将酯酶bme基因引入表达载体pET-30a,构建得到重组质粒pET30a-bme。将重组质粒pET30a-bme转化入宿主菌E.coil BL21(DE3)中,在IPTG诱导下,酯酶在E.coil BL21(DE3)中高效表达,分子量约为41.5kDa,与预期相符。利用重组质粒携带的多组氨酸标签,表达的重组酶经Ni2+亲和色谱纯化后经SDS-PAGE检测,显示为单一条带(图1),实现了重组蛋白的一步纯化。经过酶活、蛋白质浓度测定,计算得酶的比活为200 U/mg。
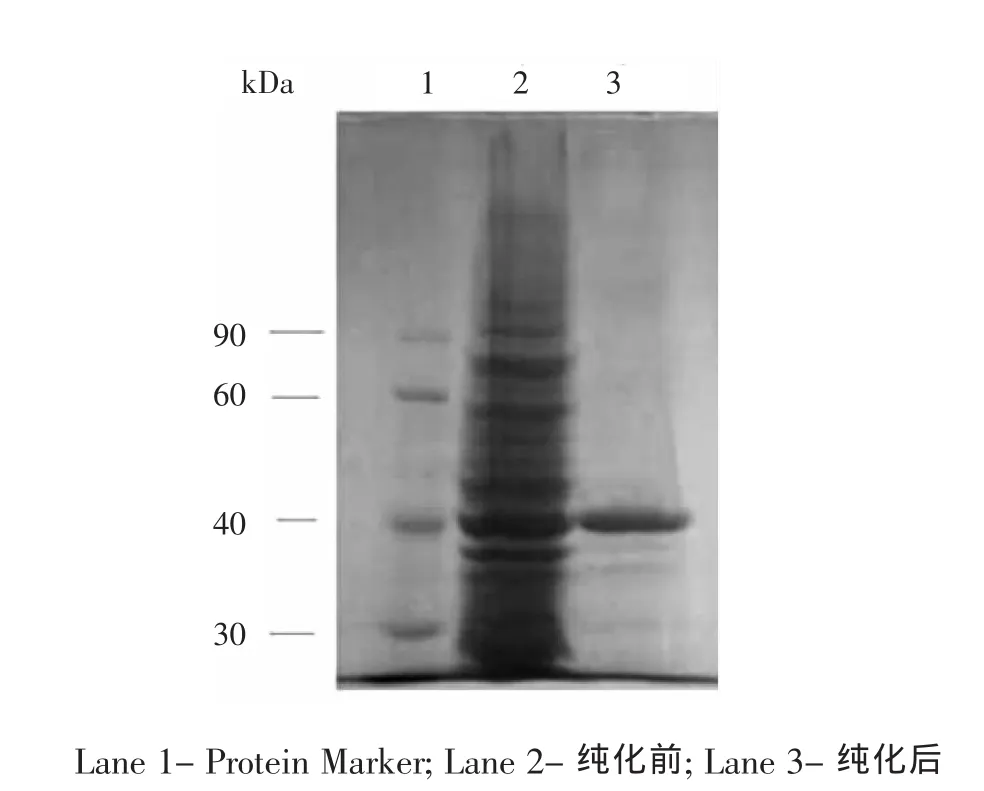
图1 纯化前后样品的SDS-PAGE分析
2.2 酯酶酶学性质
2.2.1 酯酶的最适反应温度
图2结果表明,酯酶在70℃表现出最高活力。在25℃活力仅为最高活力的21.4%;随着温度的增加,活性有所提高;超过80℃后,活性开始降低,到90℃时活性仅为最高活性的16.7%。

图2 温度对酶活的影响
2.2.2 酯酶的最适反应pH
图3结果表明,该酶在偏酸性条件下(<pH6.5)酶活力相当低,不到最高酶活的50%。当pH7.5时酶活达到最大值,所以该酶的最适pH为7.5。酯酶一般为中性蛋白,其最适pH一般都在中性的6.5~7.5范围内,适宜于中性介质中应用。

图3 pH对酶活的影响
2.2.3 金属离子对酯酶活力的影响
由表 1可知较高浓度的 Na+,Zn2+,Ca2+和EDTA对酶活有一定的抑制作用,但该酶能耐受低浓度的Zn2+,Ca2+,Mn2+,EDTA等,表明该重组酶具备良好的金属离子耐受性。

表1 金属离子对酶活的影响
2.2.4 有机溶剂耐受性
选用甲醇作为助溶剂,以未加甲醇时的酶活力为100%计算相对酶活力,结果如图4所示。不同浓度的甲醇并不抑制酶活力,说明重组酶具有良好的有机溶剂耐受性。

图4 有机溶剂耐受性
2.3 5L发酵罐扩培——发酵曲线
发酵过程曲线如图5,pH随着发酵的进行,其数值逐渐升高。溶氧曲线一开始下降迅速后又回升,发酵9 h时又降到最低,之后稳定一段时间后又回身至较高值。说明发酵初期,耗氧量大,菌体摄氧量达高峰;发酵中期,耗氧相对较恒定,但此处也有所波动。OD600曲线逐渐升高,说明菌体生长良好正常。细菌生长进入对数生长期,OD值明显上升,达最大值,随后增长缓慢。
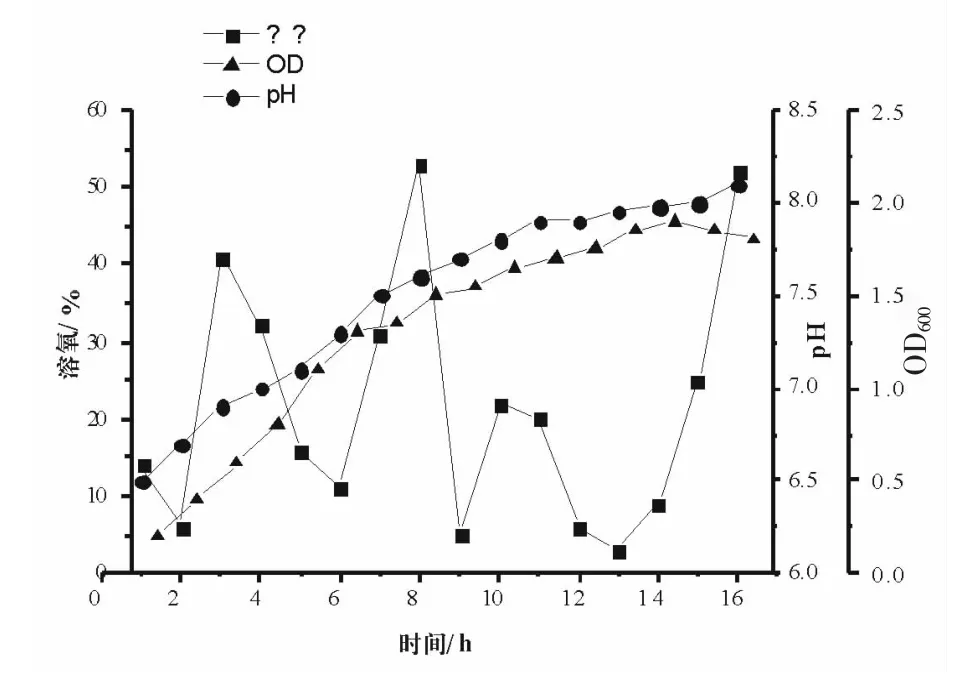
图5 BME 5 L发酵罐发酵曲线
2.4 酶不对称水解4-氯-3-羟基丁酸乙酯

图6 手性气相色谱图
经检测得到如下气相色谱图6,a为样品,b为标样。(R)-和(S)-4-氯-3-羟基丁酸乙酯对映体出峰时间分别为:28.2 min和28.5 min。
以混旋4-氯-3-羟基丁酸乙酯为底物,在30℃下重组酯酶BME催化水解10 h,反应转化率为50%,底物e.e.值为70%,表明酯酶对4-氯-3-羟基丁酸乙酯水解具有立体选择性。
本研究成功实现了一个巨大芽孢杆菌酯酶基因分子克隆与功能性表达,并对其进行了扩大培养。经分离纯化得到了重组酯酶,该酶亚基分子量为41.5 kDa。重组酯酶的最适反应温度为70℃,最适 pH为7.5,比酶活为 200 U/mg,比活力较高。该酶能耐受低浓度的Zn2+,Ca2+,Mn2+,EDTA等和高浓度的甲醇和Triton X-100。此外,该酯酶在不对称水解4-氯-3-羟基丁酸乙酯中E值达到11.7。上述结果表明,本研究的酯酶在选择性拆分上具有较好的应用潜力,具有进一步研究的价值。
[1]Bornscheuer U T.Microbial carboxyl esterase:classification,properties and application in biocatalysis[J].FEMS Microbiology Rev 2002,26(1):73-81.
[2]Patel J M.Biocatalytic synthesis of atorvastatin intermediates.J Mol Catal B:Enzymatic ,2009,61:123-128.
[3]Lee S H,Park O J.Uses and production of chiral 3-hydroxy-γbutyrolactones and structurally related chemicals[J].Appl Microbiol Biotechnol,2009,84:817-828.
[4]Nakagawa A,Suzuki T,Kato K,Shinmyo A,Suzuki T.Production of(S)-4-chloro-3-hydroxybutyrate by microbial resolution using hydrolase from Rhizobium sp.DS-S-51[J].J Biosci Bioeng,2008,105:313-318.
[5]Nakagawa A,Idogaki J,Kato K,Shinmyo A,Suzuki T.Improvement on produ-ction of(R)-4-chloro-3-hydroxybutyrate and(S)-3-hydroxy-γ-butyrolactone with recombi-nant Escherichia coli cells[J].J Biosci Bioeng,2006,101:97-103.
[6]Nakagawa A,Kato K,Shinmyo A,Suzuki T.Asymmetric hydrolysis of 2-hydroxy-carboxylic esters using recombinant Escherichia coli[J].Tetrahedron-Asymmetry,2007,18:2394-2398.
[7]Sambrook J,Fritsch EF,Maniatis T.Molecular cloning:a laboratory manual,2nd ed.Cold Spring Harbor Laboratory Press,Cold Spring Harbor[M].New York:Cold Spring Harbor Laboratory Press,1989.
[8]Bradford M,M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1-2):248-254.
