利用改进的耐高温酵母菌发酵木质纤维素生产生物乙醇的研究进展
2013-12-20宋维霞
宋维霞
(青岛科技大学 化工学院,山东 青岛 266042)
0 前 言
石油资源短缺、环境污染严重,已经成为制约我国可持续发展的瓶颈。利用生物方法生产的生物乙醇,是传统燃料石油最有前景的替代品。目前,世界上生产生物乙醇的原料大多数是淀粉和甘蔗汁,而以玉米为原料生产的第一代生物燃料乙醇,由于与人类竞争粮食,已逐渐被淘汰[1]。从丰富的农副产品和工业废渣 (如甘蔗渣、玉米秸秆、小麦和水稻秸秆、木屑等)中获得的木质纤维素,都可用作生产生物乙醇的原料。
木质纤维素主要由纤维素、半纤维素和木质素构成。原料不同各部分的组成也会有所变化[2]。纤维素结晶形成的超细纤维结构即无定形结构,不易被真菌和细菌分泌的糖化酶水解。虽然经过化学和物理方法预处理后的纤维素和半纤维素更容易和糖化酶反应,但是由于纤维素的结构相对坚固,因此,寻求有效的纤维素水解方法仍然是利用木质纤维素生产乙醇的关键[3]。
纤维素水解成可溶性的糖,需要包括内切葡聚糖酶(EG)、外切葡聚糖酶(包括纤维二糖水解酶(CBH)、纤维糊精酶)和 β-葡萄糖苷酶(BGL)的共同作用,然而反应产物如纤维低聚糖和葡萄糖会抑制纤维素酶的活性[4]。为了避免上述的产物抑制,将生物质水解产生还原糖与还原糖发酵一起进行,这一过程被称为同步糖化发酵(SSF)。这样一方面,可以在纤维素酶的作用下将释放的还原糖直接转化为乙醇;另一方面,培养基中的葡萄糖的消耗和乙醇的存在将降低染菌的风险。联合生物加工(CBP)工艺是将酶的生产、糖化和发酵集合成一体的新工艺。具有消耗低、操作简单等优点。最近,CBP已经作为一个生物乙醇生产系统得到了认可,并且已经开发了能够有效地水解纤维素、提高乙醇生产能力CBP微生物。
SSF和CBP工艺的瓶颈在于糖化和发酵阶段所需的最佳温度不同。纤维素糖化酶的最佳温度为50℃,而大多数微生物发酵生产乙醇的最佳温度是28~37℃。笔者将重点论述利用耐高温酵母菌的SSF和CBP工艺。由于同步糖化发酵需要较高温度,所以还特别强调了能在CBP工艺中直接将纤维素转化成乙醇的酵母菌的发展情况[5]。
1 耐高温酵母菌同步糖化发酵法生产乙醇
因为在高温条件下生产乙醇有很多优点如:降低冷却成本、低压下乙醇能从发酵液中连续蒸发、降低染菌风险、在热带国家有较好适用性、缓解纤维素酶的产物抑制、提高同步糖化发酵(SSF)的效率等,因此在世界上已备受关注。Abdel-Banat等[6]计算出利用α-淀粉酶水解淀粉生产燃料乙醇,当发酵温度增加5℃时,由于减少冷却的能量,可以大大减少发酵成本。由于发酵过程中乙醇被蒸发,所以乙醇的浓度保持在较低水平,对酵母菌并没有毒害,同时也可以简化后续的精馏操作。
同步糖化发酵工艺(SSF)的一个突出的优点是能避免葡萄糖对纤维素酶的抑制进而提高糖化效率和乙醇产量。然而,SSF工艺的缺点是在较低的温度下水解反应和发酵同时进行比水解和发酵单独进行时水解效率低。因此,分离筛选在糖化温度下产乙醇的耐热菌是提高同步糖化发酵效率所必需的。耐热酵母菌克鲁维酵母(Kluyveromyces)和酿酒酵母(Saccharomyces),在高温(> 40 ℃)下能产生超过5%的乙醇[7]。因为木糖是半纤维素中最常见的戊糖,是木质纤维素生物质中第二个最丰富的多糖。因此如果菌株除了耐热之外还能够直接以木糖为原料进行发酵,那么将使以木质纤维素为原料生产乙醇变得更加经济可行。
一些耐高温和产乙醇的酵母已经被优化,用来更好的从生物质中生产乙醇(表1)。例如,耐热毕赤酵母:多形汉逊酵母 (Hansenula polymorpha),在温度升高到 37℃或较高时能够分解葡萄糖、纤维二糖和木糖生产乙醇。Dmytruk等[8]通过对内源性木糖还原酶基因进行定点突变,从而提高多形汉逊菌对木糖的利用。在48℃时,重组菌株比野生型菌株产乙醇的量高7.3倍。多形汉逊酵母菌的这种性质是SSF应用中的优点。
马克斯克鲁维酵母 (Kluyveromyces marxianus)在同步糖化发酵工艺中非常有应用前景。已经得到的多株马克斯克鲁维酵母,能在温度高达45~52℃时生长,在温度介于38℃和45℃时能有效地生产乙醇。耐热的马克斯克鲁维酵母菌IMB3,在42℃时能发酵产生60~72 g/L的乙醇,这和工业上经常使用酿酒酵母发酵得到的乙醇浓度相差无几[9]。此外,马克斯克鲁维酵母在高温下生长率高、可以利用各种糖原料(例如:阿拉伯糖、半乳糖、甘露糖、木糖)生产乙醇。正是由于具有这些优点,马克斯克鲁维酵母已用于以工业相关的基础原料(如甘蔗汁、青贮玉米汁、糖浆和乳清粉)生产乙醇。此外,还应用于将经过蒸汽爆破预处理的各种木质材料(杨树、桉树、甜高粱、甘蔗渣和小麦秸秆)转化为乙醇。同步糖化发酵实验在42℃、100 g/L底物和15 FPU/g商业纤维素酶条件下进行,经过72~82 h发酵木质纤维素产生16~19 g/L乙醇。基于预处理材料中葡萄糖的可利用量,乙醇产量为理论产量的50%~72%[10]。Banat等[11]验证40℃至50℃有利于马克斯克鲁维酵母IMB进行同步糖化发酵。耐热的马克斯克鲁维酵母菌IMB3通过SSF工艺将进行水热预处理的柳枝稷转化为乙醇。通过条件优化,在45℃条件下,80 g/L的纤维素经过168 h发酵,产生 22.5 g/L的乙醇,接近于理论产量的86%。
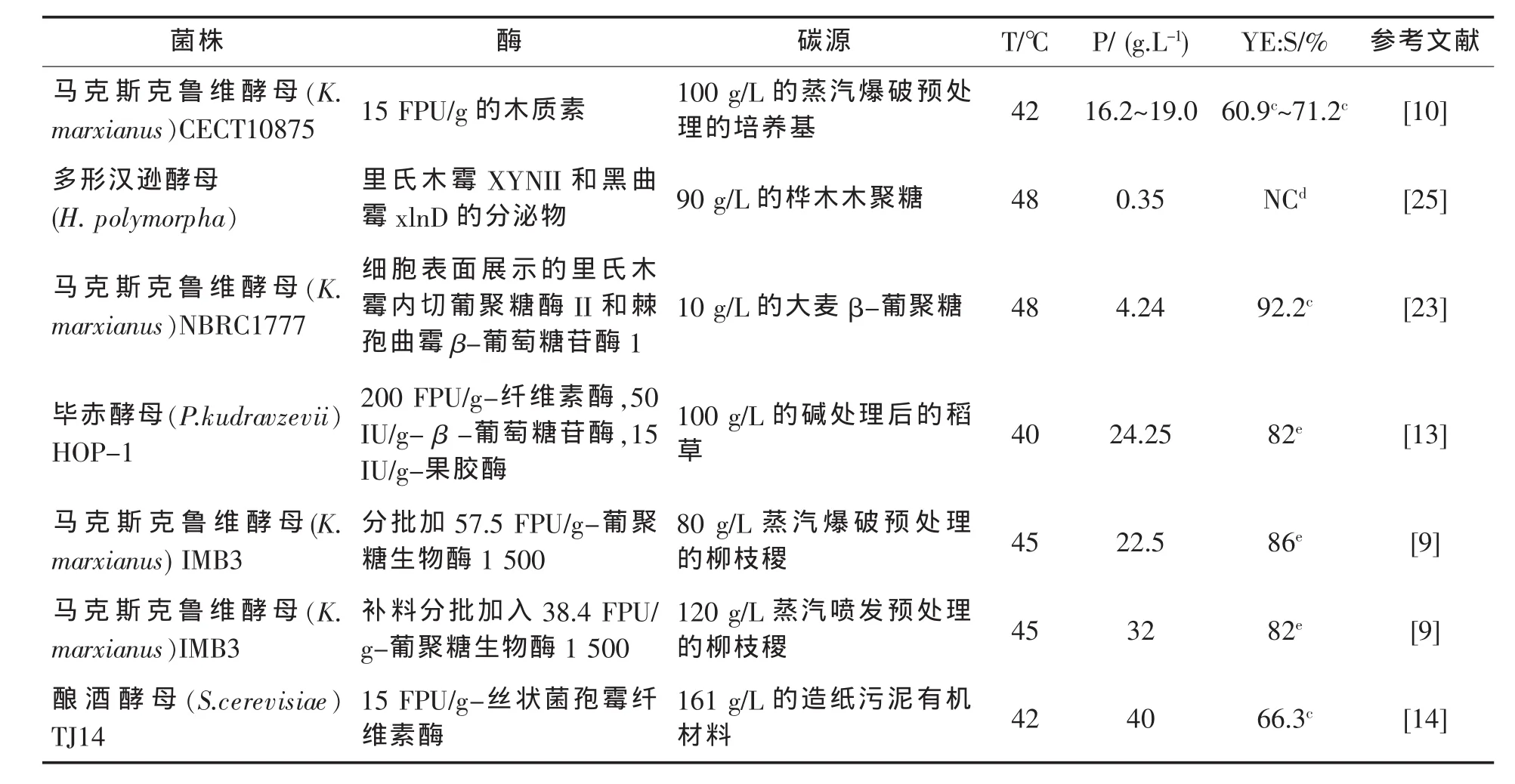
表1 在高温下耐热菌株通过SSF或CBP工艺水解纤维素和半纤维素生产乙醇的最新数据资料
最新分离出的耐热的产乙醇菌即毕赤酵母(Pichia kudriavzevii)IPE100,在 42 ℃利用葡萄糖产乙醇的产量为的理论产量的85%。42℃时利用酶水解经过发酵蒸汽爆破预处理过的玉米秸秆,乙醇产量为理论产量的93.8%。Kitagawa等[12]在耐酸、耐乙醇,耐热菌毕赤酵母中构建了一个棘孢曲霉β-葡萄糖苷酶bgl基因转化系统。转化株在40℃,无需加入β-葡萄糖苷酶(BGL)的条件下,经72 h同步糖化发酵100 g/L微晶纤维素,产生29 g/L的乙醇。P.kudriavzevii基因工程菌需要较少量的糖化酶,因此可以大大降低同步糖化发酵工艺中酶的成本。发酵过程中的各种形式的压力包括低pH值和预处理产生的酸性发酵抑制剂(如醋酸,甲酸和乙酰丙酸)都会损害同步糖化发酵中的酵母菌,而酵母菌P.kudriavzevii的综合忍受能力有明显优势。耐热的毕赤酵母菌在40℃条件下,发酵含有141 g/L蔗糖、15 g/L葡萄糖和9 g/L的果糖的甘蔗汁,产生71.9 g/L的乙醇。另外,毕赤酵母用于连续四个批次发酵后,仍然保持较高的生物活性。Oberoi等[13]报道了使用新分离的P.kudriavzevii HOP-1菌株通过SSF工艺以碱处理的秸秆为原料生产乙醇。在40℃时条件下P.kudriavzevii发酵150 g/L葡萄糖是传统的酿酒酵母产乙醇的35%;而在45℃时则在200%以上。 用酶(20 FPU/g-纤维素酶,50 IU/g-β-葡萄糖苷酶和15 IU/g-果胶酶)水解碱处理的稻草,40℃时加入P.kudriavzevii进行同步糖化发酵,24 h后,乙醇浓度为24.25 g/L,是基于葡聚糖的理论产量的82%。
工业上常用来生产乙醇的酿酒酵母(S.cerevisiae),具有很高的乙醇耐受性,但不耐热。用校对缺陷DNA聚合酶或紫外线 (UV)照射进行筛查,获得耐热性的突变菌株,酿酒酵母突变体可在温度高达40~42℃时生长。通过基因组重排、原生质体融合和紫外光照射相结合的方法提高了耐热性、耐乙醇的酿酒酵母生产乙醇的效率。从热带地区分离出耐高温酿酒酵母菌S.cerevisiaeTJ14,显示出高温(41℃)的生长表型。在42℃条件下,在利用同步糖化发酵过程中使用丝状菌孢霉产生的纤维素酶水解发酵含有66%的葡聚糖的161 g/L的造纸污泥有机材料,能够产生40 g/L的乙醇。Harashima等[14]基于耐高温酿酒酵母菌经典遗传分析,RSP5编码的E3泛素连接酶和CDC19编码的丙酮酸激酶,负责菌株的高温生长。
2 酿酒酵母中的纤维素酶基因的异源表达
CBP工艺中理想的微生物应能糖化纤维素并利用糖生产酒精。由于酿酒酵母发酵纤维素生产乙醇具有许多优点,例如:糖的消耗速度更快、乙醇产量高、乙醇和各种抑制剂的耐受性强。同时,酿酒酵母易于遗传操作并且长期用于食品和饮料工业,被公认是安全的,所以酿酒酵母是CBP工艺中常用的菌种。
在一般情况下,结晶纤维素的高效降解需要水解酶的协同反应,如内切葡聚糖酶(EG)、纤维二糖水解酶(CBH)和 β-葡萄糖苷酶(BGL)[4]。 由内切葡聚糖酶优先在纤维素的无定形区进行随机切割,产生还原性和非还原性末端,然后由纤维二糖水解酶作用释放出纤维二糖;随后在EG-CBH内切外切酶协同作用下纤维素可被高效降解为可溶纤维二糖和纤维寡糖[15]。最后在β-葡糖苷酶的作用下将纤维寡糖分解为葡萄糖分子。由于纤维二糖和纤维低聚糖是纤维素水解的强效抑制剂,是纤维素水解过程的限速步骤,BGL则可以将纤维二糖和可溶性纤维糊精转化为葡萄糖。来源于真菌的BGL基因 (如从A.aculeatus获得的BGL1、从Saccharmycopsis fibuligera获得的BGL1、从黑曲霉获得的bglA、从Candida wickerhamii获得的bglB、从 Trichoderma reesei获得的 bgl、和从 Endomyces fibuliger获得的BGL1)已在酿酒酵母中异源表达。Gurgu等[16]报道:携带S.fibuligeraBGL1基因的工业酵母菌利用纤维二糖的能力取决于其积累BGL1的能力也取决于其遗传背景。重组的酿酒酵母菌能够表达纤维糊精转运基因与分解纤维二糖和纤维糊精的细胞内BGL基因,通过细胞在细胞外BGL将纤维糊精完全水解成葡萄糖。这意味着以纤维糊精为原料生产乙醇的效率已经被提高。
纤维素酶直接参与纤维素水解反应,通过纤维素酶基因的共表达能够使纤维素直接生产乙醇。Den-Haan等[17]表达了两个纤维素酶基因,从T.reesei中获得的编码 EG的基因和从S.fibuligera中获得的编码BGL的基因,两个基因整合在酿酒酵母中得到的酵母菌,成功地以无定形纤维素(PASC)作为唯一的碳源生产乙醇。最近,基因编码的里氏木霉内切葡聚糖酶(EGII)、酸性纤维素酶II(CBH II)和棘孢曲霉BGL1基因通过具有携带抗抗生素G418基因的单一载体集成到葡萄酒酵母菌的染色体上。重组得到的酿酒酵母菌可以直接利用经预处理的玉米秸秆纤维素生产乙醇,而不需要额外的加入各种酶。
3 细胞表面工程技术的应用
细胞表面工程,将目的蛋白和酵母的细胞壁蛋白融合表达,使目的蛋白固定在酵母细胞的表面。比较常用的细胞壁蛋白有α-凝集素和Flo1p蛋白[18]。细胞表面表达不仅可以有效提高酶活力的稳定性,而且还可以将表达、纯化和固定集合于一体,节省时间和资源[19]。Fujita等[20]利用纯的纤维素原料如大麦β-葡聚糖和无定形纤维素生产乙醇,使用重组酿酒酵母菌细胞表面表达的里氏木霉内切葡聚糖酶 (EGII)和酸性纤维素酶II(CBH II)和棘孢曲霉BGL1而没有而没有添加其他的酶。利用无定形纤维素生产乙醇的产量为0.45 g/g,是理论产率的88.5%。最近,一个表达分解纤维素酶的二倍体酵母重组株被优化,在不添加外源酶的条件下,分解经过热水预处理的100 g/L的水稻秸秆产生7.5 g/L乙醇。
利用酵母菌细胞表面工程表达纤维素酶具有以下优点:①在细胞表面有多种纤维素酶协同水解纤维素,可增加糖的利用率产生更多的乙醇;②水解纤维素释放的葡萄糖被酵母细胞表面吸收,糖浓度维持在较低水平,以减少污染、降低纤维素酶产物抑制的风险;③由于在培养基中的葡萄糖稳态浓度可以保持接近于零,因此可减少葡萄糖的阻遏作用,促进木糖的消耗;④酵母细胞酶的回收利用,降低酵母繁殖成本、减少酶的消耗[21];⑤纤维素酶自动固定化在酵母细胞表面上,只要酵母继续生长,该酶的活性则得以保持。
4 耐高温酵母菌株在提高CBP工艺方面的应用
纤维素酶的异源产物已经以耐热酵母菌为宿主得到表达。例如,一些外源基因已被引入马克斯克鲁维酵母并成功的得到表达。耐热纤维素酶基因编码的黑曲霉EG、嗜热子囊菌BGL和CBH被引入马克斯克鲁维酵母NBRC1777基因组。马克斯克鲁维酵母中的相关基因,在甘油醛-3-磷酸脱氢酶(GAPDH)启动子的控制下成功的得到表达,并且酵母在温度高达45~50℃生长良好。重组菌株能够利用100 g/L的纤维素产生43.4 g/L乙醇[22]。
为了提高纤维素的转化效率,从里氏木霉中获得的EGII和从棘孢曲霉中获得的BGL1被共展示在重组马克斯克鲁维酵母细胞表面,在45℃条件下能够利用53.4 g/L纤维二糖产生20.4 g/L的乙醇。在48℃、不加入其他纤维素酶的条件下,经过12 h反应,重组菌株能够以10 g/L的纤维素β-葡聚糖为原料产生4.24 g/L乙醇;而在30℃条件下,乙醇量仅为0.930 g/L即产量(生产每克乙醇需要消耗的β-葡聚糖克数)为0.47 g/g。这一结果表明使用该重组耐热马克斯克鲁维酵母菌的细胞表面显示耐热性的纤维素酶,可以有效地实现在高温下发酵纤维素生产乙醇。作为一般认为是安全的(GRAS)微生物,马克斯克鲁维酵母,可在高温下利用纤维素(见表1),因为它在较高的温度下可以利用广泛的碳源,迅速地进行生长繁殖。马克斯克鲁维酵母为改进CBP工艺、提高乙醇产量做出重大贡献[23]。
半纤维素是木质纤维素中第二丰富的成分,与纤维素一起被用来生产乙醇。Voronovsky等[24]通过将XYN2(里氏木霉中编码木聚糖酶的基因)和xlnD(黑曲霉中编码β-木糖苷酶的基因)整合到多形汉逊酵母基因组中,得到的转化体在48℃能够在以桦木木聚糖作为唯一碳源的基本培养基中生长并且产生乙醇。Sakamoto等[25]通过构建重组的酿酒酵母直接以水稻秸秆半纤维素为原料生产乙醇,不仅能通过内切木聚糖酶、β-木糖苷酶和β-葡萄糖苷酶1的共同作用来水解半纤维素,也可通过表达出的树干毕赤酵母木糖还原酶、木糖醇脱氢酶和酿酒酵母中木酮糖激酶同化木糖。半纤维素降解酶在耐热酵母菌细胞表面显示出的应用也将有助于提高以半纤维素为原料生产乙醇的产量。
5 结论与展望
通过基因工程获得的具有纤维素水解活性的酵母使得利用CBP工艺以木质纤维素为原料生产乙醇有突破性的提高。CBP工艺的主要缺点是糖化和发酵的最佳温度的差异,而耐热菌株的应用可以克服这个缺点。耐高温、产乙醇的酵母菌用于SSF工艺,使木质纤维素在高温下高效水解。有效的水解需要多种酶包括内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的结合并转化进入耐热酵母菌中,这需要高效的转化系统。因此,构建多基因表达系统仍是进一步研究的目标。
同时,细胞表面工程是在酵母细胞表面展示各种纤维素分解酶并有效地水解纤维素原料的有力工具,是应用在发酵生产乙醇的一个新方向。已构建的能够利用木质纤维素酵母菌,可有效地将来源丰富的纤维素废料转化新的生物能源,因此具有极其重要的意义。
[1]李江,谢天文,刘晓风.木质纤维素生产燃料乙醇的糖化发酵工艺研究进展[J].化工进展,2011,30(2):284-288.
[2]杨涛,马美湖.纤维素类物质生产酒精的研究进展[J].中国酿造,2006(8):11-5.
[3]Himmel M E,Ding S Y,Johnson D K,Adney W S,Nimlos M R,Brady J W,et al.Biomass recalcitrance:engineering plants and enzymes for biofuels production[J].Science,2007,315:804-807.
[4]Zhang Y H P,Himmel M E,Mielenz J R.Outlook for cellulase improvement:screening and selection strategies[J].Biotechnol Adv,2006,24:452-481.
[5]翁海波,王志强,敬蔚然.联合生物加工工艺生产乙醇的研究展望[J].湖南农业科学,2010(7):110-112.
[6]Abdelbanat B M A,Hoshida H,Ano A,Nonklang S,Akada R.High-temperature fermentation:how can processes for ethanol production at high temperatures become superior to the traditional process using mesophilic yeast?[J].Appl Microbiol Biotechnol,2010,85:861-867.
[7]D’Amore T,Celotto G,Russell I,Stewart G G.Selection and optimization of yeast suitable for ethanol production at 40?C[J].Enzyme Microb Technol,1989,11:411-416.
[8]Dmytruk O V,Dmytruk K V,Abbas C A,Voronovsky A Y,Sibirny A A.Engineering of xylose reductase and overexpression of xylitol dehydrogenase and xylulokinase improves xylose alcoholic fermentation in the thermotolerant yeast Hansenula polymorpha[J].Microb Cell Fact,2008,7:21.
[9]Pessani N K,Atiyeh H K,Wilkins M R,Bellmer D D,Banat I M.Simultaneous saccharification and fermentation of Kanlow switchgrass by thermotolerant Kluyveromyces marxianus IMB3:the effect of enzyme loading,temperature and high solid loadings[J].Bioresour Techonol,2011,102:10618-10624.
[10]Ballesteros M,Oliva J M,Negro M J,Manzanares P,Balles-teros I.Ethanol from lignocellulosic materials by a simulataneous saccharification and fermentation process (SFS)with Kluyveromyces marxianus CECT 10875[J].Process Biochem,2004,39:1843-1848.
[11]Banat I M,Nigam P,Marchant R.Isolation of thermotolerant,fermentative yeasts growing at 52℃and producing ethanol at 45℃and 50℃[J].World J Microbiol Biotechnol,19928:259-263.
[12]Kitagawa T,Tokuhiro K,Sugiyama H,Kohda K,Isono N,Hisamitsu M,et al.Construction of β-glucosidase expression system using the multistress-tolerant yeast Issatchenkia orientalis[J].Appl Microbiol Biotechnol,2010,87:1841-1853.
[13]Oberoi H S,Babbar N,Sandhu S K,Dhaliwal S S,Kaur U,Chadha B S,et al.Ethanol production from alkali-treated rice straw via simultaneous saccharification and fermentation using newly isolated thermotolerant Pichia kudriavzevii HOP-1[M].J Ind Microbiol Biotechnol,2011.
[14]Prasetyo J,Naruse K,Kato T,Boonchird C,Harashima S,Park E Y.Bioconversion of paper sludge to biofuel by simultaneous saccharification and fermentation using a cellulase of paper sludge origin and thermotolerant Saccharomyces cerevisiae TJ14[J].Biotechnol Biofuels,2011,4:35.
[15]杨炎锋.酵母细胞表面工程在生物乙醇生产中的应用[J].化工进展,2009,28(8):1415-1407.
[16]Gurgu L,Lafraya á,Polaina J,Marínnavarro J.Fermentation of cellobiose to ethanol by industrial Saccharomyces strains carrying the β-glucosidase gene (BGL1)from Saccharomycopsis fibuligera[J].Bioresour Technol,2011,102:5229-5236.
[17]Den Haan R,Rose S H,Lynd L R,Van Zyl W H.Hydrolysis and fermentation of amorphous cellulose by recombinant Saccharomyces cerevisiae[J].Metab Eng,2007,9:87-94.
[18]杨非,曹萌,金怡,等.酿酒酵母细胞表面展示技术在燃料乙醇生产中的应用及研究进展[J].生物工程学报,2012,28(8):901-911.
[19]张宁,蒋剑春,程荷芳,等.木质纤维生物质同步糖化发酵(SSF)生产乙醇的研究进展[J].化工进展,2010,29(2):238-242.
[20]Fujita Y,Ito J,Ueda M,Fukuda H,Kondo A.Synergistic saccharification,and direct fermentation to ethanol of amorphous cellulose by use of engineered yeast strain codisplaying three types of cellulolytic enzyme[J].Appl Environ Microbiol,2004,70:1207-1212.
[21]Yamakawa S,Yamada R,Tanaka T,Ogino C,Kondo A.Repeated batch fermentation from raw starch using a maltose transporter and amylase expressing diploid yeast strain[J].Appl Microbiol Biotechnol,2010,87:109.
[22]Hong J,Wang Y,Kumagai H,Tamaki H.Construction of thermotolerant yeast expressing thermostable cellulase genes[J].J Biotechnol,2007,130:114-123.
[23]Nonklang S,Abdelnanat B M A,Cha-aim K,Moonjai N,Hoshida H,Limtong S,et al.High-temperature ethanol fermentation and transformation with linear DNA in the thermotolerant yeast Kluyveromyces marixianus DMKU3-1042[J].Appl Environ Microbiol,2008,74:7514-7521.
[24]Voronovsky A Y,Rohuya O V,Abbas C A,Sibirny A A.Development of strains of the thermotolerant yeast Hansenula polymorpha capable of alcoholic fermentation of starch and xylan[J].Metab Eng,2009,11:234-242.
[25]Sakamoto T,Hasunuma T,Hori Y,Yamada R,Kondo A.Direct ethanol production from hemicellulosic materials of rice straw by use of an engineered yeast strain codisplaying three types of hemicellulolytic enzymes on the surface of xylose-utilizing Saccharomyces cerevisiae cells[J].J Biotechnol,2012,158:203-210.
