60Co-γ和离子束注入对甜菊杂交后代种子萌发和幼苗生长的影响
2013-12-14杨敬敏黄苏珍杨永恒
杨敬敏,黄苏珍,杨永恒
〔江苏省·中国科学院植物研究所(南京中山植物园),江苏南京210014〕
甜菊(Stevia rebaudiana Bertoni)又名甜叶菊,隶属于菊科(Asteraceae)甜菊属(Stevia Cav.),为多年生草本植物,原产南美洲巴拉圭与巴西交界的阿曼拜山脉,当地原住民很早就将甜菊作为糖料使用。从甜菊中获得的甜味提取物甜菊糖苷的甜度约为蔗糖的300倍,不但甜度高,还具有热量低、口感好、稳定性强的特点,对高血压、糖尿病和儿童龋齿也有预防和辅助治疗作用,目前被誉为“最佳天然甜味剂”[1-2]。甜菊自20世纪70年代中期引入中国后被广泛引种和推广栽培,目前中国已成为全世界最大的甜菊种植国及甜菊糖苷的生产和出口国。甜菊优良品种选育与优质甜菊糖苷的生产密切相关,因此选育具有甜菊糖苷含量高、高产并具有优良抗性的新品种是甜菊育种的主要目标[3-4]。
目前,常规育种方法是杂交育种,它可以将2个亲本的不同优良性状集中于同一后代,但受选育周期较长和自然变异率较低等因素限制[5-6]。辐射诱变因其变异率较高和较易获得变异材料等优点被广泛应用于作物育种[7-9]。甜菊种子十分细小且表皮极薄,对γ射线和离子的阻挡作用较低,使γ射线和离子很易直接作用于种胚DNA,低剂量的射线和离子注入即可产生显著的影响,因而适宜进行γ射线和离子注入诱变[10]。诸多研究结果均表明利用辐射诱变进行甜菊育种是有效的[10-16]。沈明山等[12]的研究结果表明:注入碳离子的甜菊种子的萌发率和株高均高于对照组。舒世珍等[15-16]认为:使用一定剂量的氮离子束辐射处理甜菊种子,不仅可以促进幼苗根及叶的生长、提高产量,同时还可以提高糖苷含量以及莱鲍迪苷A的含量。
作者以甜菊5个杂交组合F1代种子[17]为实验材料,选用60Co-γ和离子束为辐射源进行辐照,对种子萌发率和幼苗成活率进行比较,同时对实生单株的生长和形态指标进行观测与分析,以期筛选出兼具抗寒和优良农艺性状的甜菊优良单株,并为甜菊诱变育种的进一步研究提供理论依据。
1 材料和方法
1.1 材料
供试材料为甜菊人工杂交种子,于2010年8月至11月通过人工杂交获得。杂交组合及其种子数量分别为:组合Ⅰ‘守田2号’ב中山3号’(‘Shoutian No.2’בZhongshan No.3’)F1代种子 292 粒;组合Ⅱ‘守田 2号’ב中山 4号’(‘Shoutian No.2’בZhongshan No.4’)F1代种子271粒;组合Ⅲ‘中山3号’ב守田2号’(‘Zhongshan No.3’בShoutian No.2’)F1代种子149粒;组合Ⅳ‘中山3号’ב守田3号’(‘Zhongshan No.3’בShoutian No.3’)F1代种子220粒;组合Ⅴ‘守田3号’自交(‘Shoutian No.3’בShoutian No.3’)F1代种子346粒,共计1 278粒种子。
杂交亲本品种‘中山3号’、‘中山4号’、‘守田2号’和‘守田3号’均来源于江苏省·中国科学院植物研究所,其中,‘中山3号’为总苷高含量品种,‘中山4号’为莱鲍迪苷A高含量兼较高产品种,‘守田2号’为高产品种,‘守田3号’为莱鲍迪苷A高含量品种[18]。
1.2 方法
1.2.1 诱变处理 诱变辐射源分别为60Co-γ和离子束。将各杂交组合种子平均分成3组,分别为对照、60Co-γ 注入(剂量15 Gy,剂量率0.5 Gy·min-1)和离子束注入(能量 20 keV,剂量 2.6×1016N+·cm-2)处理组。60Co-γ注入在安徽双丰农业高新技术有限责任公司进行,离子束注入在中国科学院合肥物质科学研究院进行,对照组种子不进行任何处理。
1.2.2 播种和育苗 于2011年4月上旬至5月下旬进行播种和育苗。将对照及辐射处理后的种子按照不同的杂交组合和处理分别播种于育苗盘(长和宽均为40.0 cm、高4.5 cm)中,栽培基质为V(细沙)∶V(园土)∶V(泥炭)=1∶1∶2 的混合基质。播种前轻轻揉搓去掉冠毛,分小区均匀播在基质上,轻轻覆1层薄土。播种后保持基质湿润,自然光照。每天观察种子的发芽情况,记录各处理各杂交组合种子的发芽数并计算发芽率。待实生苗长至5~6对真叶时移栽至大田中,统计不同处理各杂交组合幼苗的存活数并计算存活率。
1.2.3 植株形态学性状观测 对定植在田间的5个杂交组合后代的所有实生植株的形态性状(包括株高、叶宽、叶长、茎粗、分枝数、节数和平均节间长度)进行观测,观测时期为初蕾期,即植株最早出现花蕾的时期。株高为从地面到植株顶端的高度;叶宽为植株中部最宽叶片的宽度;叶长为植株中部最长叶片叶基至叶尖的长度;茎粗为距地面5 cm处主茎的直径;分枝数为着生于主茎10 cm以上的一级分枝数;节数为主茎上第1节至顶芽间的节数;以株高除以主茎的节数计算平均节间长度。其中,株高用卷尺测量,叶宽和叶长用直尺测量,茎粗用游标卡尺测量;每个指标重复测量3次,取平均值。
在植株越冬休眠前统计从植株基部萌发的脚芽数量,以此评价杂交组合后代植株的耐寒性。
1.3 数据处理
按以下公式计算种子发芽率和幼苗成活率[19-20]:种子发芽率=(发芽种子数/播种种子数)×100%;幼苗成活率=(成活幼苗数/发芽种子数)×100%。采用Excel 2010和SPSS 16.0统计分析软件对数据进行差异显著性分析以及变异系数[21]计算。
2 结果和分析
2.1 60Co-γ和离子束注入对甜菊不同杂交组合后代种子发芽率和幼苗成活率的影响
经60Co-γ和离子束注入处理后甜菊不同杂交组合F1代种子的发芽率和幼苗的成活率见表1。由表1可以看出:与对照相比,经60Co-γ注入后的杂交组合‘中山3号’ב守田2号’后代种子和经离子束注入后的杂交组合‘守田2号’ב中山3号’后代种子的发芽率显著高于对照组,经60Co-γ和离子束注入后的其他杂交组合后代种子的发芽率均显著低于对照组。从幼苗成活率看,经60Co-γ注入后杂交组合‘守田2号’ב中山3号’和‘守田2号’ב中山4号’以及经离子束注入后的杂交组合‘中山3号’ב守田2号’及‘中山3号’ב守田3号’后代幼苗的成活率均显著高于对照,而在这2种辐照条件下其他杂交组合后代幼苗的成活率均显著低于对照。说明使用合适的辐射源对于提高甜菊杂交组合后代的种子发芽率和幼苗成活率有一定作用。

表1 60Co-γ和离子束注入对甜菊不同杂交组合F1代种子发芽率和幼苗成活率的影响1)Table 1 Effects of60Co-γ and ion beam injections on F1seed germination and seedling survival rate of different cross combinations of Stevia rebaudiana Bertoni1)
从5个杂交组合后代种子发芽率和幼苗成活率的平均值来看,这2种辐照方式均对甜菊杂交后代种子萌发有一定影响,60Co-γ和离子束注入后种子发芽率的平均值均显著低于对照,其中离子束注入后种子发芽率的平均值降幅更大;60Co-γ注入后5个杂交组合后代幼苗成活率的平均值均显著高于对照,而离子束注入后幼苗成活率的平均值均显著低于对照。此外,由表1还可见:60Co-γ和离子束注入后各杂交组合后代种子发芽率和幼苗成活率的变异系数均显著大于对照。
上述研究结果说明:60Co-γ和离子束注入对甜菊的种子发芽率和幼苗成活率产生了显著的诱导效应,对部分杂交组合后代种子发芽率和幼苗成活率的提高有一定的作用。
2.2 60Co-γ和离子束注入对甜菊不同杂交组合后代幼苗植株形态性状的影响
2.2.1 对茎部形态性状的影响 经60Co-γ和离子束注入处理后甜菊不同杂交组合后代植株茎部形态性状的变化见表2。
从株高看,仅离子束注入后的‘守田2号’ב中山3号’杂交组合后代和‘守田3号’自交后代幼苗的株高与对照组间差异不显著,其他处理组各杂交组合后代幼苗的株高均显著低于对照组,说明60Co-γ和离子束注入这2种辐射处理方式均有助于甜菊杂交后代植株的矮化。
从节数看,经60Co-γ注入后5个杂交组合后代幼苗的节数均显著低于对照组;而离子束注入后,仅‘中山3号’ב守田3号’杂交后代幼苗的节数显著低于对照组,其他杂交组合后代幼苗的节数与对照组间均无显著差异。说明60Co-γ注入对甜菊植株节数的诱变效果较为显著。
表2 60Co-γ和离子束注入对甜菊不同杂交组合后代幼苗茎部形态性状的影响(±SE)1)Table 2 Effects of60Co-γ and ion beam injections on stem morphological character of progeny seedlings of different cross combinations of Stevia rebaudiana Bertoni(±SE)1)
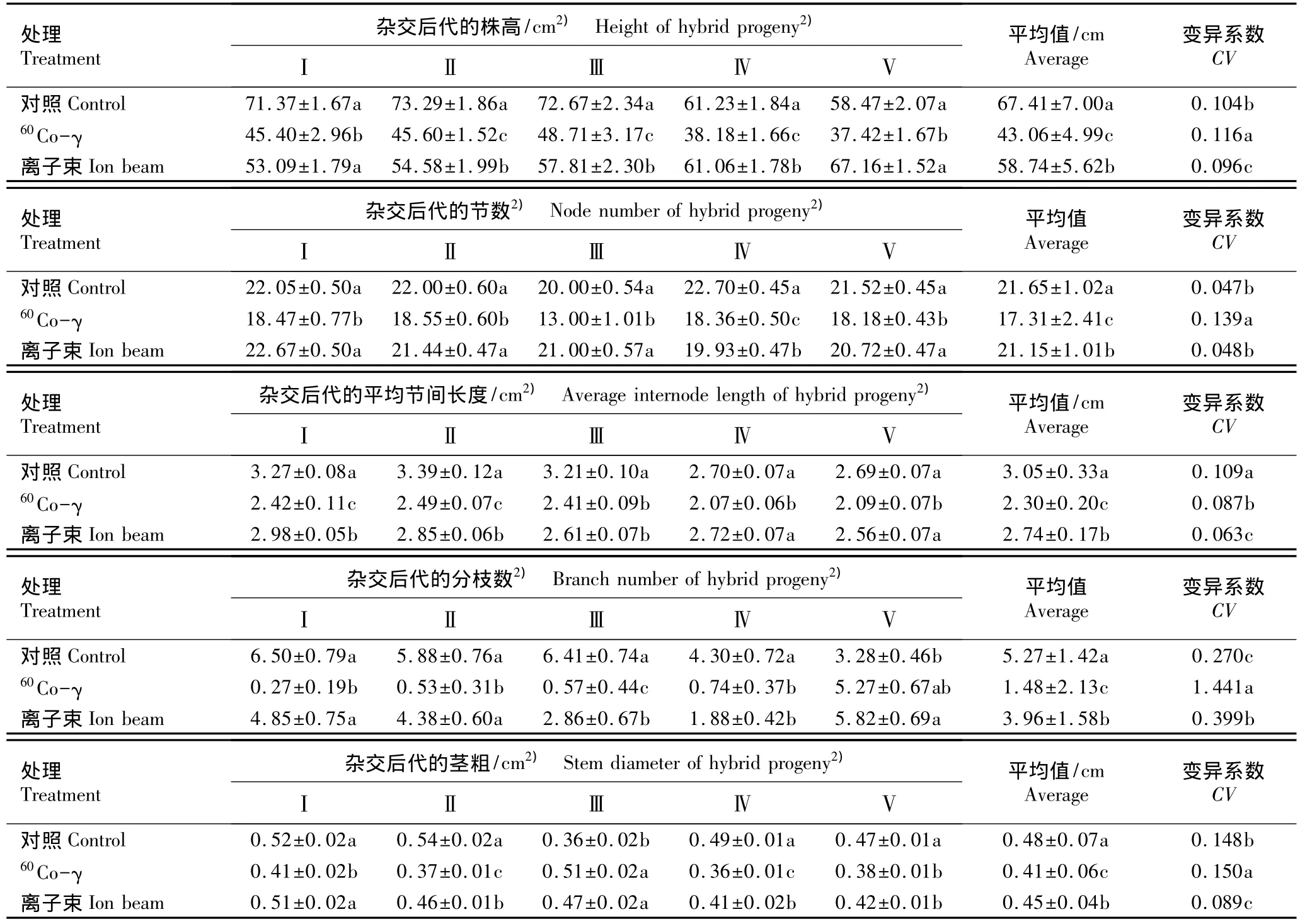
表2 60Co-γ和离子束注入对甜菊不同杂交组合后代幼苗茎部形态性状的影响(±SE)1)Table 2 Effects of60Co-γ and ion beam injections on stem morphological character of progeny seedlings of different cross combinations of Stevia rebaudiana Bertoni(±SE)1)
1)同列中不同的小写字母表示差异显著(P<0.05)Different small letters in the same column indicate the significant difference(P<0.05).2)Ⅰ:‘守田2号’ב中山3 号’‘Shoutian No.2’בZhongshan No.3’;Ⅱ:‘守田2 号’ב中山4 号’‘Shoutian No.2’בZhongshan No.4’;Ⅲ:‘中山3号’ב守田2号’‘Zhongshan No.3’בShoutian No.2’;Ⅳ:‘中山3 号’ב守田3号’‘Zhongshan No.3’בShoutian No.3’;Ⅴ:‘守田3 号’ב守田3 号’‘Shoutian No.3’בShoutian No.3’.
?
从平均节间长度看,除‘中山3号’ב守田3号’和‘守田3号’ב守田3号’杂交组合外,经60Co-γ和离子束注入后其他杂交组合后代幼苗的平均节间长度均显著低于对照组。说明60Co-γ和离子束注入均可诱导甜菊植株节间长度缩短,有利于株型紧凑型后代的诱导。
从分枝数看,经60Co-γ和离子束注入后‘守田3号’自交后代幼苗的分枝数较对照组有所增加;而经60Co-γ和离子束注入后其他杂交组合后代幼苗的分枝数则均较对照组有所降低。说明2种辐射源处理均能诱导‘守田3号’自交后代幼苗分枝数的增加,有利于筛选高产后代单株;而对于其他杂交组合,这2种辐射源处理均能诱导后代幼苗分枝数的减少,有利于抗倒伏后代单株的筛选。
从茎粗看,经过60Co-γ和离子束注入处理后,‘中山3号’ב守田2号’杂交后代植株的茎粗显著增加,‘守田2号’ב中山4号’和‘中山3号’ב守田3号’杂交组合后代及‘守田3号’自交后代植株的茎粗均较对照组显著降低;经60Co-γ注入处理后‘守田2号’ב中山3号’杂交组合后代植株的茎粗显著小于对照组,而经离子束注入后其后代植株的茎粗与对照组无显著差异。说明60Co-γ和离子束注入这2种辐照方式对甜菊不同杂交后代植株茎粗的诱变效应有差异,选择合适的杂交组合进行诱变有可能得到茎粗增加的变异后代。
从5个杂交组合后代茎部形态性状5个指标的平均值来看,经60Co-γ和离子束注入后,植株的株高、节数、分枝数、平均节间长度及茎粗均显著低于对照,而且60Co-γ处理组5个指标的平均值均显著低于离子束处理组。说明60Co-γ和离子束注入均对植株茎部上述各指标有显著诱变作用,而且60Co-γ注入的诱变作用较离子束注入更显著。因此,采用这2种辐射源处理均有助于选育分枝较少、节间较短的株型紧凑型甜菊植株后代。
经60Co-γ注入后各杂交组合后代植株的株高、节数及分枝数的变异系数均显著高于对照组,说明经60Co-γ注入后各杂交组合后代植株的这3个茎部指标的变异谱增加,从不同杂交组合后代中筛选出植株高、节间短和分枝多等性状植株的概率增加,从而有利于获得高产后代单株。经离子束注入后各杂交组合后代植株的株高和平均节间长度的变异系数显著低于对照,分枝数则显著高于对照组,而节数的变异系数与对照差异不显著,表明离子束注入有利于矮生、株型紧凑且分枝多的后代单株的选育。经离子束注入后各杂交组合后代植株茎粗的变异系数显著低于对照,但经60Co-γ注入后茎粗的变异系数显著高于对照,说明通过60Co-γ诱变可筛选得到相对抗倒伏的后代单株。
2.2.2 对叶部形态性状的影响 经60Co-γ和离子束注入处理后甜菊不同杂交组合后代植株叶部性状的变化见表3。
由表3可以看出:经60Co-γ和离子束注入后,‘守田2号’ב中山3号’杂交后代的叶宽及叶宽/叶长比均显著低于对照组,‘守田2号’ב中山4号’杂交后代的叶宽、叶长及叶宽/叶长比均显著低于对照组;经离子束注入后‘守田3号’自交后代的叶宽及叶宽/叶长比也显著低于对照组;而经60Co-γ和离子束这2种辐射源处理后其他杂交组合后代的3个指标与对照组均无显著差异。
从叶部3个性状指标的平均值和变异系数来看,经60Co-γ及离子束注入后5个杂交组合后代植株的叶宽和叶长的平均值均显著低于对照组;植株叶长的变异系数均高于对照组,而叶宽以及叶宽/叶长比的变异系数均低于对照组,说明经60Co-γ和离子束这2种辐射源处理后甜菊杂交后代植株叶长的变异概率增加。
2.2.3 对越冬前脚芽数量的影响 经60Co-γ和离子束注入后甜菊不同杂交组合后代植株越冬前脚芽数量的变化见表4。
从表4可以看出:经60Co-γ注入后‘守田2号’ב中山4号’和‘中山3号’ב守田2号’杂交组合后代植株越冬前萌发的脚芽数量显著低于对照组,而经60Co-γ和离子束这2种辐射源处理后其他杂交组合后代的脚芽数量均与对照组无显著差异。
从脚芽数量的平均值和变异系数看,经60Co-γ和离子束注入后,5个甜菊杂交组合后代植株在越冬前萌发的脚芽数量平均值均显著低于对照组,而脚芽数量的变异系数均显著高于对照组,表明60Co-γ和离子束注入对甜菊杂交后代植株越冬前脚芽的萌发有较大影响,从而也说明辐射诱变是甜菊抗寒后代选育的有效方法之一[22]。
表3 60Co-γ和离子束注入对甜菊不同杂交组合后代幼苗叶部形态性状的影响(±SE)1)Table 3 Effects of60Co-γ and ion beam injections on leaf morphological character of progeny seedlings of different cross combinations of Stevia rebaudiana Bertoni(±SE)1)
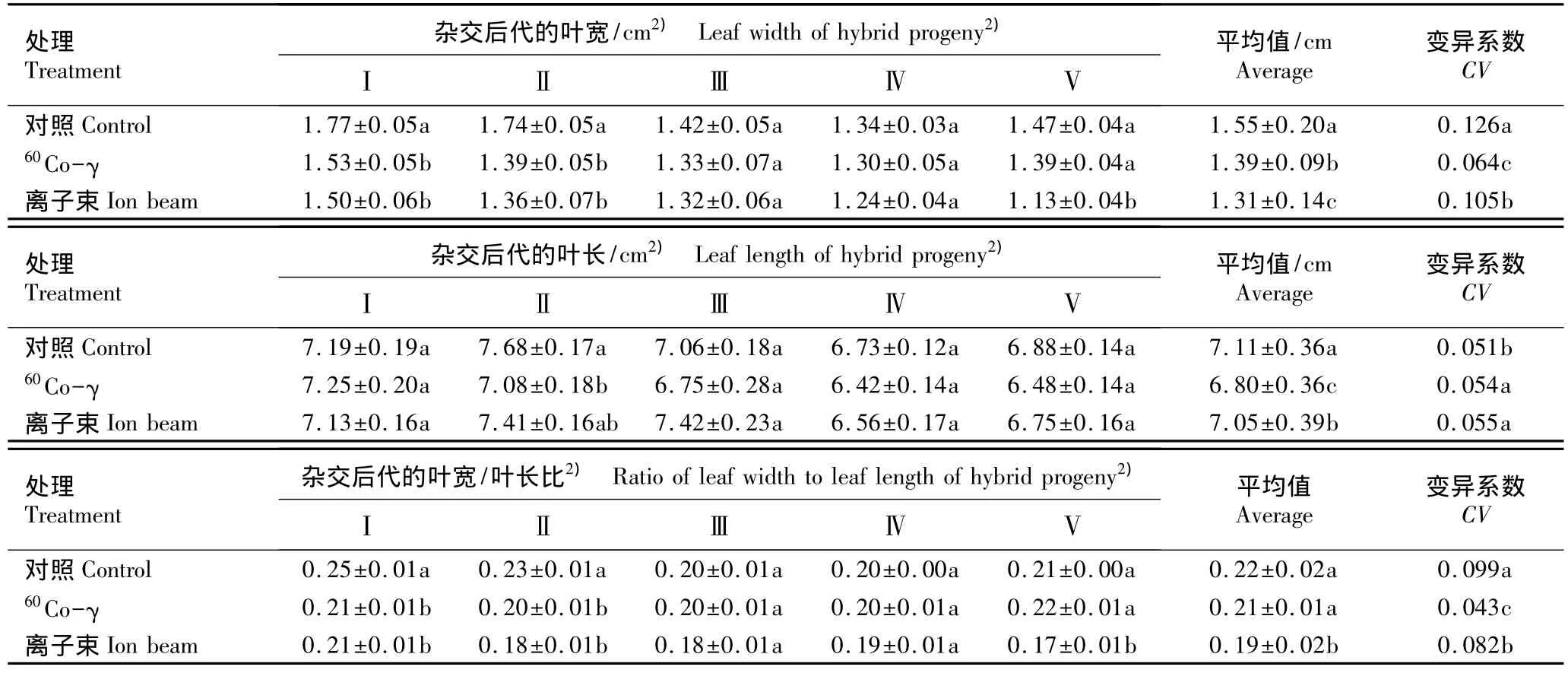
表3 60Co-γ和离子束注入对甜菊不同杂交组合后代幼苗叶部形态性状的影响(±SE)1)Table 3 Effects of60Co-γ and ion beam injections on leaf morphological character of progeny seedlings of different cross combinations of Stevia rebaudiana Bertoni(±SE)1)
1)同列中不同的小写字母表示差异显著(P<0.05)Different small letters in the same column indicate the significant difference(P<0.05).2)Ⅰ:‘守田2号’ב中山3 号’‘Shoutian No.2’בZhongshan No.3’;Ⅱ:‘守田2 号’ב中山4 号’‘Shoutian No.2’בZhongshan No.4’;Ⅲ:‘中山3号’ב守田2号’‘Zhongshan No.3’בShoutian No.2’;Ⅳ:‘中山3 号’ב守田3号’‘Zhongshan No.3’בShoutian No.3’;Ⅴ:‘守田3 号’ב守田3 号’‘Shoutian No.3’בShoutian No.3’.
?
表4 60Co-γ和离子束注入对甜菊不同杂交组合后代植株越冬前脚芽数量的影响(±SE)1)Table 4 Effects of60Co-γ and ion beam injections on rhizome sucker number of progeny seedlings of different cross combinations of Stevia rebaudiana Bertoni before overwintering(±SE)1)
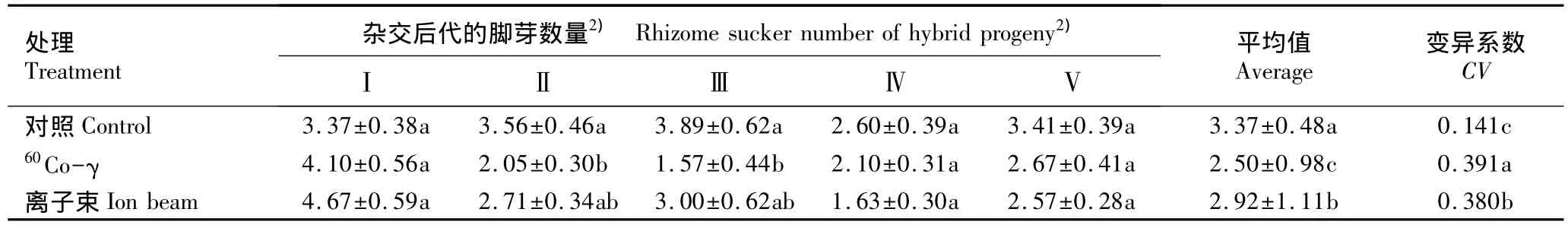
表4 60Co-γ和离子束注入对甜菊不同杂交组合后代植株越冬前脚芽数量的影响(±SE)1)Table 4 Effects of60Co-γ and ion beam injections on rhizome sucker number of progeny seedlings of different cross combinations of Stevia rebaudiana Bertoni before overwintering(±SE)1)
1)同列中不同的小写字母表示差异显著(P<0.05)Different small letters in the same column indicate the significant difference(P<0.05).2)Ⅰ:‘守田2号’ב中山3 号’‘Shoutian No.2’בZhongshan No.3’;Ⅱ:‘守田2 号’ב中山4 号’‘Shoutian No.2’בZhongshan No.4’;Ⅲ:‘中山3号’ב守田2号’‘Zhongshan No.3’בShoutian No.2’;Ⅳ:‘中山3 号’ב守田3号’‘Zhongshan No.3’בShoutian No.3’;Ⅴ:‘守田3 号’ב守田3 号’‘Shoutian No.3’בShoutian No.3’.
?
3 讨 论
甜菊为异花授粉植物,因此其有性繁殖品种的品质极易退化,而甜菊优良品种选育与优质甜菊糖的生产密切相关。辐射诱导突变是选育植物新品种的快速有效方法之一,其有价值突变体的获得率主要受被辐射材料、辐射源种类及辐射剂量等因素影响[23-25]。本实验结果表明:采用60Co-γ和离子束注入处理甜菊杂交组合F1代种子,有利于部分甜菊杂交组合种子发芽率和幼苗成活率的提高。Shen等[12]的研究结果也表明:碳离子注入甜菊种子后,种子萌发期的合成代谢和呼吸代谢能力明显强于对照组。辐射在单一性状改良方面,特别是在降低株高[11]、提高抗性、缩短生育期、改变花色等方面,具有更快更理想的效果[26]。本实验结果表明:选取适宜的60Co-γ和离子束注入剂量有助于选育叶形一致、分枝较少、节间长度较短、株型紧凑、抗倒伏、抗寒的甜菊矮型植株,但这2种处理方式对不同杂交组合后代植株不同性状的诱变效应并不完全一致,说明辐射诱发的突变具有一定的随机性,应对筛选出来的表型特异的植株进行反复鉴定,以确定其表型性状的可靠性和遗传稳定性[27]。
采用传统杂交育种方法结合辐射诱变进行甜菊育种,可以提高突变频率,得到丰富的变异体,增加选择几率,缩短育种周期,可为甜菊育种提供丰富的育种材料,但辐射诱变的方法和剂量要根据实际需要不断完善。从辐射诱变后甜菊不同杂交组合后代植株的主要形态指标及变异幅度看,利用60Co-γ和离子束辐射诱变在一定程度上拓宽了甜菊的遗传谱,从而提高了获得优良后代单株的可能性。
[1]苗玉新.甜菊的综合利用[J].黑龙江农业科学,1998(2):42-43.
[2]MAURI P,CATALANO G,GARDANA C,et al.Analysis of Stevia glycosides by capillary electrophoresis[J].Electrophoresis,1996,17:367-371.
[3]SHIBATA H,SONOKE S,OCHIAI H,et al.Glucosylation of steviol and steviol-glucosides in extracts from Stevia rebaudiana Bertoni[J].Plant Physiology,1991,95:152-156.
[4]YADAV A K,SINGH S,DHYANI D,et al.A review on the improvement of stevia 〔Stevia rebaudiana(Bertoni)〕[J].Canadian Journal of Plant Science,2011,91(1):1-27.
[5]杨兆民,张 璐.辐射诱变技术在农业育种中的应用与探析[J].基因组学与应用生物学,2011,30(1):87-91.
[6]王少平.辐射育种在园林植物育种中的应用[J].种子,2008,27(12):63-68.
[7]郭建秋.电离辐射和航天搭载对大豆的诱变效应[D].北京:中国农业科学院作物科学研究所,2008.
[8]YANG Z,PENG X M,PENG W Z,et al.Study on mutagenic effect of space flight in two-line sterile rice[J].Agricultural Science and Technology,2009,10(4):105-107,174.
[9]王俊敏,徐建龙,魏力军,等.空间环境和地面γ辐照对水稻诱变的差异[J].作物学报,2006,32(7):1006-1010.
[10]慎 玫,王彩莲,陈秋方,等.氮离子注入甜菊的细胞学效应[J].核农学报,1997,11(3):141-144.
[11]罗茂春,沈明山,徐金森,等.低能碳离子对甜菊生长和叶绿体发育的影响[J].厦门大学学报:自然科学版,2000,39(1):96-101.
[12]SHEN M S,JIANG X Z,XU J S,et al.Biological effects of Stevia rebaudianum induced by carbon ion implantation[J].植物学报,2000,42(9):892-897.
[13]沈明山,徐金森,丁 亮,等.氮离子注入对甜菊幼苗生长发育和细胞核的影响[J].厦门大学学报:自然科学版,2000,39(3):386-391.
[14]王彩莲,慎 玫,陈秋方,等.离子注入甜菊的诱变效应研究[J].核农学报,1998,12(6):347-352.
[15]舒世珍,王彩莲,陈秋芳,等.离子注入甜菊种子生物效应的研究Ⅰ.低能离子注入甜菊种子对其植物学性状的影响[J].中国糖料,1998(1):14-17.
[16]舒世珍,陆 挺,王彩莲,等.离子注入甜菊种子生物效应的研究Ⅱ.甜菊糖甙成分及其产量分析[J].中国糖料,1998(4):6-9.
[17]吴广文,王其斌,简善亮,等.甜菊杂种优势利用和制种技术研究[J].安徽农学通报,2005,11(1):73-74.
[18]杨永恒,黄苏珍,佟海英.甜菊不同杂交组合结实率及其F1代萌发和生长及对NaCl耐性的比较[J].植物资源与环境学报,2012,21(2):73-78.
[19]韩玉林,黄苏珍,汪鸿江,等.甜菊扦插繁殖快速成苗的研究[J].特产研究,2001(2):36-37.
[20]汤访评,陈素梅,陈发棣,等.栽培菊与菊属—近缘属杂种远缘杂交的研究[J].园艺学报,2011,38(1):101-107.
[21]张国防,于静波,冯 娟.芳樟无性系叶精油及芳樟醇含量变异分析[J].植物资源与环境学报,2012,21(2):117-118.
[22]许 瑛,陈发棣.菊花8个品种的低温半致死温度及其抗寒适应性[J].园艺学报,2008,35(4):559-564.
[23]程备久,李 展,王公明,等.氮离子注入棉花种子的诱变效应[J].核农学报,1993,7(2):73-80.
[24]张慧琴,谢 鸣,蒋桂华,等.60Co-γ射线对草莓组培苗诱变效应[J].浙江大学学报:农业与生命科学版,2007,33(2):180-183.
[25]刘丽强,刘军丽,张 杰,等.60Co-γ辐射对观赏海棠组培苗的诱变效应[J].中国农业科学,2010,43(20):4255-4264.
[26]洪亚辉,朱兆海,黄 璜,等.菊花组织培养与辐射诱变的研究[J].湖南农业大学学报:自然科学版,2003,29(6):457-461.
[27]李中存.辐射小麦幼胚诱发和筛选白粉病抗性突变体的研究[J].华北农学报,2002,17(2):58-61.
