湖北海棠类甜蛋白基因MhPR5的克隆与表达特性分析
2013-12-14张计育渠慎春乔玉山郭忠仁
张计育,渠慎春,乔玉山,章 镇,①,郭忠仁,①
〔1.江苏省·中国科学院植物研究所(南京中山植物园),江苏南京210014;2.南京农业大学园艺学院,江苏南京210095〕
在生长发育和进化过程中,植物通常会遇到生物和非生物方面的胁迫,其中,生物胁迫主要包括病原真菌、细菌和病毒感染以及昆虫和草食动物破坏等,而非生物胁迫则主要包括盐害、冷害、涝害以及组织器官受到伤害等[1]。各种胁迫均可诱导植物产生防御反应,通过合成活性氧、植物抗毒素、细胞壁组成物质、病程相关蛋白等物质抵抗胁迫环境对植物的伤害。1970年,Loon等[2]首先在烟草花叶病毒(TMV)侵染的烟草(Nicotiana tabacum Linn.)叶片中检测到与过敏性反应(HR)相关的蛋白,称为病程相关蛋白(pathogenesis-related proteins,PRs)。根据蛋白的结构和生物功能,可将PRs分为17个亚类[3]。其中,病程相关蛋白PR-5家族的氨基酸序列与西非竹竽〔Thaumatococcus danielli(Benn.)Benth.et Hook.f.〕的甜蛋白高度同源,故其又被称为类甜蛋白(thaumatin-like proteins,TLPs),该蛋白具有 β-1,3 葡聚糖酶活性、蛋白酶活性、抗真菌活性以及抑制α-淀粉酶和反转录酶活性等多种生物学活性[4]。类甜蛋白基因(即PR5基因)是植物在受到病原微生物侵害时体内诱导产生的病程相关蛋白基因家族的重要成员之一,能够参与多种真菌的抗性反应过程,目前多位研 究 者 已 从 水 稻 (Oryza sativa Linn.)[5-6]、番 茄(Lycopersicon esculentum Mill.)[7]和马 铃薯 (Solanum tuberosum Linn.)[8]等多种植物中分离到该基因序列。
湖北海棠〔Malus hupehensis(Pamp.)Rehd.〕原产中国,具有较强抗性,为苹果(M.domestic Borkh.)嫁接时重要的砧木之一。近几年来,作者对湖北海棠病程相关蛋白基因家族的多个基因进行了克隆、测序与表达特征的分析和研究[9-12],但其中并未涉及PR5基因。
为了能够更加全面了解湖北海棠PR5基因(MhPR5)的生物学功能,作者采用特异引物从湖北海棠基因组DNA和经水杨酸处理的全长cDNA文库中分别克隆获得PR5基因的基因组DNA序列和cDNA序列,利用多种生物信息学软件对MhPR5基因的核苷酸序列及其推导出的氨基酸序列进行分析并与其他物种PR5基因的氨基酸序列进行对比;此外,还利用实时荧光定量RT-PCR技术分析了MhPR5基因在湖北海棠各组织(根、茎和叶)中的表达特性及其在非生物胁迫(4℃低温和200 mmol·L-1NaCl)和生物胁迫〔苹果轮纹病病原菌(Physalospora piricola Nose)和苹果蚜虫(Aphis citricola van der Goot)〕条件下的表达特性,以期为湖北海棠抗逆机制的相关研究以及通过基因工程技术培育苹果抗逆新种质奠定理论基础,并为类甜蛋白基因功能及其在植物抗病过程中的作用机制研究提供实验依据。
1 材料和方法
1.1 材料
实验用湖北海棠组培苗由山东农业大学郝玉金教授赠送;经水杨酸处理的湖北海棠全长cDNA文库由南京农业大学园艺学院果树生物技术实验室提供[13]。使用的 dNTPs、DL2000 Marker、rTaq DNA 聚合酶、DNA消化酶、反转录试剂盒和pMD18-T载体等均购于宝生物工程(大连)有限公司。
1.2 方法
1.2.1 MhPR5基因的克隆和测序 取湖北海棠组培苗叶片,参照文献[14]的方法进行基因组DNA的提取和其中RNA的消化;将基因组DNA和全长cDNA文库均稀释10倍后用于MhPR5基因的克隆。
根据GenBank中登录的苹果PR5基因序列(登录号DQ318213)设计特异引物PR5F1和PR5R1,引物序列分别为5'-ATGATGAAGAGCCAAGCAGC-3'和5'-GTAATCCCATTTCGTGCTTATG-3'。全长 cDNA文库和基因组DNA的MhPR5基因的扩增条件相同,反应体系总体积均为25 μL;反应体系具体组成、PCR反应程序、PCR产物检测及目的片段的回收和克隆等操作均与文献[10]相同。将PCR鉴定呈阳性的克隆交由华大生物技术有限公司完成测序。
1.2.2 MhPR5基因核苷酸及其编码氨基酸的序列分析 参照文献[10]的分析方法进行相关序列分析。将测序得到的MhPR5基因的核苷酸序列及其推导出的氨基酸序列分别在NCBI(http:∥www.ncbi.nlm.nih.gov)上用BLASTn和BLASTp进行序列相似性分析;并利用BioEdit中的Clustal W程序将它们与GenBank数据库中收录的拟南芥〔Arabidopsis thaliana(Linn.)Heynh.〕、苹果和梨〔Pyrus pyrifolia(Burm.f.)Nakai〕的PR5基因序列进行多序列比对,分析序列中存在的保守氨基酸残基和结构域;采用ProtParam(http:∥au.expasy.org/tools/protparam.html)分析MhPR5基因编码的蛋白质的相对分子质量及等电点等理化性质;利用Signal P程序(http:∥genome.cbs.dtu.dk/services/SignalP/)分析该蛋白质N-末端的信号肽序列。
1.2.3 MhPR5基因的表达特性分析 将湖北海棠组培苗进行生根培养,培养条件和生根培养基配方参照文献[10];生根培养3周后分别取组培苗的根、茎和叶进行MhPR5基因组织表达特性分析,各重复3次。
对生根培养3周的组培苗分别进行苹果轮纹病病原菌和低温处理。苹果轮纹病病原菌的处理方法参照文献[15],具体操作过程:将苹果轮纹病病原菌接种于PDA培养基中,培养1周后,用黑光灯进行照射培养,诱导苹果轮纹病病原菌产生孢子;收集苹果轮纹病病原菌的分生孢子,制成密度约1×106mL-1的悬浮液喷洒于湖北海棠组培苗叶片表面,分别于培养0、3、6、12、24、48、72 和 96 h 取叶片,迅速置于液氮中冷冻后保存于-70℃冰箱中,备用。低温处理方法:将湖北海棠组培苗置于4℃培养箱中分别培养0、4、12和48 h,取叶片迅速置于液氮中冷冻,并保存于-70℃冰箱中,备用。
于2010年5月上旬对2年生湖北海棠盆栽苗分别进行NaCl和苹果蚜虫处理。NaCl处理方法:用200 mmol·L-1NaCl溶液对盆栽苗进行浇灌,每盆约500 mL;分别于处理后0、4、12和48 h取叶片,迅速置于液氮中冷冻后保存于-70℃冰箱中,备用。苹果蚜虫处理方法:将苹果蚜虫置于盆栽苗叶片上侵染1周,分别取经过和未经过苹果蚜虫侵染的叶片,迅速置于液氮中冷冻后保存于-70℃冰箱中,备用。以上实验每处理均为4株苗,各重复3次。
参照文献[13,16-17]的方法提取总 RNA,并根据DNA消化酶(产品编号D2215)说明书中的方法对总RNA中的DNA进行消化;取1 μg经过消化的总RNA,按照反转录说明书中的操作步骤合成cDNA的第1链,稀释10倍后置于-20℃保存,备用。根据克隆获得的 MhPR5基因序列设计特异引物,引物PR5F2的序列为5'-CATGTCCTCCCACAGAGTAC-3',引物PR5R2的序列为5'-ATATAATCCCATTTCGT GCTTATG-3';参照文献[15]进行内参基因Mhtubulin引物的序列设计,引物TF的序列为5'-AGGATGCTA CAGCCGATGAG-3',引物TR的序列为5'-GCCGAA GAACTGACGAGAATC-3'。参考张计育等[15]的方法进行实时荧光定量RT-PCR分析;数据分析采用7300 Real Time PCR System 软件和 2-ΔΔCT方法[18]进行。为了确保反应产物的准确性和单一性,随机挑取3个PCR产物的阳性克隆进行测序。
2 结果和分析
2.1 MhPR5基因的克隆与序列分析
利用特异引物PR5F1和PR5R1从湖北海棠基因组DNA和经水杨酸处理的全长cDNA文库中分离出MhPR5基因,扩增产物的电泳结果见图1。测序结果表明:湖北海棠MhPR5基因全编码区的cDNA序列长度为741 bp,共编码246个氨基酸残基;从湖北海棠基因组DNA获得的MhPR5基因编码区序列长度为1 106 bp,含有1个长度为365 bp的内含子,内含子的接头序列分别为TA和TG。ProtParam分析结果表明:MhPR5基因编码的蛋白质相对分子质量为25 520,等电点为 pI 4.72。

图1 从基因组DNA和经水杨酸处理的全长cDNA文库中获得的湖北海棠MhPR5基因的电泳图谱Fig.1 Electrophoretogram of MhPR5 gene of Malus hupehensis(Pamp.)Rehd.obtained from genomic DNA and full-length cDNA library treated by salicylic acid
2.2 MhPR5基因与其他植物PR5基因编码的氨基酸序列比较分析
相似性比较分析结果表明:湖北海棠MhPR5基因的核苷酸序列与苹果、梨、桃〔Prunus persica(Linn.)Batsch.〕和甜樱桃(P.avium Linn.)PR5 基因核苷酸序列(GenBank登录号分别为 DQ318213、FJ201995、AF362988和 U32440)的同源性分别为98%、95%、82%和75%;MhPR5基因编码的氨基酸序列与苹果、梨和桃PR5基因编码的氨基酸序列(GenBank登录号分别为 AAX19849、ACN97417和 AAM00216)的同源性分别为97%、94%和52%。
湖北海棠MhPR5基因与其他植物PR5基因编码的氨基酸序列的比对结果(图2)表明:MhPR5基因编码的蛋白质含有16个保守的半胱氨酸残基,苹果和梨PR5基因编码的蛋白质也含有同样的16个保守的半胱氨酸残基,与拟南芥中类甜蛋白的氨基酸序列结构组成相似[19],说明该基因序列在物种间具有保守性;在MhPR5基因以及苹果、梨和拟南芥PR5基因编码的氨基酸序列中还含有5个保守的带负电荷的氨基酸残基,这5个氨基酸残基可以在PR5蛋白中形成酸性裂缝[20-22]。另外,在MhPR5基因编码的氨基酸序列的N端还含有1个由25个氨基酸残基组成的信号肽。

图2 湖北海棠MhPR5基因与其他植物PR5基因编码的氨基酸序列的比对结果Fig.2 Comparison result of amino acid sequences encoded by MhPR5 gene of Malus hupehensis(Pamp.)Rehd.and PR5 gene of other species
2.3 MhPR5基因的表达特性分析
2.3.1 组织表达特性分析 利用Mhtubulin作为内参基因,通过实时荧光定量RT-PCR技术对MhPR5基因在生根培养3周的湖北海棠组培苗叶、茎和根中的表达特性进行了分析,结果见图3。MhPR5基因在湖北海棠组培苗根、茎和叶中均有表达,且在叶中的相对表达量最低,在茎中的相对表达量略高,在根中的相对表达量最高。
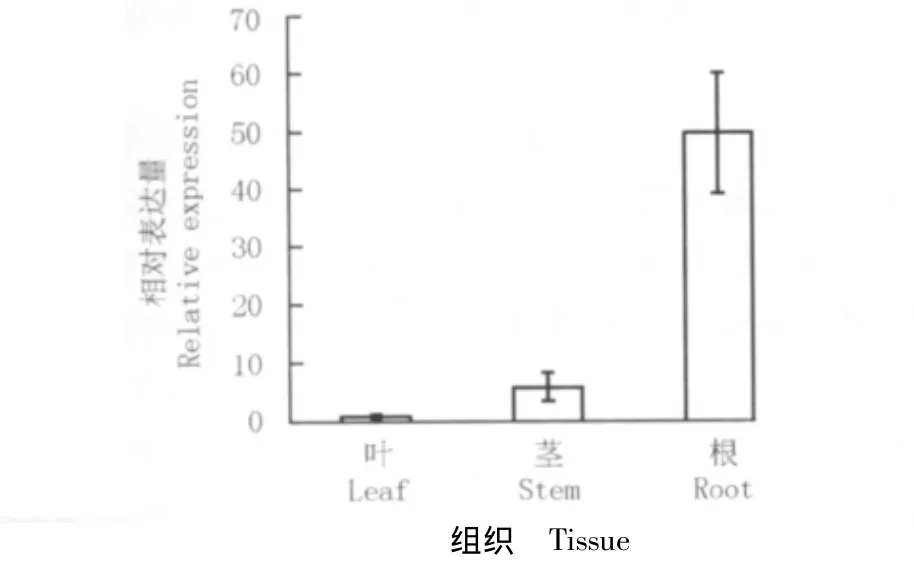
图3 湖北海棠组培苗不同组织中MhPR5基因相对表达量的比较Fig.3 Comparison of relative expression of MhPR5 gene in different tissues of tissue culture seedlings of Malus hupehensis(Pamp.)Rehd.
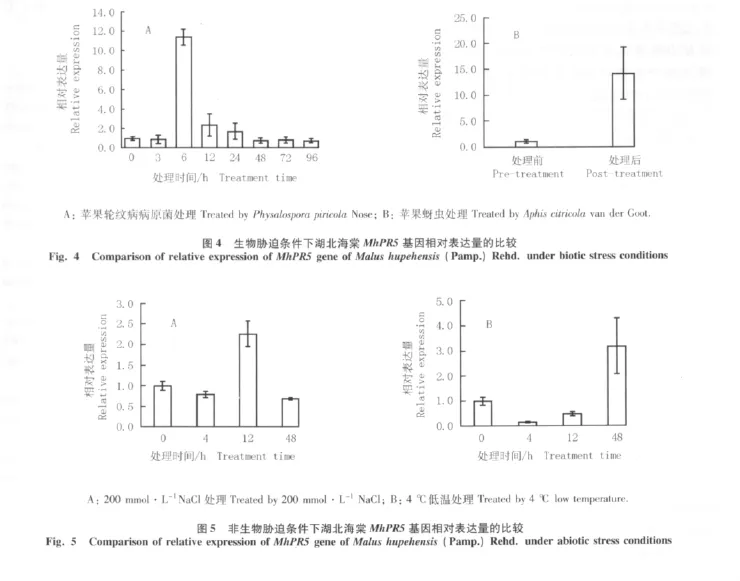
2.3.2 生物胁迫条件下的表达特性分析 实时荧光定量RT-PCR分析结果(图4)表明:在苹果轮纹病病原菌分生孢子和苹果蚜虫侵染条件下,MhPR5基因的表达特性有明显差异。苹果轮纹病病原菌处理6 h后,MhPR5基因的相对表达量最高,为处理前(处理0 h)的11.34倍,随后相对表达量逐渐降低(图4-A);被苹果蚜虫侵染后,MhPR5基因的相对表达量明显提高,为处理前的14.33倍(图4-B)。
2.3.3 非生物胁迫条件下的表达特性分析 在200 mmol·L-1NaCl和4℃低温2种非生物胁迫条件下,MhPR5基因表达特性的实时荧光定量RT-PCR分析结果见图5。结果表明:经200 mmol·L-1NaCl处理12 h后,MhPR5基因的相对表达量最高,为处理前(处理0 h)的2.25倍,随后相对表达量降低,且处理4和48 h后该基因的相对表达量均低于处理前(图5-A);在4℃低温处理48 h内,MhPR5基因的相对表达量呈先降低后升高的趋势,且在处理12 h内相对表达量均低于处理前,处理48 h后相对表达量最高,为处理前的3.17倍(图5-B)。
3 讨论和结论
类甜蛋白最重要的结构特征为其分子结构中具有由16个半胱氨酸残基配对形成的8个二硫键,由于这些二硫键的存在,该蛋白质才具有相对稳定的化学结构,能够抗热、抗酶解和抗酸碱[23]。本研究分离出的湖北海棠MhPR5基因编码的蛋白质含有16个保守的半胱氨酸残基,与拟南芥等种类所包含的类甜蛋白的氨基酸序列结构组成相似,说明PR5基因序列在物种间具有保守性;该基因编码的氨基酸序列还有5个保守的带负电荷的氨基酸残基,它们在PR5蛋白中可以形成酸性裂缝,说明从湖北海棠中分离得到的基因是类甜蛋白基因。
类甜蛋白基因在植物的特定组织和器官中通常表现为低水平组成型表达且表达特性不同。草莓(Fragaria×ananassa Duch.)类甜蛋白基因在植株的叶和花冠中的表达量最大,在根中的表达量中等,在未成熟果实中的表达量最小[24]。本研究中,湖北海棠MhPR5基因在各组织中的表达量也存在一定差异,在根中的相对表达量最高、叶中最低。说明在不同物种中PR5基因的表达存在较大差异。
湖北海棠类甜蛋白MhPR5基因是植物在受到病原微生物侵害时体内诱导产生的病程相关蛋白基因家族的重要成员之一,参与多种真菌抗性反应过程。Datta等[25]在水稻中过量表达水稻的类甜蛋白基因,获得的转基因植株表现出抗水稻纹枯病〔Thanatephorus cucumeris(Frank)Donk〕特性;Chen等[26]将水稻的类甜蛋白基因导入小麦(Triticum aestivum Linn.)体内,获得的转基因植株对小麦赤霉病(Fusarium graminearum Schw.)具有一定的抗性;Jayasankar等[27]发现过量表达类甜蛋白基因可以增强葡萄(Vitis vinifera Linn.)对炭疽病〔Glomerella cingulate(Stonem.)Schr.et Spanld.〕的抗性。本研究中,经苹果轮纹病病原菌分生孢子侵染6 h,MhPR5基因的相对表达量显著升高并达到最大值,说明MhPR5基因参与湖北海棠对苹果轮纹病的抵抗。另外,在受到植食昆虫取食时可诱导植物体内的类甜蛋白基因大量表达,如被麦二叉蚜(Schizapnis graminum Rondani)取 食 后 高 粱 〔Sorghum bicolor(Linn.)Moench〕体内的类甜蛋白基因的转录水平增加数千倍[28]。本研究结果也表明:受到苹果蚜虫侵染后,湖北海棠MhPR5基因的相对表达量较侵染前显著增加。
病程相关蛋白(PRs)在植物抵抗非生物胁迫的过程中也起着非常重要的作用。已有研究表明:逆境条件可诱导植物体内PR基因的表达[29];ABA和干旱胁迫可以诱导水稻体内内切葡聚糖酶基因的表达[30];干旱可以诱导茶树〔Camellia sinensis(Linn.)Kuntze〕体内类甜蛋白基因的表达[31]。本研究中,经200 mmol·L-1NaCl处理12 h和4℃低温处理48 h后,MhPR5基因的相对表达量均较处理前(处理0 h)明显增加,说明MhPR5基因在抵抗非生物胁迫的过程中起着非常重要的作用。
综合分析结果表明:类甜蛋白的氨基酸序列在物种间具有保守性,含有16个保守的半胱氨酸残基和5个保守的带负电荷的氨基酸残基。MhPR5基因在湖北海棠各组织中的表达量有一定差异,在抵抗生物和非生物胁迫过程中可能起着非常重要的作用,苹果轮纹病病原菌、苹果蚜虫、200 mmol·L-1NaCl和4℃低温均可以诱导MhPR5基因的表达。
[1]LEON-REYES A,SPOEL S H,De LANGE E S,et al.Ethylene modulates the role of NONEXPRESSOR OF PATHOGENESISRELATED GENES1 in cross talk between salicylate and jasmonate signaling[J].Plant Physiology,2009,149(4):1797-1809.
[2]Van LOON L C,Van KAMMEN A.Polyacrylamide disc electrophoresis of the soluble leaf proteins from Nicotiana tabacum var.‘Samsun’and‘Samsun NN’:Ⅱ.changes in protein constitution after infection with tobacco mosaic virus[J].Virology,1970,40(2):199-211.
[3]Van LOON L C,REP M,PIETERSE C M J.Significance of inducible defense-related proteins in infected plants[J].Annual Review of Phytopathology,2006,44:135-162.
[4]Van LOON L C,Van STRIEN E A.The families of pathogenesisrelated proteins,their activities,and comparative analysis of PR-1 type proteins[J].Physiological and Molecular Plant Pathology,1999,55:85-97.
[5]REIMMANN C,DUDLER R.cDNA cloning and sequence analysis of a pathogen-induced thaumatin-like protein from rice(Oryza sativa)[J].Plant Physiology,1993,101(3):1113-1114.
[6]KALPANA K,MARUTHASALAM S,RAJESH T,et al.Engineering sheath blight resistance in elite indica rice cultivars using genes encoding defense proteins[J].Plant Science,2006,170(2):203-215.
[7]STINTZI A,HEITZ T,KAUFFMANN S,et al.Identification of a basic pathogenesis-related,thaumatin-like protein of virus-infected tobacco asosmotin[J]. Physiologicaland MolecularPlant Pathology,1991,38:137-146.
[8]PIERPOINT W S,JACKSON P J,EVANS R M.The presence of a thaumatin-like protein,a chitinase and a glucanase among the pathogenesis-related proteins of potato(Solanum tuberosum)[J].Physiological and Molecular Plant Pathology,1990,36:325-333.
[9]张计育,郭忠仁.低温诱导湖北海棠病程相关蛋白基因家族MhPRs的表达[J].上海农业学报,2013,29(1):20-23.
[10]张计育,乔玉山,渠慎春,等.湖北海棠MhPR1a基因的克隆与表达特性分析[J].植物资源与环境学报,2012,21(3):1-7.
[11]张计育,渠慎春,薛华柏,等.湖北海棠病程相关蛋白MhPR8基因的克隆与表达[J].中国农业科学,2012,45(8):1568-1575.
[12]张计育,章 镇,乔玉山,等.湖北海棠MhPR10多基因家族成员的特征分析[J].江西农业学报,2011,23(11):1-4.
[13]张计育,渠慎春,董 畅,等.水杨酸诱导湖北海棠全长cDNA文库的构建及应用[J].西北植物学报,2010,30(8):1527-1533.
[14]佟兆国,王富荣,章 镇,等.一种从果树成熟叶片提取DNA的方法[J].果树学报,2008,25(1):122-125.
[15]张计育,佟兆国,高志红,等.SA、MeJA、ACC和苹果轮纹病病原菌诱导湖北海棠MhWRKY1基因的表达[J].中国农业科学,2011,44(5):990-999.
[16]蔡斌华,张计育,高志红,等.一种改良的提取草莓属叶片总RNA的方法[J].江苏农业学报,2008,24(6):875-877.
[17]张计育,杜小丽,渠慎春,等.一种简便的同步提取烟草叶片DNA和总RNA的方法[J].上海农业学报,2011,27(3):140-143.
[18]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[19]HU X,REDDY A S N.Cloning and expression of a PR5-like protein from Arabidopsis:inhibition of fungal growth by bacterially expressed protein[J].Plant Molecular Biology,1997,34(6):949-959.
[20]BATALIA M A,MONZINGO A F,ERNST S,et al.The crystal structure of the antifungal protein zeamatin,a member of the thaumatin-like, PR-5 protein family[J]. NatureStructural Biology,1996,3(1):19-23.
[21]KOIWA H,KATO H,NAKATSU T,et al.Crystal structure of tobacco PR-5d protein at 1.8 angstrom resolution reveals a conserved acidic cleft structure in antifungal thaumatin-like proteins[J].Journal of Molecular Biology,1999,286(4):1137-1145.
[22]LEONE P,MENU-BOUAOUICHE L,PEUMANS W J,et al.Resolution of the structure of the allergenic and antifungal banana fruit thaumatin-like protein at 1.7-Å[J].Biochimie,2006,88(1):45-52.
[23]SMOLE U,BUBLIN M,RADAUER C,et al.Mal d 2,the thaumatin-likeallergen from apple,is highly resistantto gastrointestinal digestion and thermal processing[J].International Archives of Allergy and Immunology,2008,147(4):289-298.
[24]ZHANG Y,SHIH D S.Isolation of an osmotin-like protein gene from strawberry and analysis of the response of this gene to abiotic stresses[J].Journal of Plant Physiology,2007,164(1):68-77.
[25]DATTA K,VELAZHAHAN R,OLIVA N,et al.Over-expression of the cloned rice thaumatin-like protein(PR-5)gene in transgenic rice plants enhances environmental friendly resistance to Rhizoctonia solani causing sheath blight disease[J].Theoretical and Applied Genetics,1999,98(6):1138-1145.
[26]CHEN W P,CHEN P D,LIU D J,et al.Development of wheat scab symptoms is delayed in transgenic wheat plants that constitutively express a rice thaumatin-like protein gene[J].Theoretical and Applied Genetics,1999,99(5):755-760.
[27]JAYASANKAR S,LI Z J,GRAY D J.Constitutive expression of Vitis vinifera thaumatin-like protein after in vitro selection and its role in anthracnose resistance[J].Functional Plant Biology,2003,30(11):1105-1115.
[28]CHOU J,HUANG Y.Differential expression of thaumatin-like proteins in sorghum infested with greenbugs[J].Zeitschrift für Naturforschung C,2010,65(3/4):271-276.
[29]SRINIVASAN T,KUMAR K R R,MEUR G,et al.Heterologous expression of Arabidopsis NPR1(AtNPR1)enhances oxidative stress tolerance in transgenic tobacco plants[J].Biotechnology Letters,2009,31(9):1343-1351.
[30]AKIYAMA T,PILLAI M A.Molecular cloning,characterization and in vitro expression of a novel endo-1,3-β-glucanase upregulated by ABA and drought stress in rice(Oryza sativa L.)[J].Plant Science,2001,161(6):1089-1098.
[31]SHARMA P,KUMAR S.Differential display-mediated identification of three drought-responsive expressed sequence tags in tea〔Camellia sinensis(L.)O.Kuntze〕[J].Journal of Biosciences,2005,30(2):231-235.
