稃的有无对大赖草种子扩散与萌发特性的影响
2013-12-14古丽娜尔阿不来提周桂玲
古丽娜尔·阿不来提,周桂玲
(新疆农业大学草业与环境科学学院新疆草地资源与生态重点实验室,新疆乌鲁木齐830052)
果实是被子植物特有的繁殖器官,其类型是植物对生态环境适应与演化的直接反映[1]。对果实成熟后果皮不开裂的类群来说,繁殖体的扩散主要以果实为单元,因此,果实的大小、形状及果皮附属物的形态特征对植物的扩散与定居[2-3]以及土壤种子库的形成[4]具有重要影响,也会影响植物种群内和种群间的基因流以及遗传分化。此外,果皮还能抑制种子的水分吸收、胚根生长和气体交换并能产生萌发抑制物影响种子的萌发和幼苗的生长[5-7]。
禾本科(Poaceae)是被子植物中的大科之一,其种类遍布全球并能适应多种生境。禾本科种类通过有性结籽、无融合结籽以及多年生分蘖等繁殖方式保持物种繁衍的延续性和遗传性并产生一定的变异性和适应性,而种子繁殖是禾本科植物的繁殖方式之一[8]。绝大多数禾本科植物的果实为颖果,只有少数种类例外,如隐花草属(Crypsis Ait.)的果实为胞果;不同种类的颖果在形态(如圆柱形、棱形、披针形、鱼身形、椭圆柱形、三棱柱形、三棱锥形和长纺锤形等)和附属结构(微毛、刺毛、大毛和苞片等)上有丰富的多态性,这些特性可导致其扩散行为的差异,并显著影响种子的扩散与萌发特性[9]。
大赖草〔Leymus racemosus(Lam.)Tzvel.〕为禾本科多年生草本,主要分布于中亚及俄罗斯东南部的一些沙漠中,在中国仅分布于新疆额尔齐斯河低阶地的沙地与沙丘上[10],是典型的兼性克隆植物。目前,对大赖草种子萌发特性的研究有少量的报道[11-12]。大赖草果实成熟后带稃脱落,稃对其果实扩散、定居及种子萌发等行为的影响尚未见研究报道。鉴于此,作者对大赖草带稃及去稃果实的扩散特性、种子含水量及活性、种子萌发特性的差异进行比较,以期了解大赖草果实的生态学行为,为探讨大赖草对沙漠荒地的适应性提供基础研究资料。
1 材料和方法
1.1 材料
供试大赖草果实于2011年8月采收于新疆额尔齐斯河沿岸沙丘上自然分布的大赖草居群;地理坐标为北纬47°58'14″、东经86°33'40″,海拔486 m;均为成熟果实。大赖草果实成熟后带稃脱落,为进行比较实验,一部分果实带稃直接供试;另一部分果实用手术刀小心将内外稃去掉,成为去稃种子,供试。
1.2 方法
1.2.1 种子扩散性测定 在室内没有风力的条件下将带稃种子和去稃种子分别从200 cm高处自由落下,研究在静止空气中种子的扩散特性。每类种子各100粒,3次重复;用秒表测定种子降落到地面的时间,计算降落速度。
在室内用电风扇产生水平气流,设置风速分别为1和4 m·s-1,根据其自然的株高,将2类种子分别从70 cm高处释放,模仿种子脱离母体时的状态,研究在流动空气中种子的扩散特性。每类种子各100粒,3次重复;分别测量种子在水平气流作用下水平方向的扩散距离。
1.2.2 种子萌发率比较 设置3个处理组:A组为带稃种子(对照组);B组为去稃种子;C组为去稃种子与稃混合(去稃种子与剥掉的稃组合在一起);每组种子各100粒,4次重复。参照文献[11]将种子在昼25℃、夜15℃各12 h的条件下培养萌发;以胚根突破种皮为判断种子萌发的标准,每隔24 h统计1次种子萌发数,并将萌发种子取出,持续观测20 d。
1.2.3 种子活力测定 将带稃种子和去稃种子装入细网孔尼龙袋中,置于原生境土壤表面90 d,每隔10 d取带稃种子和去稃种子各100粒,分成4组;将种胚剥出后切成两半,放置于质量体积分数0.1%TTC溶液中,在20℃黑暗条件下放置24 h后检测胚活力,若胚呈红色或粉红色则表明种子具有活力。比较自然条件下带稃种子和去稃种子的活力差异。种子活力=(d/c)×100%,式中:d表示未萌发但有活力的种子数,c表示未萌发的种子总数。
将带稃种子和去稃种子放置在60℃烘箱中,分别于处理3、6、9、12和24 h后各取出100粒,分成4组,参照上述方法检测种子活力,比较高温条件下带稃种子和去稃种子的活力差异。
1.2.4 种子吸水性和失水性测定 选带稃和去稃种子各100粒,分成4组,先进行吸水实验:将各组种子分别称量(即吸水第0 min时的质量)后加入蒸馏水,每隔10 min称量1次,记录各组种子的质量,直至质量不再变化为止。随后进行失水实验:在室温28℃ ~30℃、相对湿度约30%条件下,在吸水饱和(即失水0 min)时对每组种子的质量进行称量,然后每隔30 min称量1次并记录种子质量,直至种子质量恢复至干质量为止。种子吸水量及失水量用公式[13]“Wi=〔(Wi-Wd)/Wd〕×100%”计算,式中,Wi和 Wd分别为吸涨种子质量和干种子质量。
1.3 数据分析
利用SPSS 16.0统计分析软件对实验数据进行单因素方差分析(One-way ANOVA)和LSD多重比较;所有数据以±SE表示;并用Sigma Plot 10.0绘图软件绘图。
2 结果和分析
2.1 带稃种子和去稃种子扩散性的比较
在静止空气中,带稃种子和去稃种子的降落速度分别为(3.96±0.06)和(4.81±0.09)m·s-1,去稃种子的降落速度大于带稃种子,差异显著(F=55.6,P<0.05)。在风速1 m·s-1水平气流中,带稃种子和去稃种子的扩散距离分别为(15.26±1.55)和(11.86±1.31)cm;而在风速4 m·s-1的水平气流中,带稃种子和去稃种子的扩散距离分别为(27.80±1.47)和(21.60±1.75)cm;带稃种子的扩散距离均大于去稃种子,差异显著(F1=2.8,F2=7.3,P<0.05)。
2.2 带稃种子和去稃种子萌发率的比较
大赖草带稃种子、去稃种子以及与稃混合的去稃种子的萌发率见图1。带稃种子以及与稃混合的去稃种子的萌发率略高于去稃种子,萌发20 d后三者的萌发率分别为(99.0±1.0)%、(98.0±2.0)%和(97.0±3.0)%,差异不显著(P>0.05),说明稃对大赖草种子萌发有一定促进作用但影响不显著。去稃种子的起始萌发时间以及萌发高峰期均晚于其他2组种子(图1),表明去稃后种子的萌发期有所推迟。
2.3 带稃种子和去稃种子活力的比较
在自然条件下大赖草带稃种子和去稃种子的活力见图2;在高温(60℃)条件下大赖草带稃种子和去稃种子的活力见图3。
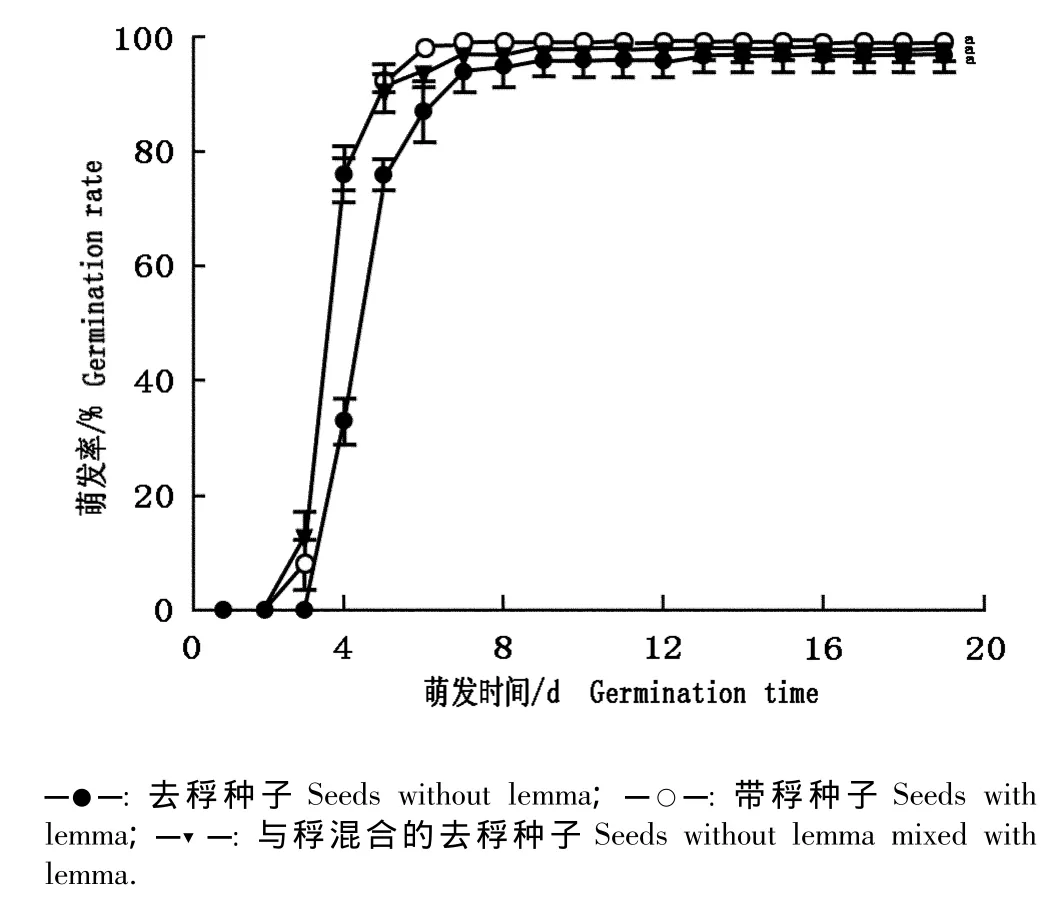
图1 大赖草带稃种子和去稃种子萌发率的比较Fig.1 Comparison of germination rate of Leymus racemosus(Lam.)Tzvel.seeds with or without lemma
由图2可见:随着在土壤表面放置时间的延长,带稃和去稃种子的活力均逐渐降低。在土壤表面放置0 d时,带稃和去稃种子的活力分别为98.0%和96.0%;在土壤表面放置90 d后,带稃和去稃种子的活力分别下降至81.0%和80.0%;总体上看,带稃种子的活力大于去稃种子,但差异不显著(P>0.05)。
由图3可见:在60℃高温条件下,大赖草带稃种子和去稃种子的活力随高温处理时间的延长逐渐下降;处理24 h后带稃种子和去稃种子的活力分别下降至23%和17%。总体上看,带稃种子的活力大于去稃种子,但差异不显著(P>0.05)。
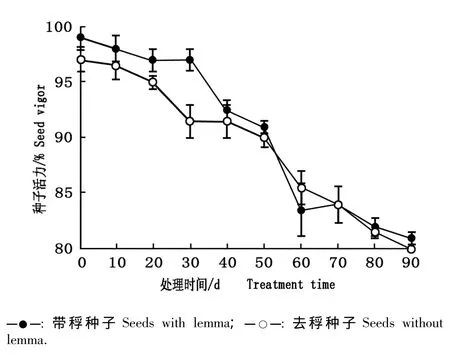
图2 在自然条件下大赖草带稃种子和去稃种子活力的比较Fig.2 Comparison of seed vigor of Leymus racemosus(Lam.)Tzvel.seeds with or without lemma under natural condition
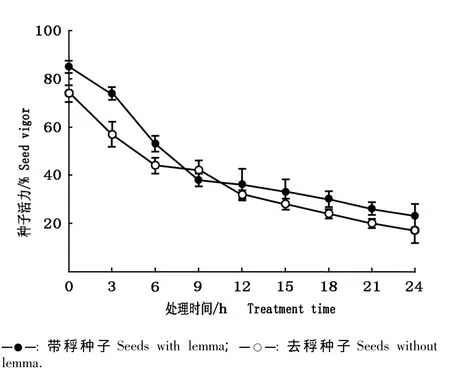
图3 在60℃高温条件下大赖草带稃种子和去稃种子活力的比较Fig.3 Comparison of seed vigor of Leymus racemosus(Lam.)Tzvel.seeds with or without lemma under high temperature(60 ℃)condition
2.4 带稃种子和去稃种子吸水性和失水性的比较
大赖草带稃种子和去稃种子的吸水量和失水量见图4。由图4-A可见:带稃种子在吸水180 min后吸水量达到饱和,种子质量较原质量增加66%;而去稃种子在吸水120 min后吸水量达到饱和,种子质量较原质量增加61%;带稃和去稃种子的吸水量及吸水饱和时间均有显著差异(P<0.05)。
由图4-B可见:在失水过程中,带稃种子在失水8 h后达到干质量标准,而去稃种子在失水7.5 h后达到干质量标准,说明带稃种子失水缓慢,但二者差异不显著(P>0.05)。另外,在失水初期的0~1.5 h内,带稃种子的失水量显著大于去稃种子 (P<0.05),而在2 h后前者的失水量则小于后者。说明稃对大赖草种子的吸水和失水均有一定影响,稃的存在不仅能保障其种子有效吸水还能降低其失水速率。

图4 大赖草带稃种子和去稃种子吸水量(A)和失水量(B)的比较Fig.4 Comparison of water absorption amount(A)and water loss amount(B)of Leymus racemosus(Lam.)Tzvel.seeds with or without lemma
3 讨论和结论
植物的扩散是指植物以各种散布器官离开母体到达安全生境的过程[14],是植物更新的关键阶段[15]。果实或种子的扩散方式是由扩散媒介及与扩散相关的自身特征所决定的[16],种子大小、果皮或果实结构及果实开裂方式对扩散起决定作用[17]。例如,具冠毛、翅、苞片及其他传播结构的种子或果实适应于风媒扩散,而具有针、刺或芒结构的种子或果实则以动物为媒介进行扩散[18-19]。大赖草去稃种子的降落速度比带稃种子快,且在相同风速条件下扩散距离较近,可见,稃不仅能增加种子在空气中的浮力,同时有利于种子扩散至较远的环境,使大赖草能够拓展新的生存空间,增加其生存和扩大种群的机会。
果皮、种皮、苞片、果翅及粘液层等附属物结构不仅对果实或种子的扩散有影响,对种子萌发也有影响[20]。月桂(Laurus nobilis Linn.)的果皮和种皮共同抑制种子萌发,也即果皮完全抑制种子萌发、种皮部分抑制种子萌发[7];野萝卜(Raphanus raphanistrum Linn.)的种皮对其种子萌发的抑制性强于其果皮[8];稃能抑制针茅(Stipa tenacissima Linn.)种子吸水并显著影响其种子萌发率[21]。大赖草带稃种子和去稃种子的萌发率分别为99%和97%;而将去稃种子与稃一起培养,种子萌发率为98%,说明稃对大赖草种子萌发有一定促进作用,但这一作用的效果不显著。某些十字花科(Brassicaceae)植物的种子表面具有粘液物质,有助于种子吸水和保水,以满足在干旱环境中种子萌发所需的基本条件[19],而大赖草种子的稃也很可能具有类似的作用。
种子活力即种子健壮度,是种子发芽和出苗率、幼苗生长潜势、植株抗逆能力和生产潜力的总和,是种子品质的重要指标。扩散至地表的种子活力除受温度、光照、降水和土壤肥力等因素的影响外,还受种子本身特征的影响。杨期和等[22]发现:果皮有利于种子长期保持较强活力。在60℃条件下处理24 h,大赖草带稃和去稃种子的活力明显下降但差异不显著,说明在荒漠较高的地表温度下,稃对保持大赖草种子活力无显著影响。而在野外置于土壤表面90 d后,大赖草带稃和去稃种子的活力均较高但差异不显著,说明放置在地表的种子可从土壤中吸收水分使种子保持一定的活力。在极端环境中,长期保持种子活力有利于植物种群的保存和基因库的增强[23]。
果皮和种皮能控制种子的吸水和失水,其原因是果皮和种皮可增加种子的吸水表面积,促使种子迅速吸水;相反,覆盖于种子外面的果皮会减缓种子的吸水速率[24]。大赖草带稃种子的吸水速率比去稃种子慢,吸水达到饱和及失水后恢复到干质量所需的时间均较长,说明稃对大赖草种子的吸水和失水均有抑制作用。该结果与细枝岩黄蓍(Hedysarum scoparium Fisch.et Mey.)[20]、石茅〔Sorghum halepense(Linn.)Pers.〕[25]和野萝卜[8]等植物的表现相同。由此可见,在干旱荒漠环境中,大赖草种子可利用稃限制其种子失水以逃避极端干旱环境,提高其生态适应性。
综上所述,大赖草种子带稃脱落,稃不仅有利于其种子扩散,同时可保持其种子含水量,避免种子快速吸水和失水,增强其对干旱环境的适应能力。
[1]王国宏,周广胜.甘肃木本植物区系生活型和果实类型构成式样与水热因子的相关分析[J].植物研究,2001,21(3):448-455.
[2]VENABLE D L,LAWLOR L.Delayed germination and dispersal in desert annuals:escape in space and time[J].Oecologia,1980,46:272-282.
[3]De CLAVIJO R E.Heterocarpy and seed polymorphism in Ceratocapnos heterocarpa(Fumariaceae)[J].International Journal of Plant Sciences,1994,155(2):196-202.
[4]ERIKSSON A,ERIKSSON O.Seedling recruitment in semi-natural pastures:the effects of disturbance,seed size,phenology and seed bank[J].Nordic Journal of Botany,1997,17(5):469-482.
[5]BRÄNDEL M.Dormancy and germination of heteromorphic achenes of Bidens frondosa[J].Flora,2004,199(3):228-233.
[6]SARI A O,OGUZ B,BILGIC A.Breaking seed dormancy of laurel(Laurus nobilis L.)[J].New Forests,2006,31(3):403-408.
[7]COUSENS R D,YOUNG K R,TADAYYON A.The role of the persistentfruitwallin seed water regulation in Raphanus raphanistrum(Brassicaceae)[J].Annals of Botany,2010,105(1):101-108.
[8]马国华,赵南先,黄学林.禾本科植物无融合生殖(综述)[J].热带亚热带植物学报,2001,9(1):83-92.
[9]孙海群.青海禾本科植物的生物多样性分析[J].草业科学,2002,19(2):7-12.
[10]崔乃然.新疆植物志:第六卷[M].乌鲁木齐:新疆科技卫生出版社,1996:214.
[11]刘 宇,周桂玲.不同处理对大赖草种子萌发的影响[J].新疆农业大学学报,2008,31(4):5-10.
[12]王 超,迪利夏提·哈斯木,周桂玲.不同环境因素对大赖草种子萌发的影响[J].新疆农业大学学报,2011,34(6):469-473.
[13]BASKIN J M,BASKIN C C.A classification system for seed dormancy[J].Seed Science and Research,2004,14(1):1-16.
[14]HARPER J L.Population Biology of Plants[M].New York:Academic Press,1977.
[15]HOWE H F,SMALLWOOD J.Ecology of seed dispersal[J].Annual Review of Ecology and Systematics,1982,13:201-228.
[16]SINHA A,DAVIDAR P.Seed dispersal ecology of a wind dispersed rain forest tree in the western Ghats,India[J].Biotropica,1992,24(4):519-526.
[17]WENDER N J,POLISETTY C R,DONOHUE K.Densitydependent processes influencing the evolutionary dynamics of dispersal:a functional analysis of seed dispersal in Arabidopsis thaliana(Brassicaceae)[J].American Journal of Botany,2005,92(6):960-971.
[18]WERKER E.Seed Anatomy[M].Berlin:Gebrüder Borntraeger,1997.
[19]刘晓风,谭敦炎.荒漠植物种子粘液的生态学意义[J].植物学通报,2007,24(3):414-424.
[20]HU X W,WANG Y R,WU Y P.Effects of the pericarp on imbibition,seed germination and seedling establishment in seeds of Hedysarum scoparium Fisch.et Mey.[J].Ecological Research,2009,24:559-564.
[21]GASQUE M,GARCÍA-FAYOS P.Seed dormancy and longevity in Stipa tenacissima L.(Poaceae)[J].Plant Ecology,2003,168(2):279-290.
[22]杨期和,尹小娟,叶万辉.硬实种子休眠的机制和解除方法[J].植物学通报,2006,23(1):108-118.
[23]GUTTERMAN Y.Seed Germination in Desert Plants[M].Berlin:Springer-Verlag,1993.
[24]POWELL A A,OLIVEIRA M A,MATTEWS S.The role of imbibition damage in determining the vigour of white and coloured seed lots of dwarf French beans(Phaseolus vulgaris)[J].Journal of Experimental Botany,1986,37(5):716-722
[25]TAO K J.Improving the germination of Johnsongrass seeds[J].Journal of Seed Technology,1982,7(1):1-9.
