花生果针向地性弯曲过程中内源激素变化分析
2013-12-13李海芬陈小平洪彦彬刘海燕梁炫强
李海芬,陈小平,洪彦彬,刘海燕,李 玲,梁炫强*
(1. 广东省农业科学院作物研究所,广东广州510640;2. 华南师范大学生命科学院,广东广州510631)
花生(Arachis hypogaea L.)在植物界中具一个独特的“地上开花,地下结果”生长现象,这种现象称“花生果针向地性”.花生果针在花生整个生育周期中发挥重要的作用,花生胚珠一旦授精,果针就携带幼小的种子(受精胚珠)伸长,并呈向下生长,进入土壤后幼小的种子发育成熟形成荚果[1].
自19 世纪末,DARWIN[2]首次描述花生果针向地性以及果针生长过程和环境条件以来,有关果针向地性的问题一直引起人们的关注[3-5]. 花生果针和荚果的整个生长和发育过程受到各种内源激素的调节. SHUSHU 等[6]对吲哚乙酸(IAA),赤霉素(GA)和细胞分裂素(CTK)在果针生长过程中的作用进行了研究,认为IAA 和GA 对果针的伸长起作用,CTK 则主要作用于果针细胞分裂的早期阶段.SHLAMOVITZ 等[7]发现乙烯在果针入土过程中有轻微增加,IAA 在整个过程中保持不变,脱落酸则在入土后减少了5 倍之多. 但这些研究主要集中于植物内源激素在花生荚果形成的整个过程中所起的作用.由于实验条件的制约,有关植物内源激素与果针向性关系的研究除了少数集中于IAA,对于其他激素的研究报道尚少.
本文以授粉后12~15 d 的果针为材料,采用离体培养的方式,通过比较正置(果针尖端向下,与自然生长方向一样)和倒置(果针尖端向上,与自然生长方向相反)离体培养果针生长早期发生向地性反应时主要植物内源激素(IAA、GA、ABA 和CTK)的差异,研究内源激素与果针向地性的关系,这对了解花生果针向地性机理具有一定的理论意义.
1 材料和方法
1.1 植物材料及处理
供试花生(Arachis hypogaea L.)品种为粤油7号,由广东省农科院作物研究所提供.2010年春季大田栽培,按正常方式管理.在开花后12 d,选取健壮植株第2 节位,长约4~5 cm,生长粗细一致的花生果针,自来水冲洗干净,体积分数为70%酒精表面消毒5 s,再用质量分数为0.1%升汞表面消毒10 min,无菌水冲洗3 次,然后将果针顶端1 cm(带子房和部分子房柄)切下,分别进行正置(果针顶端朝下,以D 表示)与倒置(果针顶端朝上,以U 表示)垂直插入培养基(约0.3 cm)中,置人工气候箱中避光离体培养6、12 h 之后,分别切取果针顶部(约6~8 mm),备用.每个试验重复3 次.
1.2 内源激素的测定
1.2.1 内源激素的提取 称取新鲜样品1 g(图2~图5 数据都以鲜重计)于研钵,加入少许的抗氧化剂二乙基二硫代氨基甲酸钠,将冷冻后的样品在液氮中研成粉末;加入5 mL 体积分数(下同)为80%的冷甲醇溶液,密封4 ℃下静置浸提12 h,离心30 min(2 000 r/min)取上清液;加3 mL 80%的冷甲醇溶液振荡摇匀数小时,离心20 min 取上清液,将其真空冷冻离心,40 ℃下旋转减压蒸发,除去甲醇;采用等体积的三氯甲烷萃取3 次,去除色素,水相用1 mol/L HCl 将pH 调至2.5~2.8;用等体积乙酸乙酯萃取3 次,将萃取获得水相(下层)与乙酸乙酯(上层)分别合并(水相合并,乙酸乙酯相合并). 将水相调pH 8.0~8.5,用水饱和正丁醇(体积分数85%)萃取3 次,弃水相. 正丁醇相用氮气吹干,残留物用500 μL 100%甲醇溶解,过0.45 μm 有机滤膜后进行HPLC 分析(6-BA). 乙酸乙酯相旋转减压蒸发(40 ℃),残留物用500μL 100%甲醇溶解,过0.45 μm 有机滤膜后进行HPLC 分析(IAA、ABA、GA3).
1.2.2 内源激素的检测与分析 用LC-6A 高效液相色谱仪进行测定.检测器为紫外可见型SPD-6AV,色谱柱Kromasil C18 (150 mm×4.6 mm,5 μrn),标样IAA、GA3、ABA、6-BA 均为Fluka 高效液相色谱仪专用试剂,所用色谱甲醇和乙腈均为德国默克公司生产.检测条件:1 mL/min,柱温35 ℃,进样量10 μL.以标样出峰时间和峰高叠加定性,外标法峰面积定量,按照以下公式计算:

每个处理检测3 次,统计时取平均数,并按统计学方法进行差异显著性测定.
2 结果与分析
2.1 离体培养花生果针向地性反应
将离体果针以不同角度(图1)插入不含任何激素的MS 培养基中避光培养6 h 后,除了正置培养(与果针自然生长状态一样)的果针外,其它以不同角度插入离体培养的果针均发生不同程度的向地性弯曲;离体培养12 h 后弯曲程度加深,倒置果针发生90°弯曲,显著呈正向性反应.
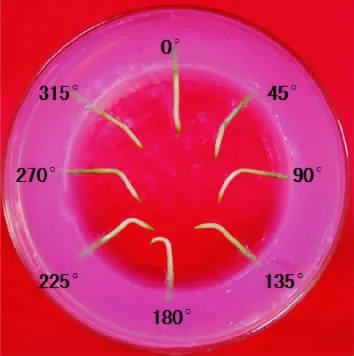
图1 不同角度离体培养12 h 后的花生果针Figure 1 Peanut gynophores grown in vitro with different angles at 12 h of culture
2.2 正置与倒置离体培养花生果针内源激素的变化
为了解花生果针在向地性弯曲过程中主要内源激素的变化规律,以正置和倒置离体培养6 h 和12 h的果针为材料分别检测GA3、IAA、ABA 和6-BA 等含量的变化规律.
2.2.1 GA3质量分数差异分析 正常活体果针GA3质量分数约为3 674 μg/g(图2). 正置果针培养6 h 后,GA3质量分数达6 046 μg/g,提高65%(P<0.05);培养12 h 后,下降到2 669 μg/g. 与正置相反,倒置果针培养6 h 后,GA3质量分数略有上升;12 h 后,达5 306 μg/g,较正置同期增加88%,差异显著(P <0.05),初步表明GA3浓度变化与果针向地性弯曲有关.
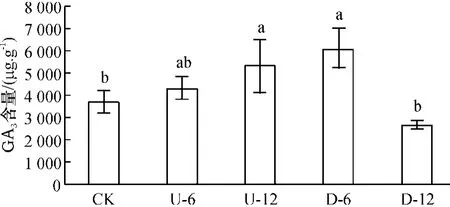
图2 果针正置和倒置离体培养6 h 和12 h 内源GA3 质量分数变化Figure 2 Change of GA3 content in peanut gynophores grown in vitro with tip pointing upward at 6 h,12 h,and downward at 6 h and 12 h
2.2.2 IAA 质量分数差异分析 果针IAA 的质量分数低,正置和倒置果针在离体培养过程中,IAA 的质量分数虽然有所变化,但未达显著标准(P >0.05)(图3).

图3 果针正置和倒置离体培养6 h 和12 h 内源IAA 质量分数变化Figure 3 Change of IAA content in peanut gynophores grown in vitro with tip pointing upward at 6 h,12 h,and downward at 6 h and 12 h
2.2.3 ABA 质量分数差异分析 ABA 在果针中的质量分数较低,果针在正置生长过程中,ABA 的质量分数逐渐增加,正置12 h 后增加了80%,并达显著水平(P <0.05)(图4);而倒置果针离体培养并发生果针弯曲后,ABA 的质量分数逐下降,但未达显著水平(P >0.05),显示ABA 的质量分数度变化可能与果针向地弯曲有关.
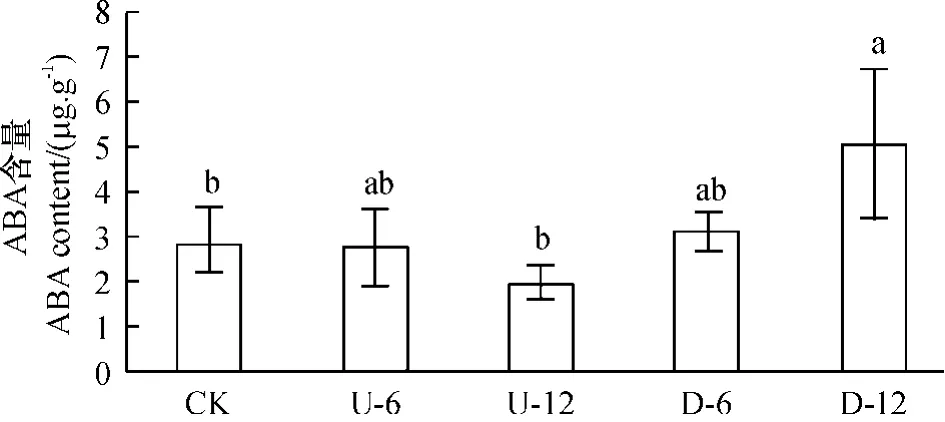
图4 果针正置和倒置离体6 h 和12 h 内源ABA 质量分数变化分析Figure 4 Change of ABA content in peanut gynophores grown in vitro with tip pointing upward at 6 h,12 h,and downward at 6 h and 12 h
2.2.4 6-BA 质量分数差异分析 离体正置果针在培养的12 h 内,6-BA 的质量分数缓慢减少,未达显著水平(P >0.05)(图5);与此相反,倒置果针在离体培养12 h 后,6-BA 的质量分数达61.9 μg/g,是正置同期的7.2 倍(P <0.05),表明CTK 的质量分数变化与果针向地性弯曲、细胞分裂活动加剧有关.
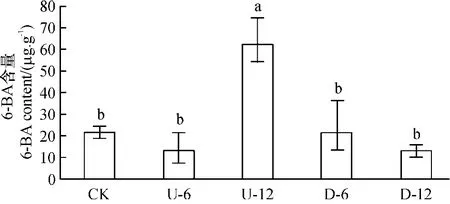
图5 果针正置和倒置离体6 h 和12 h 内源6-BA 质量分数变化分析Figure 5 Change of 6-BA content in peanut gynophores grown in vitro with tip pointing upward at 6 h,12 h,and downward at 6 h and 12 h
3 讨论
花生地下结实性是植物独特的一种现象,引起众多学者的关注.一直以来,研究花生向地性均以活体果针为材料,但受限于个体发育时期和实验处理等因素,相关的研究开展并不多.本文采用果针离体培养的方式研究向地性,发现离体果针能够自主吸收水分和营养物质来维持自身正常生长,并能感受重力刺激呈明显的正向地性反应,因此花生果针离体培养是研究植物组织和器官正向地性的最好材料和方式.
植物激素作为执行细胞通讯的化学信息在代谢、生长、形态建成等植物生理活动的各个方面均起着十分重要的作用.由于IAA 的功能主要与植物细胞分裂,细胞生长,极性反应和诱导果实座果有关[8],因此前期有关果针向地性研究主要集中于IAA[6,9-10].相关的研究表明IAA 产生于果针顶端并作用于荚果发育的整个过程. 切除果针顶端或人工施用IAA 转运抑制剂能显著抑制果针生长,而施用一定数量的IAA 于果针切口端可使果针恢复生长[6,11-12].同样,去除顶端的果针施用IAA 可使果针 发 生 向 地 性 弯 曲[13]. MOCTEZUMA 和FELDMAN[14]发现当活体果针水平放置时,IAA 主要聚集果针远地面一侧的皮层和表皮细胞,而在近地面一侧却检测不到,因此认为高浓度IAA 在果针生长最快部位的聚集是引起果针向地性弯曲的原因之一.另外,在本研究中作者发现6-BA 在倒置过程中显著增加,因此推测其可能与果针发生弯曲时细胞分裂有关,这与SHUSHU 等[6]所认为的细胞分裂素主要作用于果针细胞分裂的早期阶段一致.同时ALONI[15]也认为在拟南芥根向地性信号转导的过程中,细胞分裂素参与了从根冠到伸长区的信号传导. 但目前有关赤霉素和脱落酸在花生果针向地性过程中的作用未见报道.
[1]MOCTEZUMA E. The peanut gynophore:A developmental and physiological perspective[J]. Can J Bot,2003,81:183-190.
[2]DARWIN C. The power of movement in plants[D]. New York:Appleton Co,1881.
[3]JACOBS W. The development of the gynophore of the peanut plant,Arachis hypogaea L:The distribution of mitoses,the region of greatest elongation,and the maintenance of vascular continuity in the intercalary meristem[J]. Am J Bot,1947,34:361-370.
[4]SMITH B W. Arachis hypogaea:Aerial flower and subterranean fruit[J]. Am J Bot,1990,37:802-815.
[5]ZIV M,ZAMSKI E. Geotropic responses and pod development in gynophore explants of peanut (Arachis hypogaea L.)cultured in vitro[J]. Ann Bot(London),1975,39:579-583.
[6]SHUSHU D D,CUTTER E G. Growth of the gynophore of the peanut Arachis hypogaea:2:Regulation of growth[J]. Can J Bot,1990,68:965-978.
[7]SHLAMOVITZ N,ZIV M,ZAMSKI E. Light,dark and growth regulator involvement in groundnut (Arachis hypogaea L.)pod development[J]. Plant Growth Regul,1995,16:37-42.
[8]DAVIES P J. The plant hormones:Their nature,occurrence and function[C]∥DAVIES P J. In Plant hormones:Physiology,biochemistry and molecular biology.Netherlands:Dortrecht,1995:1-12.
[9]SHUSHU D D,CUTTER E G. Growth of the gynophore of the peanut Arachis hypogaea:1:Intact and decapitated gynophores[J]. Can J Bot,1990,68:955-964.
[10]MOCTEZUMA E,FELDMAN L J. Auxin redistributes upwards in graviresponding gynophores of the peanut plant[J].Planta,1999,209:180-186.
[11]JACOBS W. Auxin relationships in an intercalary meristem:further studies on the gynophore of Arachis hypogaea L.[J]. Am J Bot,1951,38:307-310.
[12]MOCTEZUMA E,FELDMAN L J.Growth rates and auxin effects in graviresponding gynophores of the peanut,Arachis hypogaea (Fabaceae)[J]. Am J Bot,1998,85:1369-1376.
[13]MOCTEZUMA E,FELDMAN L J. IAA redistributes to the upper side of gravistimulated peanut (Arachis hypogaea)gynophores[J]. Plant Physiol,1996,111:S73.
[14]MOCTEZUMA E,FELDMAN L J. The role of amyloplasts during gravity perception in gynophores of the peanut plant (Arachis hypogaea)[J]. Ann Bot (London),1999,84:709-714.
[15]ALONI R,LANGHANS M,ALONI E,et al. Role of cytokinin in the regulation of root gravitropism[J]. Planta,2004,220:177-182.
