败酱草乙醇提取物对人结肠癌细胞Caco-2凋亡与增殖的影响
2013-12-07陈婷婷
黄 炜,杨 斌,陈 阳,黄 琰,张 伟,杨 芳,陈婷婷
(福州市中医院,福建 福州 350001)
结、直肠癌是一类常见的恶性肿瘤,目前全球每年新增发病例数高达120万,每年近60万人死于大肠癌;其发病率和死亡率在全部恶性肿瘤中居第3位[1]。手术、化疗、放疗仍然是目前常用的3种主要治疗方式。虽然手术被认为是目前该病的主要治疗手段,但仍有50%患者接受手术治疗后出现复发[2]。对于术后复发及失去手术机会或转移性大肠癌患者,化疗则是主要的治疗手段。尽管5-Fu、顺铂、依立替康等化疗药物的不断发展和联合在临床上广泛应用在一定程度上提高了患者对化疗的反应率,然而大肠癌的化疗疗效并没有出现显著改善,其中位生存期仍仅为20~28个月[3]。这使得临床疗效确切、毒副作用少的中药复方逐渐受到国内外研究者的重视[4-5]。
败酱草(Patrinia scabiosaefolia,PS)为败酱科植物白花败酱草(Patrina villosaJuss,PVJ)和黄花败酱(Patrinia scabiosaefolia Fisch.ex Trev)的全草,味辛、苦,微寒;归肝、胃、大肠经;具有清热解毒、消肿排脓和祛瘀止痛之功效,广泛用于肠痈、肠炎、痢疾及消化道肿瘤等[6]。民间常用于对结肠癌的治疗,但其作用机理尚不完全清楚。因此我们进行了黄花败酱草对人结肠癌细胞株Caco-2增殖与凋亡的影响及其作用机制研究,现将结果报道如下。
1 实验材料
1.1 药材和细胞株 黄花败酱草购于自福建中医药大学国医堂(批号:101117);Caco-2购于中南大学湘雅中心实验室。
1.2 试剂 RPMI1640培养基、胰蛋白酶(trypsin),胎牛血清(fetal bovine serum,FBS)、Trizol,lifetechnology公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)干粉,DAPI染色液,江苏碧云天生物技术研究所;逆转录试剂盒、PCR Mix,Thermo公司;引物自行设计并由上海生工生物有限公司合成。
1.3 仪器 RE-2000旋转蒸发仪,上海亚荣生化仪器厂;DLSB-520低温冷却循环泵,郑州长城科工贸有限公司;B-290型实验室小型喷雾干燥机,瑞士Buchi;二氧化碳培养箱,HF212UV,Heal Force;荧光倒置显微镜,德国Leica公司;ELX800酶标仪,BioTek公司;PCR仪,Gel DOC 2000型凝胶成像分析系统、APC 300型电泳仪、水平式电泳槽,美国Bio-Rad公司;5417R高速冷冻离心机,德国Eppendorf公司。
2 实验方法
2.1 败酱草醇提物(EEPS)的制备 败酱草全草,加入8倍量的80%乙醇(8 L)加热回流提取2次,每次1 h。2次提取液过滤,滤液减压浓缩(50℃,0.01 MPa)至相对密度1.10,喷雾干燥(进出口温度140℃/80℃;)得干粉。称量适量提取物用50%DMSO和50%水溶解,配制成250 mg/mL的储存溶液,经震荡和超声后4℃保存备用,使用前用完全培养基稀释成所需的浓度并过滤。
2.2 细胞培养 Caco-2培养于含10%热灭活胎牛血清(FBS)、100 U/L 青霉素和 100 mg/L 链霉素的RPMI-1640培养基中,并放置于37℃、5%CO2饱和湿度的细胞培养箱中培养,待汇合率长至80%~90%传代。
2.3 MTT法测定败酱草对细胞活力的影响 取对数生长期的Caco-2,至80%~90%汇合时用0.25%胰酶消化后,离心收集细胞。用RPMI-1640完全培养基重悬,进行细胞计数,并配制成细胞密度为5×104个/mL细胞悬液,均匀接种于96孔培养板,每孔100 μL,放培养箱中培养过夜。设空白对照组(直接加入等体积培养基)和EEPS治疗组(终浓度分别为0.5、1、2 mg/mL),以上各组均设 8 个重复。继续培养24 h后,吸去各孔培养基,每孔各加入0.5 mg/mL的MTT溶液100 μL,继续在37℃条件下孵育4 h,吸去各孔MTT溶液,并在每孔中加入DMSO 100 μL,放振荡器上震荡使结晶充分溶解,于ELX800酶标仪在570 nm下检测各组吸光度值(即OD值),并按以下公式计算细胞增殖抑制率:

2.4 细胞形态学观察 Caco-2细胞用EEPS药物干预24 h后,用倒置显微镜观察细胞的形态变化并拍照。
2.5 DAPI染色检测细胞凋亡 对数生长的Caco-2细胞经胰酶消化后,取每孔1×105个细胞数接种于12孔板中,过夜后分别用不同浓度EEPS药物干预,继续培养24 h后弃培养基,PBS轻洗3遍,每孔加入1 mL 4%多聚甲醛,室温放置10 min。弃甲醛,PBS轻洗 3遍,加入 DAPI溶液 1 mL/孔,避光,37℃孵育20 min。染色后弃DAPI溶液,PBS轻洗3遍,除去多余的DAPI染色液。用荧光显微镜观察细胞核形态变化并拍照。
2.6 RT-PCR检测Bc1-2和Bax的mRNA表达Caco-2细胞胰酶消化后,取2×105个细胞每孔接种于6孔板中,细胞培养过夜后用不同浓度的EEPS干预24 h,培养板中细胞经PBS洗净后参照Trizol试剂说明书用Trizol法提取总RNA,经浓度测量后,取总RNA纯度符合实验要求(OD260/OD280在1.8~2.1之间)后样本的总RNA 1 μg,参照逆转录试剂盒说明书进行逆转录反应。PCR反应体系(20 μL体系):cDNA 1 μL,Mix 10 μL,上下游引物各 1 μL,加DEPC水补齐至20 μL,震荡混匀和离心后,置PCR仪中扩增。PCR产物经1.5%琼脂糖凝胶上电泳后进行光密度扫描,以GAPDH基因的表达为内参,根据条带的明暗和大小判断相关基因的表达量。具体的退火温度及引物序列见表1。
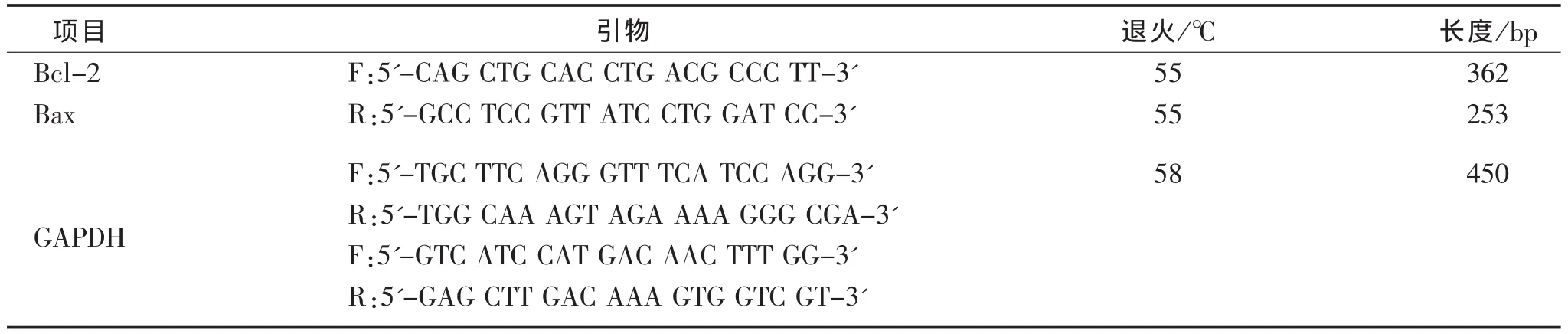
表1 PCR引物序列、退火温度及产物长度
2.7 统计学处理 所得数据采用SPSS16.0软件进行分析,并用表示,组间比较采用单因素方差分析(One-way ANOVA分析),P<0.05为差异有统计学意义)。
3 结 果
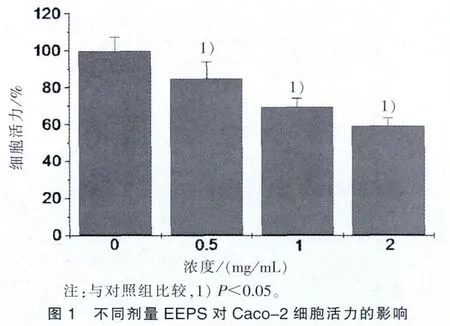
3.1 EEPS抑制Caco-2细胞增殖 见图1。
3.2 EEPS对Caco-2细胞形态的影响 见图2。
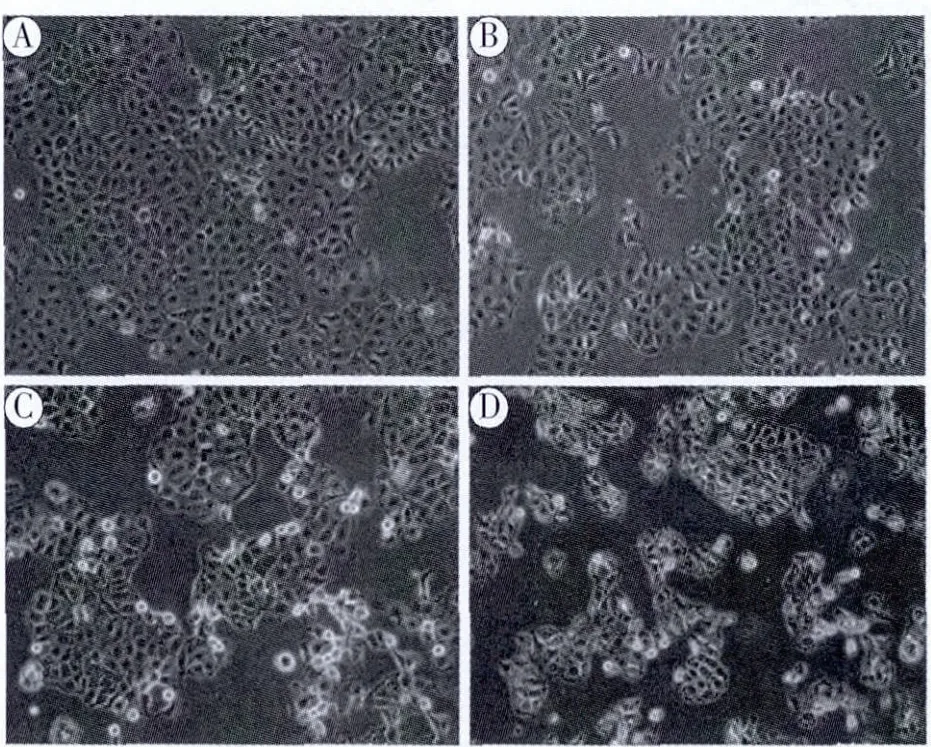
图2 不同浓度的EEPS对Caco-2细胞形态的影响
倒置显微镜下观察,空白对照组Caco-2细胞核仁清楚,胞质均匀,生长良好,形成贴壁的近圆形细胞。随着EEPS浓度的增加,可见细胞数量逐渐减少,细胞变小变圆,甚至部分出现皱缩等形态改变,当浓度为2 mg/mL时,细胞数明显减少,甚至死亡而悬浮、脱落。该结果显示败酱草醇提物能抑制Caco-2细胞的增殖和改变细胞形态的作用。
3.3 EEPS对Caco-2细胞凋亡的影响 见图3。
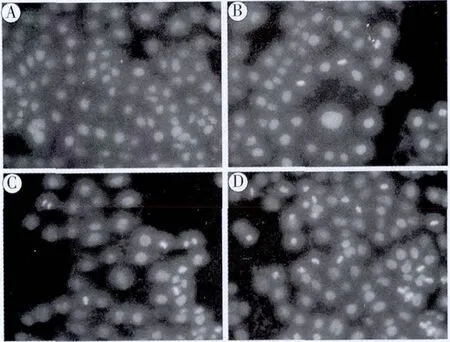
图3 不同浓度的EEPS对Caco-2细胞凋亡的影响
荧光显微镜下观察,可见空白对照组Caco-2细胞胞核完整,染色质均匀。在高浓度EEPS作用下,染色质固缩,呈现出高亮状态。
3.4 EEPS对Caco-2细胞Bcl-2和Bax的mRNA表达的影响 见图4。
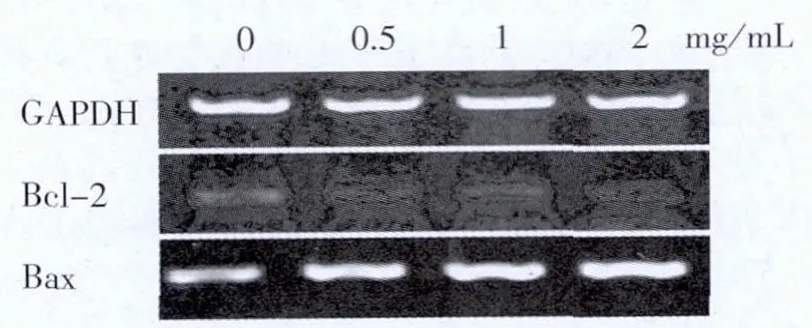
图4 不同浓度EEPS干预后Bcl-2、Bax的mRNA表达
Caco-2细胞经不同浓度EEPS药物干预24 h后,观察可得EEPS能明显地下调Bcl-2及上调Bax的mRNA表达,并且呈明显的量效作用。
4 讨 论
外科手术为主的综合治疗仍是结肠癌的首选治疗方式,但患者5年生存率仍然不高[7]。氟尿嘧啶等化疗药物仍是目前临床常用药物,但这些药物缺乏疾病的特异性,取得疗效的同时也往往给患者带来较大的毒副作用。因此,具有毒副作用小的中药日益受到国内外学者的关注和认可。
4.1 细胞过度增殖与细胞凋亡失调是肿瘤发生的主要原因。细胞凋亡是一种由基因控制的主动、高度有序的死亡过程[8]。因此抑制肿瘤细胞增殖和诱导凋亡一直是抗肿瘤研究的主要内容之一。其中Bcl-2家族是目前研究较为广泛和深入的一类基因。Bcl-2蛋白家族是调节线粒体凋亡途径的关键因子,包括Bcl-2为代表的抗凋亡基因和Bax为凋亡的促凋亡基因,且目前研究表明白花蛇舌草、半枝莲等清热解毒类中药具有促进结肠癌细胞凋亡的作用,且部分机制研究显示通过抑制Bcl-2的表达和上调Bax的表达可能是其内在机制[9-10]。
4.2 败酱草具有清热解毒、活血化瘀等功效。广泛应用于大肠癌等多种肿瘤的治疗,并在消化、呼吸、血液等恶性肿瘤治疗中取得较好的疗效。现代研究表明,其主要化学成分有熊果酸、免疫多糖、乌索酸、败酱草素等,这些有效成分具有增强免疫、抗氧化、抗肿瘤的活性[11]。本实验发现:体外培养的Caco-2细胞经不同浓度的EEPS作用后,MTT法检测显示随着败酱草乙醇提取物剂量的增加,对Caco-2细胞的抑制作用也相应增强;在倒置显微镜下观察到随药物浓度的增加,细胞生长受到抑制,细胞形态皱缩,甚至脱落而浮悬于培养液中;EEPS对能够明显下调抗凋亡蛋白Bcl-2的mRNA表达,且明显上调Bax的mRNA表达,具有显著的量效关系。
本实验表明:败酱草醇提物可诱导人结肠癌Caco-2细胞凋亡并抑制其增殖,且通过抑制Bcl-2的表达和促进Bax的表达可能是其内在机制。但本实验所用药物为提取物,发挥重要作用的成分尚不十分清楚,深层次抗肿瘤作用及机制研究和仍需进一步结合动物实验,有待进一步深入研究。
[1]JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]FANG Y J,LU Z H,WANG G Q,et al.Elevated expressions of MMP7,TROP2,and survivin are associated with survival,disease recurrence,and liver metastasis of colon cancer[J].Int J Colorectal Dis,2009,24(8):875-884.
[3]MONTAGNANI F,CHIRIATTI A,TURRISI G,et al.A systematic review of FOLFOXIRI chemotherapy for the first-line treatment of metastatic colorectal cancer:improved efficacy at the cost of increased toxicity[J].Colorectal Dis,2011,13(8):846-852.
[4]GORDALIZA M.Natural products as leads to anticancer drugs[J].Clin Transl Oncol,2007,9(12):767-776.
[5]JI H F,LI X J,ZHANG H Y.Natural products and drug discovery.Can thousands of years of ancient medical knowledge lead us to new and powerful drug combinations in the fight against cancer and dementia?[J].EMBO reports,2009,10(3):194-200.
[6]高学敏.中药学[M].北京:中国中医药出版社,2002:140-142.
[7]PETO J.Cancer epidemiology in the last century and the next decade[J].Nature,2001,411(6835):390-395.
[8]许守明,陈双喜,何艳霞.细胞凋亡与细胞色素C[J].安徽农学通报,2009,15(15):38-39.
[9]彭军,林久茂,魏丽慧,等.白花蛇舌草提取物对结肠癌HT-29细胞bcl-2和 bax表达的影响[J].福建中医学院学报,2010,20(5):23-26.
[10]彭军,林久茂,魏丽慧,等.半枝莲提取物诱导结肠癌HT-29细胞凋亡的机制研究[J].福建中医药大学学报,2010,20(6):35-39.
[11]单保恩,张金艳,杜肖娜,等.白花蛇舌草的免疫调节活性和抗肿瘤活性[J].中国中西医结合杂志,2001,21(5):370-374.
